固相萃取-气相色谱/质谱法测定人参种植土壤中48种农药残留
姚蕴恒, 吴信子, 白龙律, 田海峰, 任秀丽
(1.延边朝鲜族自治州产品质量检验所,吉林延吉 133000;2.延边大学工学院,吉林延吉 133002)
人参(Ginseng)作为一种珍贵的中草药,主产于中国、韩国、日本等东亚国家[1]。由于药用价值极高,人们对其药理和生物活性进行广泛研究[2]。其成分不仅能够提高人体免疫能力,而且对神经类疾病、糖尿病、心血管类疾病等有良好的治疗和预防效果[3 - 5]。众所周知,人参的生长周期一般在5至6年,有的甚至10年。这样一个长周期的种植与农药的使用是必不可分的,其中以除草剂、杀虫剂、杀菌剂、发芽抑制剂为主,它们的使用可以保护人参免受病菌、杂草与害虫的破坏[6]。然而,不合理的使用农药可能导致部分农药没有被利用而直接迁移到土壤当中。由于农药固有的高毒性和难降解性,在土壤中的残留长期积累不仅会对环境和公共卫生造成巨大威胁,而且不利于重茬种植[7]。其高毒性会直接干扰人体各重要器官的功能,最终导致呼吸麻痹和死亡[8]。因此,发展敏捷、可靠的分析方法检测人参种植土壤中农药残留是人身健康、环境安全的重要保障。
土壤是由矿物质、有机质、水、空气及微生物等多组分构成的复杂体系,因此,如何去除基质干扰是当前面临的主要问题。目前,样品前处理的主要方法有液-液萃取法[9]、索氏提取法[10]、加速溶剂萃取法[11]、固相萃取法(SPE)[12]、QuEChERS法[13,14]。SPE是众多前处理方法中使用最多的一种,该方法操作简便、提取率高、溶剂消耗量少且固相萃取柱能够最大限度的除去基质干扰。目前,关于人参种植土壤中农药残留分析的报道较少,且主要以气相色谱(GC)和液相色谱(LC)为检测手段。近年来,随着农药残留检测技术的快速发展,气相色谱-质谱(GC/MS)联用技术凭借抗干扰能力强、应用范围广等优势,已经成为痕量分析的首选[15,16]。本文采用固相萃取法,结合GC/MS联用技术,建立了一种人参种植土壤中48种农药残留的检测方法。该方法灵敏度高、准确性好,适合批量样品检测,有很强的实用意义,为人参种植土壤中农药残留的检测开辟了新途径。
1 实验部分
1.1 主要仪器、试剂与材料
TSQ 8000 Evo气/质联用仪(美国,Thermo Fisher Scientific公司);KQ3200型超声波振荡仪(昆山市超声仪器有限公司);EVA 50A型多功能样品浓缩仪(北京普立泰科仪器有限公司)。固相萃取柱:NH2(1 000 mg/6mL)、C18(2 000 mg/12mL)、Florisil(1 000 mg/6mL)、PestiCarb(500 mg/6mL)均购于Agela Technologies(天津(中国))。
48种农药的标准溶液(100 μg/mL)购于农业部环境保护科研检测所。用正己烷分别将各标准溶液稀释10倍,配制成质量浓度为10 mg/L的单标储备液,储存于4 ℃冰箱中,备用。分别准确吸取适量单标储备液,用正己烷稀释定容,制成各农药组分质量溶度均为1.0 mg/L的混合标准储备液,于4 ℃冰箱中保存,备用。乙腈、石油醚、丙酮、二氯甲烷、甲醇、正己烷(色谱纯,美国Fisher Chemical公司);NaCl(优级纯,天津科密欧化学试剂有限公司)。水(色谱纯,德国CNW Technologies公司)。
1.2 色谱/质谱条件
色谱条件:TG -5MS色谱柱(30 m×0.25 mm×0.25 μm;美国Thermo Fisher Scientific公司)。进样口温度为290 ℃。程序升温:初始温度40 ℃,保持1 min;然后以30 ℃/min升至130 ℃;再以5 ℃/min升至250 ℃;最后以10 ℃/min升至300 ℃,保持5 min;载气:氦气(纯度≥99.999%);恒流模式,流速为1.0 mL/min;进样方式:不分流进样;进样量:2 μL;总运行时间为38 min。
质谱条件:电子轰击电离(EI);轰击能量:70 eV;接口温度:220 ℃;离子源温度:280 ℃;四极杆温度:150 ℃;碰撞气:氩气(纯度≥99.999%);溶剂延迟时间:5 min;扫描方式:选择离子监测(SIM)模式。Xcalibur工作站软件用于仪器控制与数据处理。48种农药的保留时间、定量离子和定性离子见表1。
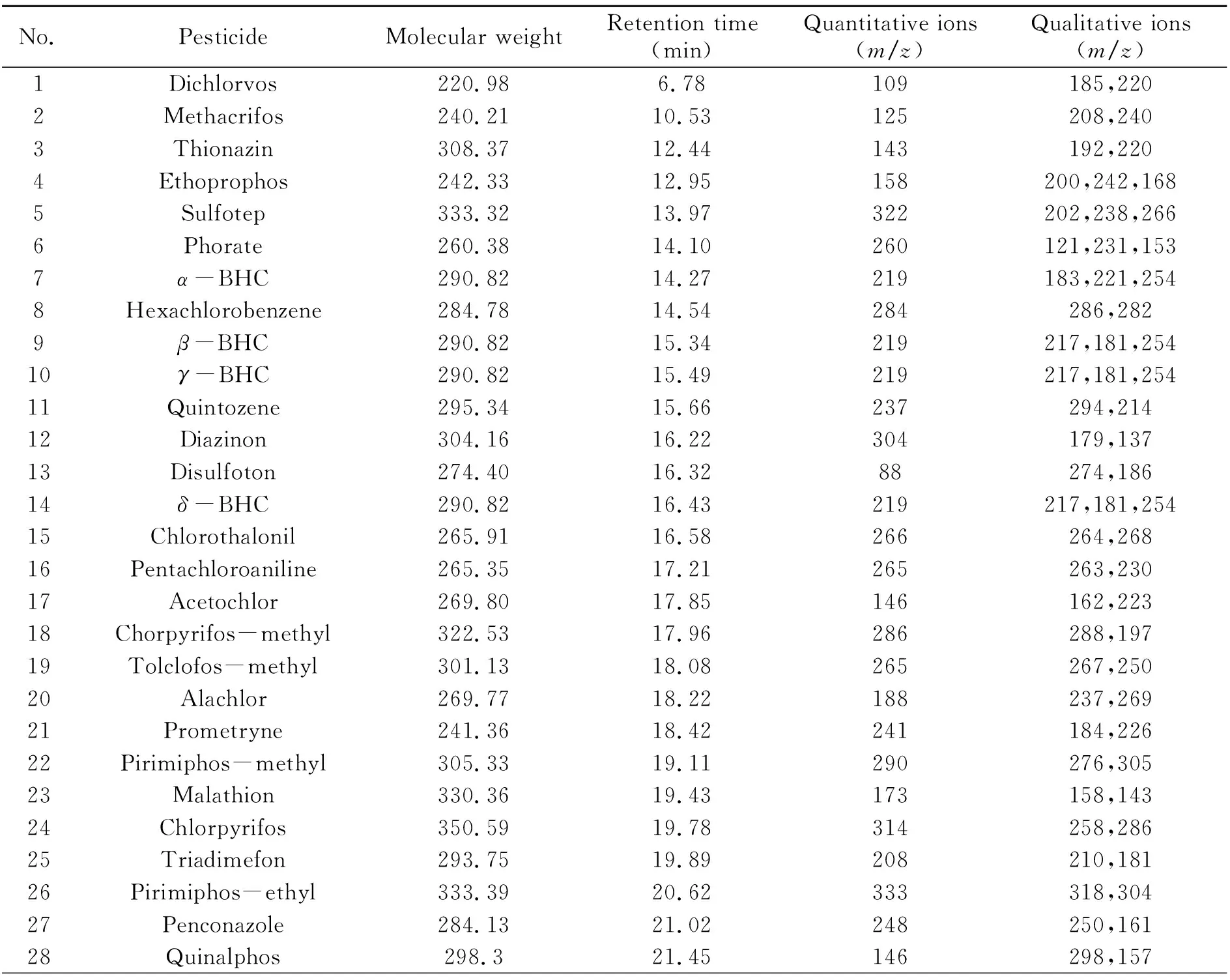
表1 48种农药的相对分子质量、保留时间、定量离子和定性离子
(续表1)
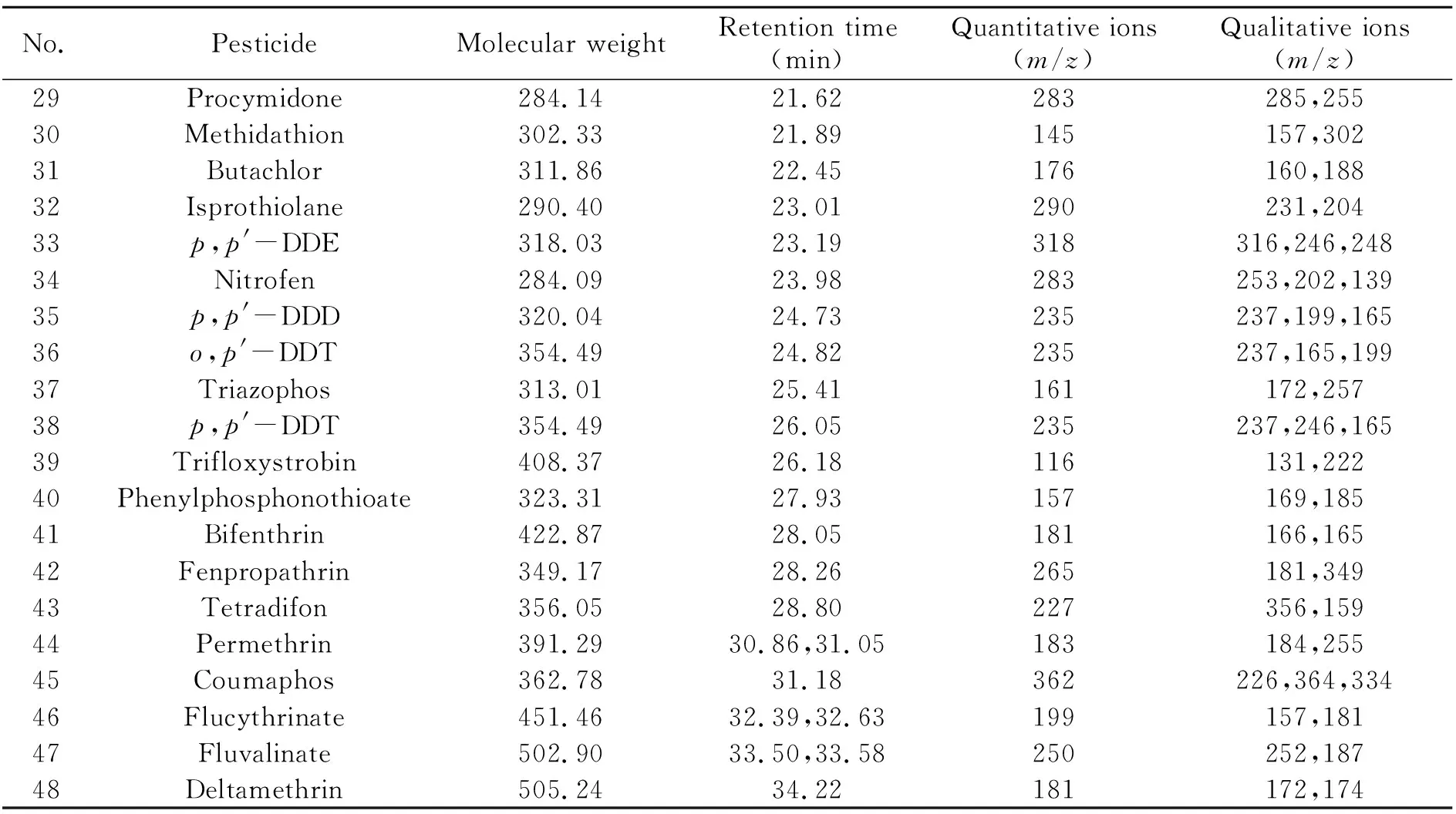
No.PesticideMolecular weightRetention time(min)Quantitative ions(m/z)Qualitative ions(m/z)29Procymidone284.1421.62283285,25530Methidathion302.3321.89145157,30231Butachlor311.8622.45176160,18832Isprothiolane290.4023.01290231,20433p,p'-DDE318.0323.19318316,246,24834Nitrofen284.0923.98283253,202,13935p,p'-DDD320.0424.73235237,199,16536o,p'-DDT354.4924.82235237,165,19937Triazophos313.0125.41161172,25738p,p'-DDT354.4926.05235237,246,16539Trifloxystrobin408.3726.18116131,22240Phenylphosphonothioate323.3127.93157169,18541Bifenthrin422.8728.05181166,16542Fenpropathrin349.1728.26265181,34943Tetradifon356.0528.80227356,15944Permethrin391.2930.86,31.05183184,25545Coumaphos362.7831.18362226,364,33446Flucythrinate451.4632.39,32.63199157,18147Fluvalinate502.9033.50,33.58250252,18748Deltamethrin505.2434.22181172,174
1.3 样品前处理
1.3.1 提取人参种植土壤样品为延边地区的某人参种植基地随机采取的土壤,取样品200 g置于均质机中搅拌,干燥,备用。准确称取10 g(精确至0.01 g)搅拌混匀的样品至250 mL离心瓶中,用2 mL水润湿,加入50 mL乙腈,加入5 g NaCl;旋好盖子后,室温下(25 ℃)超声振荡20 min,3 500 r/min离心5 min;移取有机层溶液10 mL至150 mL鸡心瓶中,40 ℃减压旋转蒸发至干,用2 mL甲醇-二氯甲烷(体积比为1∶19)溶解残渣(必要时可涡旋混合),所得溶液待净化。
1.3.2 净化固相萃取柱用5 mL二氯甲烷活化,将上述提取液过柱,再依次用5 mL、5 mL、5 mL甲醇-二氯甲烷(体积比为1∶19)过柱,所得的洗脱液40 ℃水浴中氮吹至干,向其中加入2 mL正己烷复溶,并过0.22 μm有机相滤膜,装瓶,待测。
1.4 共萃取基质的测定
基质匹配混合标准溶液按照“1.3”节步骤提取不含目标化合物的“空白”样品,获得的提取液为稀释溶剂,制备成系列质量浓度为0.005、0.01、0.025、0.05、0.1、0.25 μg/mL的基质匹配标准溶液。
通过质量测定法来考察使用不同萃取剂最终所得的提取液中共萃取基质的含量,萃取剂提取后未净化的萃取液为初级萃取液,净化后的萃取液为最终萃取液。分别将2 mL初级萃取液和最终萃取液置于10 mL已称重的离心管中,氮气吹干后于80 ℃干燥1 h,冷却后至恒重,与原离心管重量之差即为共萃取基质的含量。
2 结果与讨论
2.1 色谱和质谱条件的优化
48种农药的分子极性相对较弱,因此选择极性较小的TG -5MS石英毛细管色谱柱进行分离。首先进行全扫描以获得48种农药的保留时间和质谱图;再根据质谱图选择质荷比较大、强度较高的特征离子作为监测离子。经反复优化,确定48种农药的保留时间、定量离子和定性离子(表1)。在上述优化条件下,48种农药标准溶液(50 μg/kg)的总离子流色谱图见图1,可以看出48种农药的色谱峰形好且被较好分离。
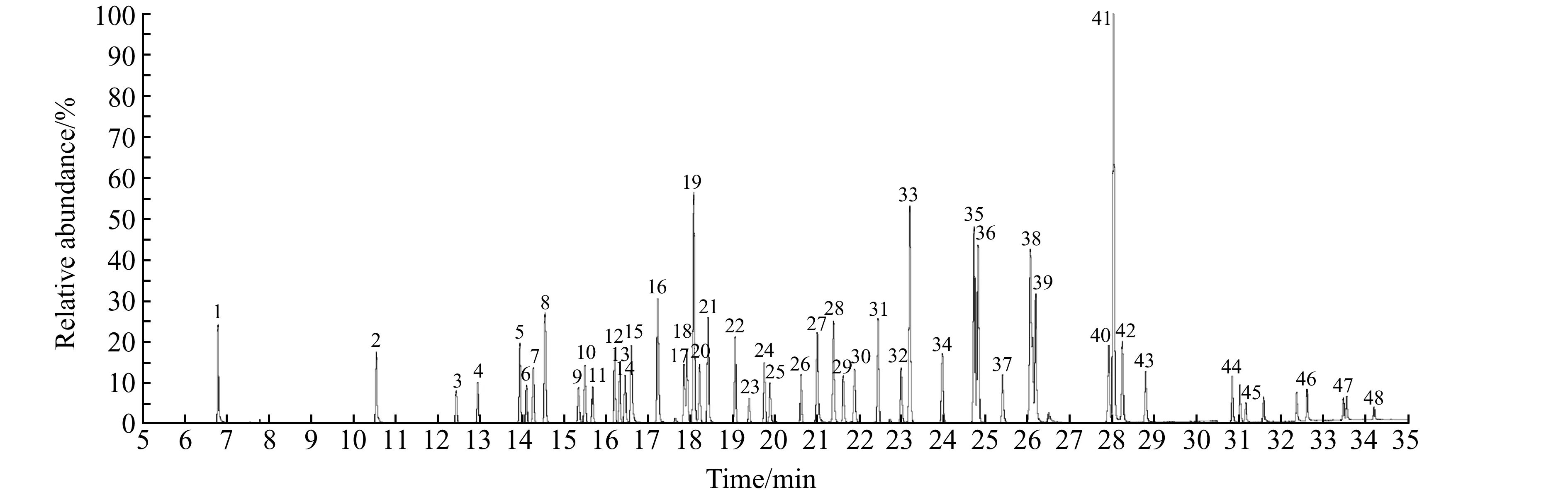
图1 48种农药混合标准溶液(50 μg/kg)的总离子流色谱图Fig.1 Total ion current chromatogram of a mixed standard solution of the 48 pesticides(50 μg/kg)
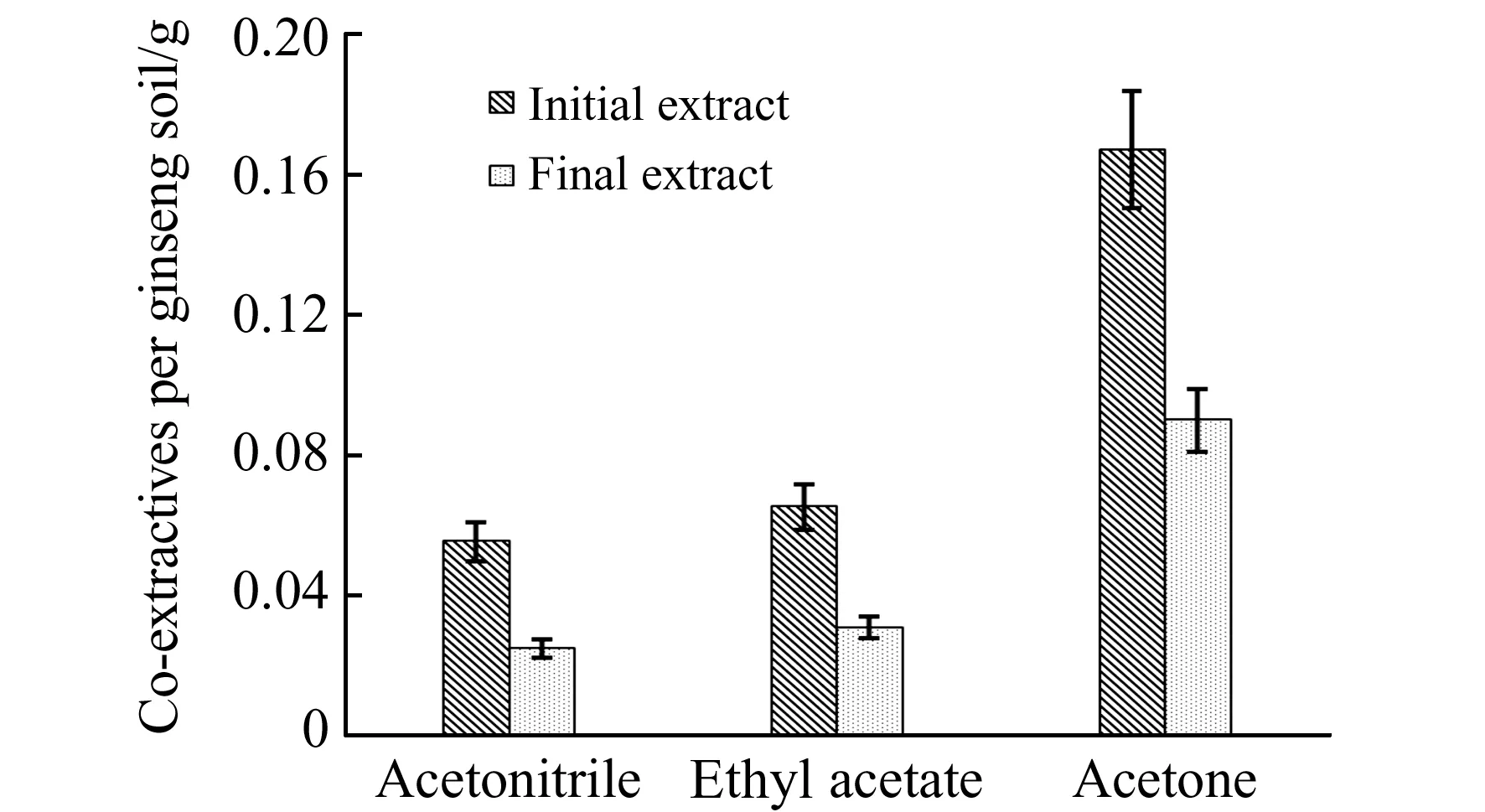
图2 采用乙腈、乙酸乙酯、丙酮3种萃取剂的初级萃取液和最终萃取液中共萃取基质的含量Fig.2 Amounts of co-extractives in initial and final extract obtained with three extractant:acetonitrile,ethyl acetate and acetone
2.2 样品前处理方法的优化
2.2.1 萃取剂的选择选择合适的萃取剂可以在提高目标物萃取效率的同时降低基质干扰。本研究比较了乙腈、乙酸乙酯、丙酮、石油醚、丙酮∶石油醚=1∶1(V/V)的提取效果。结果显示:当石油醚和丙酮∶石油醚=1∶1(V/V)作为萃取剂时,回收率较低且对目标物离子化抑制较强;而乙腈、乙酸乙酯、丙酮的提取回收率相对较高。根据质量测定法测定共萃取基质含量,发现提取出的杂质质量依次为丙酮>乙酸乙酯>乙腈(图2),相比之下,乙腈作为萃取剂的共萃取基质含量最少,说明基质效应相对最弱。综合考虑,本研究选择乙腈作为萃取剂。
2.2.2 固相萃取柱的选择目前,固相萃取法中常用的固相萃取柱有NH2、C18、Florisil、PestiCarb等。本文考察了NH2、C18、Florisil、PestiCarb固相萃取柱的净化效果,结果如图3。PestiCarb固相萃取柱去除杂质的效果最好,但因为其吸附能力较强而导致部分农药的损失较大;其中,六氯苯、百菌清、五氯苯胺三种农药被完全去除,无法被检测到,因此不适用于本研究的农药残留分析。通过比对过柱后样品的色谱图,发现经C18和Florisil固相萃取柱处理后,仍存在一些杂质峰,说明净化效果依次为NH2>Florisil>C18。综合考虑,本文最终选择NH2固相萃取柱净化。
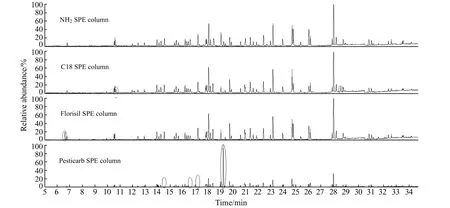
图3 4种固相萃取柱对土壤中48种农药净化效果的影响Fig.3 The effect of purification efficiency for 48 pesticides by four solid phase extraction columns in soil
2.2.3 洗脱剂和洗脱体积的选择本文考察了不同比例的甲醇-二氯甲烷(1∶9、1∶14、1∶19、1∶24,V/V)作为洗脱剂对48种农药回收率的影响。结果表明:四种比例洗脱剂的农药回收率相当,相比之下甲醇-二氯甲烷(1∶19,V/V)作为洗脱剂时,平均回收率在70%~120%范围的农药数量最多。本实验同时对洗脱剂体积(5、10、15、20 mL)进行了考察。分别收集各体积的洗脱流出液,将其浓缩、定容后进行GC/MS测定,计算48种农药的回收率。结果表明,随着洗脱剂体积的增加,48种农药的回收率逐渐增大,当洗脱剂体积为15 mL时,农药的回收率最高;而继续增加洗脱剂用量,农药的平均回收率趋于恒值。因此,最终确定选择15 mL甲醇-二氯甲烷(1∶19,V/V)洗脱NH2固相萃取柱。
2.3 基质效应
基质效应(Matrix Effect,ME)是指样品中分析物以外的组分对分析物分析过程的离子化而产生的抑制与增强作用[17]。基质效应=基质匹配工作曲线的斜率/纯溶剂中工作曲线的斜率,比值越接近1,则基质效应越小,反之则基质效应越大。48种农药目标物在采用“1.3”节前处理方法得到的萃取液中的基质效应见表2。48种农药化合物中毒死蜱、三唑磷、苯硫磷、联苯菊酯、甲氰菊酯、o,p′-滴滴涕、p,p′-滴滴涕的基质效应最为明显。目前,常见的降低基质效应的方法有:同位素内标法、基质匹配标准曲溶液、基质净化法等;相比之下,基质匹配标准溶液不仅效果较好,而且具有操作简单、廉价的优点。因此,本文采用基质匹配标准溶液进行校正。
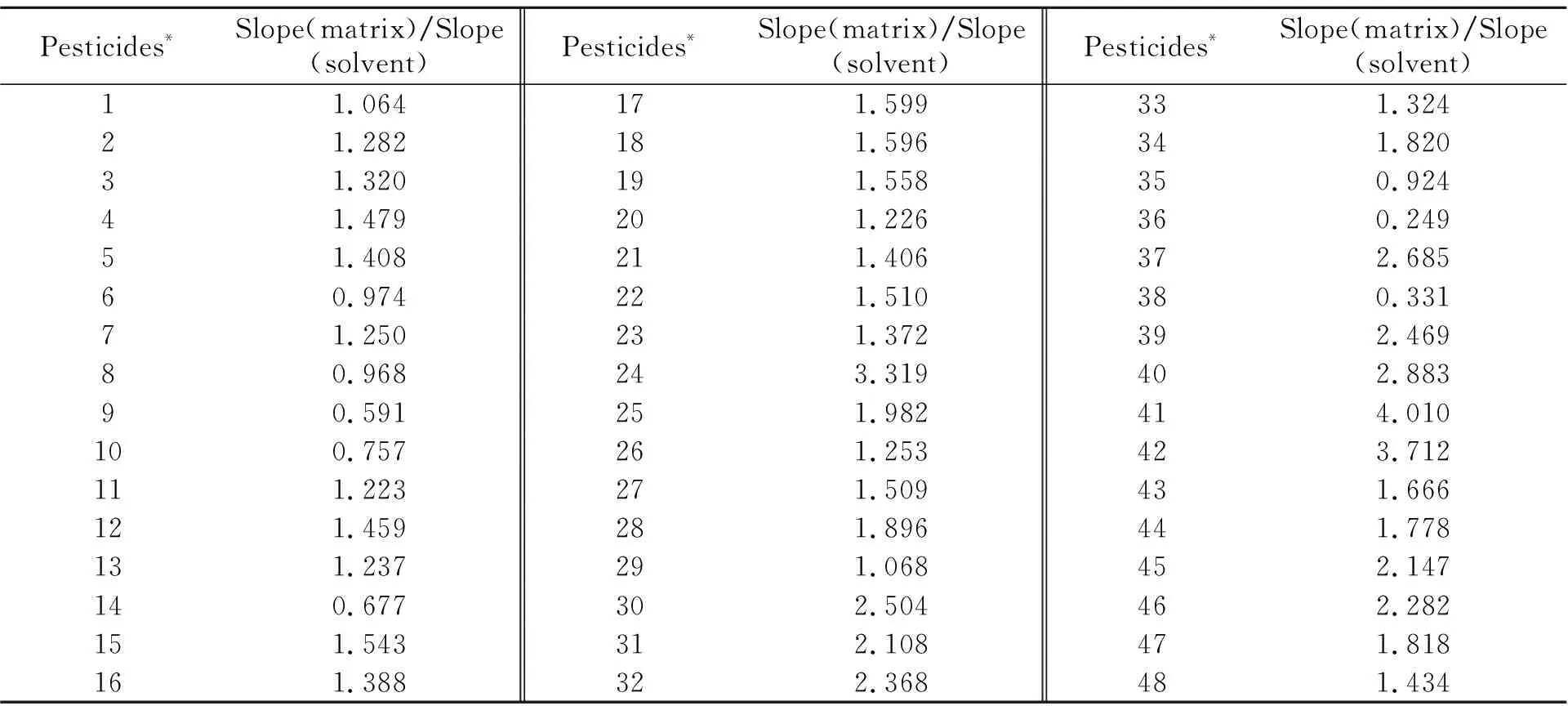
表2 48种农药在土壤中的基质效应
*The number and names of pesticides are identical to those in Table 1.
2.4 方法学验证
2.4.1 方法的标准曲线、检出限和定量限本实验采用空白土壤样品的基质提取液,配制质量浓度分别为5、10、25、50、100、250 μg/kg系列基质匹配混合标准溶液,按照“1.2”节的条件进样测定。以峰面积(y)为纵坐标,质量浓度(x)为横坐标制作标准曲线,结果如表3。48种农药在各自的线性范围内,线性关系良好,相关系数(r2)均大于0.995。以信噪比(S/N)为3和10时空白样品添加浓度计算方法的检出限(LOD)和定量限(LOQ)(表3),检出限和定量限的范围分别为2.0~6.0 μg/kg和5.0~20.0 μg/kg。
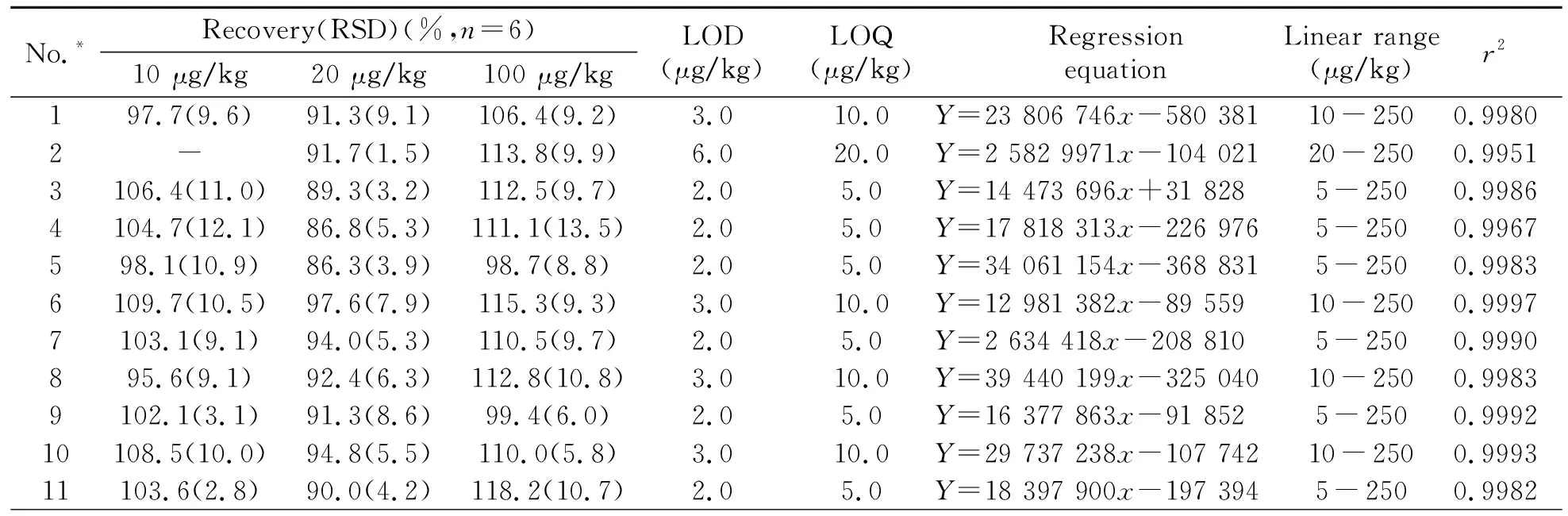
表3 48种农药的回收率、相对标准偏差、检出限、定量限、线性方程、线性范围及相关系数
(续表3)
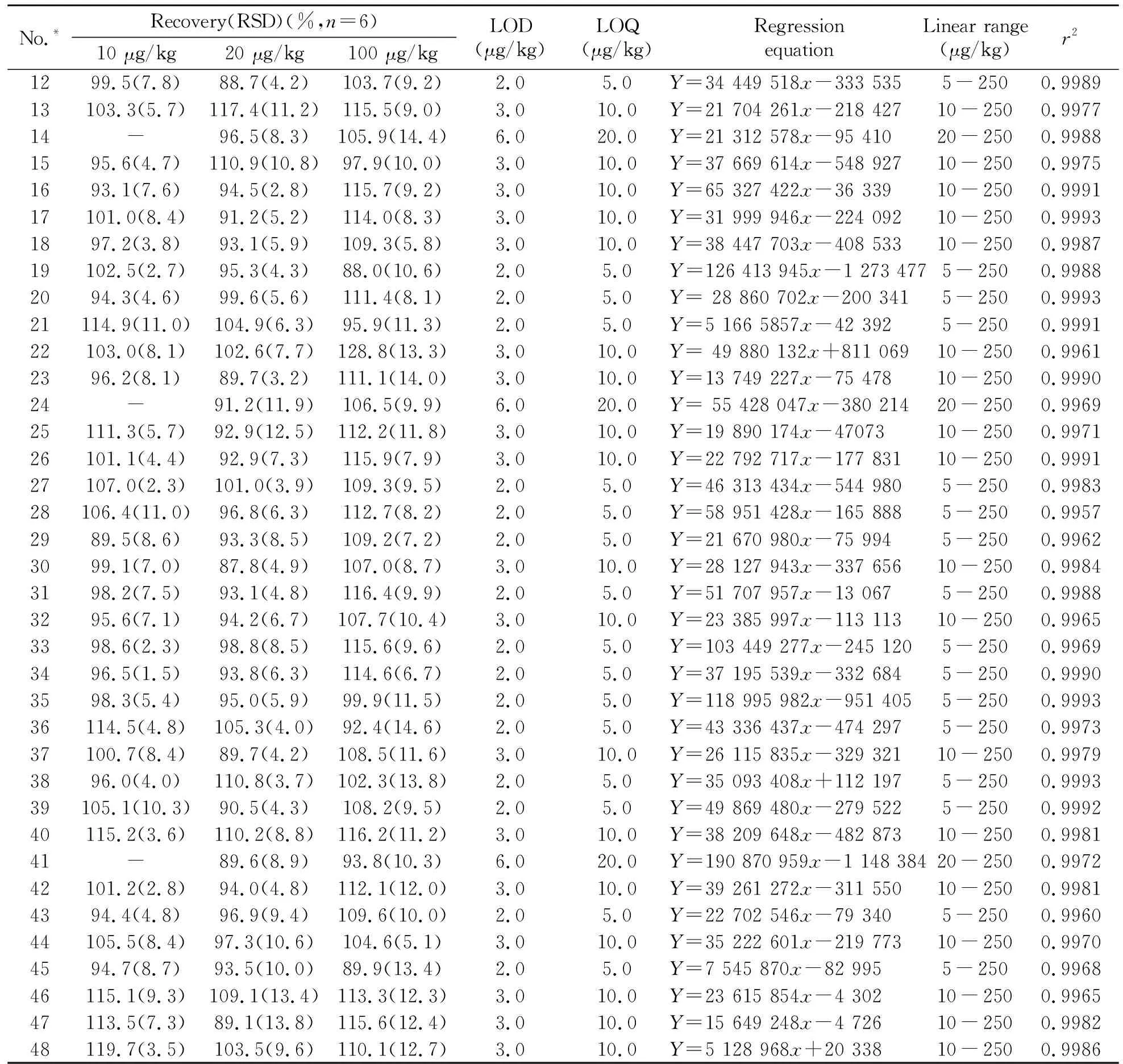
No.*Recovery(RSD)(%,n=6)10 μg/kg20 μg/kg100 μg/kgLOD(μg/kg)LOQ(μg/kg)RegressionequationLinear range(μg/kg)r21299.5(7.8)88.7(4.2)103.7(9.2)2.05.0Y=34 449 518x-333 5355-2500.998913103.3(5.7)117.4(11.2)115.5(9.0)3.010.0Y=21 704 261x-218 42710-2500.997714-96.5(8.3)105.9(14.4)6.020.0Y=21 312 578x-95 41020-2500.99881595.6(4.7)110.9(10.8)97.9(10.0)3.010.0Y=37 669 614x-548 92710-2500.99751693.1(7.6)94.5(2.8)115.7(9.2)3.010.0Y=65 327 422x-36 33910-2500.999117101.0(8.4)91.2(5.2)114.0(8.3)3.010.0Y=31 999 946x-224 09210-2500.99931897.2(3.8)93.1(5.9)109.3(5.8)3.010.0Y=38 447 703x-408 53310-2500.998719102.5(2.7)95.3(4.3)88.0(10.6)2.05.0Y=126 413 945x-1 273 4775-2500.99882094.3(4.6)99.6(5.6)111.4(8.1)2.05.0Y= 28 860 702x-200 3415-2500.999321114.9(11.0)104.9(6.3)95.9(11.3)2.05.0Y=5 166 5857x-42 3925-2500.999122103.0(8.1)102.6(7.7)128.8(13.3)3.010.0Y= 49 880 132x+811 06910-2500.99612396.2(8.1)89.7(3.2)111.1(14.0)3.010.0Y=13 749 227x-75 47810-2500.999024-91.2(11.9)106.5(9.9)6.020.0Y= 55 428 047x-380 21420-2500.996925111.3(5.7)92.9(12.5)112.2(11.8)3.010.0Y=19 890 174x-4707310-2500.997126101.1(4.4)92.9(7.3)115.9(7.9)3.010.0Y=22 792 717x-177 83110-2500.999127107.0(2.3)101.0(3.9)109.3(9.5)2.05.0Y=46 313 434x-544 9805-2500.998328106.4(11.0)96.8(6.3)112.7(8.2)2.05.0Y=58 951 428x-165 8885-2500.99572989.5(8.6)93.3(8.5)109.2(7.2)2.05.0Y=21 670 980x-75 9945-2500.99623099.1(7.0)87.8(4.9)107.0(8.7)3.010.0Y=28 127 943x-337 65610-2500.99843198.2(7.5)93.1(4.8)116.4(9.9)2.05.0Y=51 707 957x-13 0675-2500.99883295.6(7.1)94.2(6.7)107.7(10.4)3.010.0Y=23 385 997x-113 11310-2500.99653398.6(2.3)98.8(8.5)115.6(9.6)2.05.0Y=103 449 277x-245 1205-2500.99693496.5(1.5)93.8(6.3)114.6(6.7)2.05.0Y=37 195 539x-332 6845-2500.99903598.3(5.4)95.0(5.9)99.9(11.5)2.05.0Y=118 995 982x-951 4055-2500.999336114.5(4.8)105.3(4.0)92.4(14.6)2.05.0Y=43 336 437x-474 2975-2500.997337100.7(8.4)89.7(4.2)108.5(11.6)3.010.0Y=26 115 835x-329 32110-2500.99793896.0(4.0)110.8(3.7)102.3(13.8)2.05.0Y=35 093 408x+112 1975-2500.999339105.1(10.3)90.5(4.3)108.2(9.5)2.05.0Y=49 869 480x-279 5225-2500.999240115.2(3.6)110.2(8.8)116.2(11.2)3.010.0Y=38 209 648x-482 87310-2500.998141-89.6(8.9)93.8(10.3)6.020.0Y=190 870 959x-1 148 38420-2500.997242101.2(2.8)94.0(4.8)112.1(12.0)3.010.0Y=39 261 272x-311 55010-2500.99814394.4(4.8)96.9(9.4)109.6(10.0)2.05.0Y=22 702 546x-79 3405-2500.996044105.5(8.4)97.3(10.6)104.6(5.1)3.010.0Y=35 222 601x-219 77310-2500.99704594.7(8.7)93.5(10.0)89.9(13.4)2.05.0Y=7 545 870x-82 9955-2500.996846115.1(9.3)109.1(13.4)113.3(12.3)3.010.0Y=23 615 854x-4 30210-2500.996547113.5(7.3)89.1(13.8)115.6(12.4)3.010.0Y=15 649 248x-4 72610-2500.998248119.7(3.5)103.5(9.6)110.1(12.7)3.010.0Y=5 128 968x+20 33810-2500.9986
*The number and names of pesticides are identical to those in Table 1.
2.4.2 方法的精密度和准确度本文采用基质匹配标准溶液-外标法定量,在无农药残留的人参土壤空白基质中添加48种混合农药进行回收率实验。准确称取10.0 g均质的人参土壤样品于100 mL离心管中,分别添加低(10 μg/kg)、中(20 μg/kg)、高(100 μg/kg)3个水平的标准品。分别按照“1.2”节和“1.3”节所述的步骤进行样品前处理和测定,每个添加水平重复6次。由表3可见,48种农药的加标回收率在86.3%~128.8%范围内,相对标准偏差(RSD)小于20%。
2.5 实际样品检测
为验证方法的可靠性,采用本文建立的分析方法对延边地区内5个人参种植基地随机采取的20份土壤样品进行测定。结果表明,农药检出率为5%;其中,五氯硝基苯检出1份,含量0.19 mg/kg。其它土壤样品中均未检测出本文涉及到的48种农药残留。
3 结论
本文建立了同时测定人参种植土壤中48种农药残留的SPE-GC/MS分析方法。采用优化的SPE方法净化,能够有效的除去人参土壤中的矿物质、有机质等杂质干扰。在优化的GC/MS条件下,色谱图中48种农药色谱峰分离度好且基线平稳。方法学验证了该分析方法的各种参数(加标回收率、RSD、LOD、LOQ)均能够满足国内对农药残留检测中精密度和准确度的要求。该方法操作简单、高效、灵敏可靠,为人参种植土壤中多种类农药残留的风险评估、例行检测等研究提供了一种高效、可靠的分析手段。

