QuEChERS结合超高效液相色谱-串联质谱法测定咖啡中丙烯酰胺
林 涛, 李茂萱, 邹艳虹, 赵金化, 范泽剑, 邵金良*
(1.云南省农业科学院质量标准与检测技术研究所, 云南昆明 650205;2.农业农村部农产品质量安全风险评估实验室(昆明), 云南昆明 650205;3.云南省大理市农产品质量安全检测站, 云南大理 671000)
丙烯酰胺是目前国际上公认的二类致癌物之一[1],它具有神经毒性[2]、遗传毒性[3]、生殖毒性[4]及各种潜在致癌性[5,6]。研究表明,淀粉类食品在高于120 ℃的温度下烹调下会产生丙烯酰胺[7],因此,在炸薯条、炸土豆片等高温下油炸食品中常检出丙烯酰胺[8],而近年来的相关研究也主要集中于丙烯酰胺的形成和抑制机理等方面[9,10]。目前,对于咖啡中丙烯酰胺的研究较少,少量文献报道主要集中于咖啡中丙烯酰胺形成机理[11]、膳食评估等[12],而咖啡中丙烯酰胺含量的测定方法也较少。咖啡中成分复杂、干扰物较多,测定过程中的难度较大,目前还没有成熟可靠、快速准确的方法,现在常见的方法主要包括了酶联免疫分析法[13]、液相色谱法[14]、气相色谱-质谱联用法[15]。近年来,随着液相色谱-串联质谱的广泛使用,该方法也应用于咖啡中丙烯酰胺的测定,其测定结果灵敏度较高。但是由于前处理过程中通常都需要利用固相萃取柱净化,其前处理时间较长,耗时费力[16]。
QuEChERS方法是目前常用的样品前处理方法,而丙烯酰胺因其极性较大,采用常规QuEChERS方法的提取液中杂质较多,不便于后续的净化过程。因此,如何寻找简便快捷且能够普遍使用的咖啡中丙烯酰胺提取方法,是目前咖啡中丙烯酰胺测定的主要问题。本研究拟在现有的研究方法基础上,采用改进的QuEChERS方法,结合超高效液相色谱-串联质谱,以期建立快捷、简便的咖啡中丙烯酰胺的快速提取和测定方法。
1 实验部分
1.1 主要仪器与试剂
API4000三重四极杆串联质谱仪(美国,AB Sciex公司);1290超高效液相色谱仪(美国,Agilent公司);BSA124S电子分析天平(德国,Sartorius公司)。
丙烯酰胺(纯度99%,中国百灵威科技有限公司);丙烯酰胺同位素内标(1,2,3-13C3)(纯度99%,1 mg/mL,中国百灵威科技有限公司)。乙酸乙酯、乙腈、甲醇(色谱纯,德国Merck公司);K4[Fe(CN)6]、NaCl、NH4Ac(分析纯,国药集团化学试剂有限公司);乙酸、甲酸(色谱纯,美国Sigma公司);石墨化炭黑(GCB)吸附剂(45 μm,美国Sigma公司);硅藻土吸附剂(Chromosorb G -HP)(北京迪马欧泰科技发展中心)。纯净水(杭州娃哈哈公司)。
1.2 实验方法
1.2.1 标准溶液的配制用乙腈分别将丙烯酰胺和丙烯酰胺同位素内标稀释为100 μg/mL的标准储备液,再分别用乙腈稀释得到1 μg/mL的丙烯酰胺工作溶液和10 μg/mL的丙烯酰胺同位素内标工作溶液,于-18 ℃下低温避光保存。
1.2.2 样品前处理准确称取1.00 g经干燥粉碎后的咖啡样品,置于50 mL离心管中,加入同位素内标0.1 mL,加入15 mL正己烷,涡旋振荡5 min后,6 000 r/min下离心2 min,弃上层正己烷溶液,再加入10 mL 0.1 mol/L K4[Fe(CN)6]溶液,涡旋振荡5 min后,超声提取10 min,6 000 r/min下离心10 min后,取上层溶液2 mL于另一15 mL离心管中,加入400 mg硅藻土吸附剂,涡旋混匀后加入5 mL乙酸乙酯,再加入50 mg GCB吸附剂,涡旋混匀后,6 000 r/min下离心2 min,上清液氮气吹干后,用乙腈定容至1 mL,0.22 μm滤膜过滤后,待分析。
1.2.3 色谱条件CAPCELL CORE PC色谱柱(100 mm×2.1 mm,2.7 μm;日本Shiseido公司);流动相A为乙腈,B为0.1%甲酸水溶液(含1 mmol/L NH4Ac),流速:0.2 mL/min,采用等度洗脱方式,洗脱比例为A+B=95%+5%;柱温:35 ℃;进样量:5 μL。
1.2.4 质谱条件采用ESI源,正离子扫描模式,其中气帘气流速为20 L/h,雾化气流速为55 L/h,辅助气流速为55 L/h,辅助加热气温度为650 ℃,喷雾电压为5 500 V;采用多反应监测(MRM)模式。
2 结果与讨论
2.1 质谱条件的优化
本研究中采用0.1 μg/mL的丙烯酰胺,分别在正、负离子模式下对其进行质谱条件的优化,但是丙烯酰胺在负离子模式下响应较差,因此,采用正离子模式,并参照文献报道[17,18]进行离子对及相关电压的优化,确定丙烯酰胺测定的离子对条件,如表1所示。
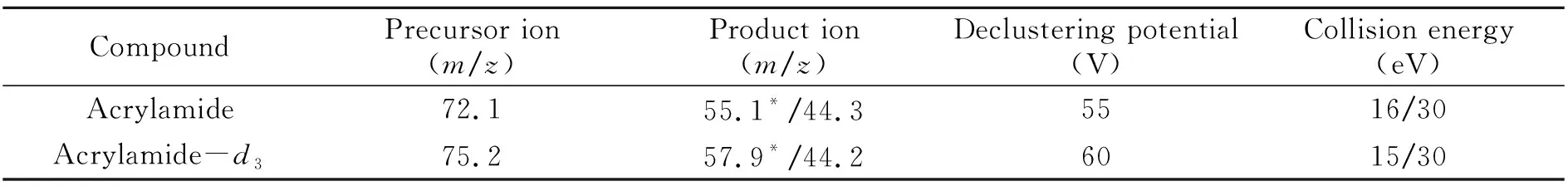
表1 丙烯酰胺的监测离子及相关电压
*Quantitative ion.
2.2 色谱条件的优化
丙烯酰胺属于小分子化合物,含有一个酰胺键,极性较大,因此实验采用了对极性化合物具有特殊保留行为的亲水色谱柱,采用乙腈+水=95%+5%等度洗脱,出峰时间在1 min左右,峰形较好,且采用高比例的有机相时也能够提高质谱的离子化效率。优化条件下丙烯酰胺色谱图见图1。
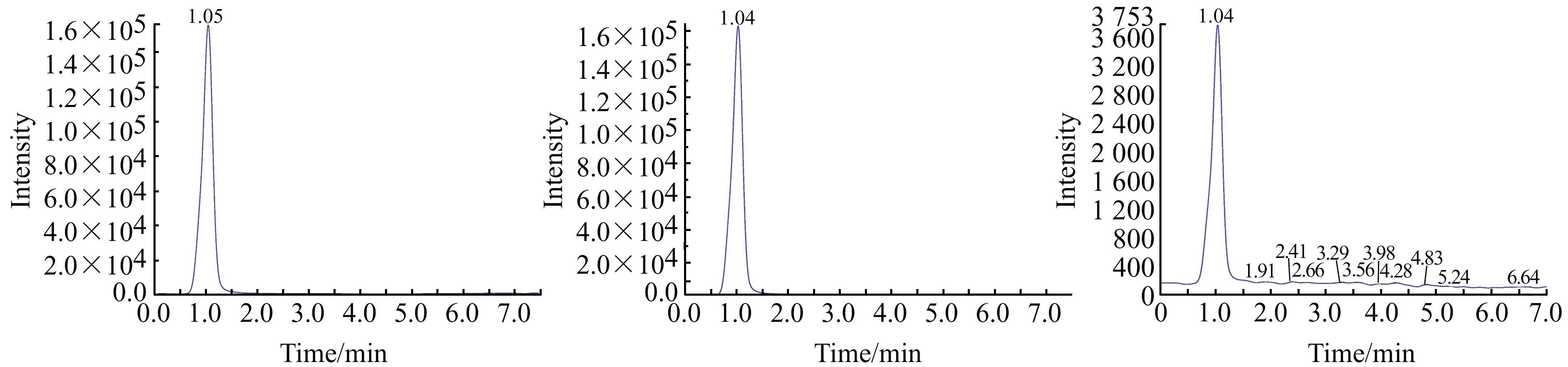
图1 丙烯酰胺标准(a)、丙烯酰胺同位素内标(b)和咖啡空白基质加标(c)色谱图Fig.1 Chromatograms of acrylamide standard(a),acrylamide isotope internal standard(b) and coffee blank matrix spike(c)
2.3 净化方法的优化
2.3.1 提取溶剂的选择首先,采用正己烷将脂肪及低极性化合物除去,然后加入K4[Fe(CN)6]利于咖啡中蛋白质的盐析并吸附,且丙烯酰胺易溶于水,利于咖啡中丙烯酰胺的提取;另一方面,溶液中的无机盐离子还可促进后续的液-液萃取过程中水相与乙酸乙酯相的分层。
2.3.2 净化填料的优化选择实验中首先采用硅藻土吸附剂对提取溶液进行净化,吸附剂与外界提取溶液接触后吸收水分子后被其包被和活化,而提取溶液中的低极性化合物和无机盐离子等被其吸附,再利用乙酸乙酯与吸附剂表面的液-液萃取而将目标化合物萃取,而GCB的加入,能够进一步的除去咖啡提取溶液中的色素,相对于PSA、C18、NH2和Florisil等吸附材料,GCB能够较好的吸附色素,并且在后续的质谱分析中能够减小基质效应。
2.3.3 净化填料使用量的优化选择试验了分别在100、200、300、400、500和600 mg硅藻土中加入2 mL 提取溶液时,对于丙烯酰胺的回收效果。结果表明,随着硅藻土加入量的增加,丙烯酰胺的回收率逐渐增加,当硅藻土加入量达到400 mg时达到最大的回收效果(76.3%),随后其回收降低。通过GCB不同加入量对丙烯酰胺回收效果的比较,确定当GCB加入量为50 mg时达到了较好的回收效果(78.5%)。因此,选择加入400 mg硅藻土和50 mg GCB吸附剂为较优的用量。
2.4 线性范围和检出限
分别将丙烯酰胺用乙腈稀释成不同浓度标准溶液,并分别加入固定含量丙烯酰胺同位素内标,以丙烯酰胺峰面积与丙烯酰胺同位素内标峰面积的比值为纵坐标,对各浓度进行线性回归分析。结果表明,丙烯酰胺在0.01~10.0 μg/mL浓度范围内相关系数较好(r2=0.9996);同时选取咖啡基质加入一定浓度的丙烯酰胺,按照上述的前处理和测定方法,以3倍和10倍信噪比(S/N)所对应的加标浓度得到检出限为0.05 mg/kg,定量限为0.15 mg/kg。根据欧盟对于焙烤咖啡中丙烯酰胺的限量要求为0.4 mg/kg,本方法的检出限和定量限完全能够满足该限量要求。
目前,国家标准(GB 5009.204-2014)的第一法中使用了液相色谱-串联质谱法,该方法在操作过程中将样品提取液完全或者分取一半进行后续的净化过程,得到了较好的测定效果,但是该方法主要是针对常见的热加工食品中丙烯酰胺的测定。本研究中采用分取少量提取溶液进行后续测定,取得了较好的净化效果和检测灵敏度,且相对于国家标准中的操作步骤,本方法较为简便可行。
2.5 回收率和精密度
本实验中,选取铁皮卡、卡杜拉和卡蒂姆等代表性咖啡样品,分别以丙烯酰胺的定量限、5倍和10倍定量限作为添加浓度进行回收试验和精密度测定,每个添加浓度进行6次平行试验。结果如表2所示,丙烯酰胺的回收率范围为73.6%~81.3%,相对标准偏差范围为4.7%~6.7%。

表2 丙烯酰胺的回收率和相对标准偏差(RSD)(n=6)
2.6 实际样品的测定
抽取当地超市及农贸市场中的烘焙咖啡和速溶咖啡样品各10个样品进行丙烯酰胺测定,测定结果为:烘焙咖啡中丙烯酰胺含量范围为0.164~0.226 mg/kg,速溶咖啡中丙烯酰胺含量范围为0.071~0.326 mg/kg。根据欧盟对于烘焙咖啡和速溶咖啡中丙烯酰胺的限量标准分别为0.40 mg/kg和0.85 mg/kg,此次抽样的烘焙咖啡和速溶咖啡中的丙烯酰胺含量均未超过标准要求。
3 结论
本文利用改进的QuEChERS方法,建立了利用亲水色谱柱的超高效液相色谱-串联质谱法快速测定咖啡中丙烯酰胺的方法。方法的回收率、准确度和精密度均满足咖啡中丙烯酰胺的测定和限量要求。

