原儿茶酸对人血清白蛋白淀粉样纤维化的抑制作用
王 瑞, 朱文清, 郑 洁, 张国文*
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
许多蛋白质或多肽在一些内部(氨基酸序列变异、氧化应激),或者外部(极端pH、高温)因素的共同作用下,会发生错误折叠和聚集,从而形成不溶性淀粉样纤维。这些蛋白纤维会在体内不断沉积,产生细胞毒性,对机体器官造成破坏和损伤,从而诱导帕金森氏症、阿尔茨海默病以及Ⅱ型糖尿病等疾病的发生[1]。原儿茶酸(Protocatechuic Acid,PA)作为一种酚酸类化合物,广泛存在于蔬菜和水果中,也是很多天然中草药的有效成分,具有抗氧化、抗肿瘤、抗血糖、消炎、保护神经等多种药理学作用[2]。研究发现,酚酸类化合物咖啡酸[3]、迷迭香酸[4],以及黄酮化合物根皮素[5]、黄芩素[6]等均能显著抑制蛋白淀粉样纤维的形成。紫衫木素通过与蛋白质的氨基酸如赖氨酸(Lys)残基发生结合[7],阻碍Aβ42蛋白的聚集,抑制了蛋白纤维化的生成。然而,关于原儿茶酸对蛋白质淀粉样纤维化的抑制及可能的抑制机制目前仍不清楚。
本文以人血清白蛋白(HSA)为蛋白模型,采用荧光光谱、圆二色谱(CD),结合透射电子显微镜(TEM)和分子模拟技术,研究了原儿茶酸对蛋白质淀粉样纤维化的抑制作用及抑制机制,以期为天然酚酸化合物在食品工业中的应用和药物开发提供理论基础。
1 实验部分
1.1 主要仪器与试剂
F-7000型荧光光度计(日本,日立公司);MOS-450型圆二色谱仪(法国,Bio-Logic公司);JEM-2100型透射电子显微镜(日本,电子光学公司);BSA224S型电子天平(德国,赛多利斯公司)。
HSA(纯度≥96%,北京索莱宝科技有限公司);分别称取一定量原儿茶酸(PA,纯度≥97%,上海阿拉丁有限公司)、硫黄素T(ThT,纯度75%,上海源叶生物科技公司)和8-苯氨基-1-萘磺酸(ANS,纯度96%,上海阿拉丁有限公司)用无水乙醇溶解,配制成浓度为2.0×10-2、2.0×10-2和1.0×10-4mol·L-1的储备溶液,于4 ℃冰箱中避光保存;其它试剂均为分析纯。实验用水为Millipore Simplicity水纯化系统(法国密理博公司)制备的超纯水。
1.2 实验方法
1.2.1 HSA淀粉样纤维化的制备称取适量的HSA溶解于pH=7.4的Tris-HCl缓冲溶液(0.05 mol·L-1)中,配制成浓度为50 μmol·L-1的蛋白溶液,放置在4 ℃的冰箱中过夜以充分溶解。取不同体积的原儿茶酸储备液加入到HSA蛋白溶液中,原儿茶酸的终浓度分别为250 μmol·L-1和500 μmol·L-1。将上述溶液充分混匀后,置于65 ℃的恒温水浴锅中孵育,分别在1、2、4、8、12、24、36、48、60、72、84、96、108、120 h时取样,待测。
1.2.2 ThT荧光光谱测定向2 mL不同时间段取出的HSA样品溶液中加入5 μL ThT储备溶液,充分振荡摇匀后,置于暗处反应30 min,将反应后的试液倒入荧光池中,在440 nm的激发波长下,测定450~650 nm 范围内的荧光光谱,激发和发射的狭缝宽度均为2.5 nm。
1.2.3 ANS荧光光谱测定将孵育后的HSA样品用缓冲溶液稀释至5.0 μmol·L-1后,加入一定体积的ANS储备溶液,保证ANS与蛋白的浓度比为10∶1,避光反应30 min后,测定ANS荧光光谱。激发波长设定为380 nm,扫描范围为400~600 nm,激发和发射的狭缝宽度均为2.5 nm。
1.2.4 CD测定采用CD仪测定HSA溶液孵育前后二级结构的变化。在室温条件下,将稀释的蛋白溶液(5.0 μmol·L-1)加入到石英比色皿中进行测定,波长扫描范围为190~250 nm,每组样品测量3次,通过扣除缓冲溶液的背景光谱来校正所测得的CD光谱。
1.2.5 TEM测定将孵化前后的HSA溶液用缓冲液稀释到5.0 μmol·L-1,轻微振荡后使其分散均匀,取20 μL稀释后的HSA溶液滴于带有碳支撑膜的铜网上,静置蒸发干燥后,滴加1%磷钨酸负染5 min,用滤纸吸去多余的磷钨酸,于37 ℃干燥箱中过夜。采用TEM观察蛋白纤维化程度。
1.2.6 分子模拟使用AutoDock 4.2和MGLTools 1.5.6软件模拟原儿茶酸与HSA的结合模式。配体分子原儿茶酸的3D结构通过Chem3D Ultra 8.0软件构建,并进行能量最小优化。HSA的晶体结构从Protein Data Bank网站下载(1h9z),除去HSA的水分子,并将极性氢原子加入到HSA中。将处理好的原儿茶酸与HSA进行分子对接,并应用Lamarckian遗传算法完成对接计算,对接次数为100次,运行结束后,形成一系列的能量簇,根据能量最优原则选择最合适的对接模型进行结果分析。

图1 (A)不同浓度原儿茶酸存在下HSA淀粉样蛋白聚集的ThT荧光动力学;(B)65 ℃孵育120 h后HSA纤维化的ThT荧光光谱Fig.1 (A) ThT fluorescence kinetics of HSA in the absence and presence of difference concentrations of PA;(B) ThT fluorescence spectra of HSA fibrillation after incubation at 65 ℃ over 120 h in the absence and presence of PA
2 结果与讨论
2.1 原儿茶酸对HSA淀粉样纤维聚集的抑制
ThT作为一种阴离子荧光染料,能够与淀粉样纤维的β片层结构特异性结合,在440 nm波长激发条件下产生荧光,ThT荧光值的大小常被用作评估蛋白淀粉样纤维程度的指标[8]。如图1(A)所示,不同于大多数蛋白质纤维化过程呈现出的核依赖聚集模型,HSA的纤维化过程不包括成核期[9],直接形成原纤维并结合捆绑形成成熟的淀粉样纤维(生长期,0~84 h),当体系中所有的蛋白质单体均转化为成熟淀粉样纤维后,ThT的荧光强度趋于稳定(稳定期,84~120 h),孵化120 h后的ThT荧光强度为304.8(图1(B)曲线1)。加入不同浓度的原儿茶酸与HSA孵化后可明显降低蛋白淀粉样纤维的生成量,当原儿茶酸的浓度为250 μmol·L-1和500 μmol·L-1时,ThT荧光强度分别降低至174和122.7(图1(B)曲线2、3),对HSA淀粉样纤维形成的抑制率分别达到了42.5%和59.5%。该结果初步证明了原儿茶酸对蛋白质淀粉样纤维的形成有良好的抑制作用,且呈现出浓度依赖性。
2.2 原儿茶酸对HSA淀粉样纤维表面疏水性的影响
研究表明,蛋白质在不断聚集形成纤维化的过程中,常伴随着蛋白质结构的部分解折叠,诱导蛋白质内部疏水性氨基酸的暴露[10]。ANS作为一种典型的疏水性探针,本身荧光强度较弱,当其作用于蛋白质的疏水性氨基酸,其荧光强度会显著增强[11]。如图2所示,25 ℃下HSA-ANS体系荧光强度较低(119.3,曲线1),说明常温下HSA内部疏水性氨基酸不会暴露出来,而在65 ℃孵化120 h后的HSA-ANS体系荧光强度明显升高(651.9,曲线2),并伴随着显著的蓝移(486 nm→479 nm),表明孵化后的HSA表面暴露出较多的疏水性氨基酸残基。当在整个蛋白质孵化体系(65 ℃,120 h)中加入浓度为250和500 μmol·L-1的原儿茶酸后,反应体系的荧光强度为374.4(曲线3)和264(曲线4),分别降低了42.6%和59.5%。该结果表明原儿茶酸诱导了HSA多肽链的收缩,从而即便在较高温度下(65 ℃)也能维持蛋白质正常的结构稳定性。有文献报道,小分子与蛋白质的非共价结合能够稳定淀粉样纤维蛋白的核心结构[12],因此,我们推测原儿茶酸可能与HSA的氨基酸残基发生非共价结合而抑制了HSA纤维的形成。
2.3 原儿茶酸对HSA二级结构的影响
研究表明,在正常蛋白向成熟的淀粉样纤维变化过程中,伴随着蛋白质二级结构中α-螺旋向β-折叠的转变[13]。图3显示未经孵化的HSA在208 nm和222 nm处有两个明显的特征吸收峰,表明在HSA结构中α-螺旋占主导地位。当HSA在65 ℃下孵化120 h后,HSA在222 nm处的吸收峰消失,强度减弱,表明HSA的二级结构由α-螺旋向β-折叠转变[14]。当向上述孵化的HSA溶液中加入原儿茶酸后,HSA的CD光谱椭圆度逐渐恢复,且呈现浓度依赖关系,表明原儿茶酸的加入能够阻止蛋白质二级结构由α-螺旋向β-折叠转变,原儿茶酸通过稳定蛋白质的α-螺旋结构而发挥其抑制淀粉样纤维作用[14]。
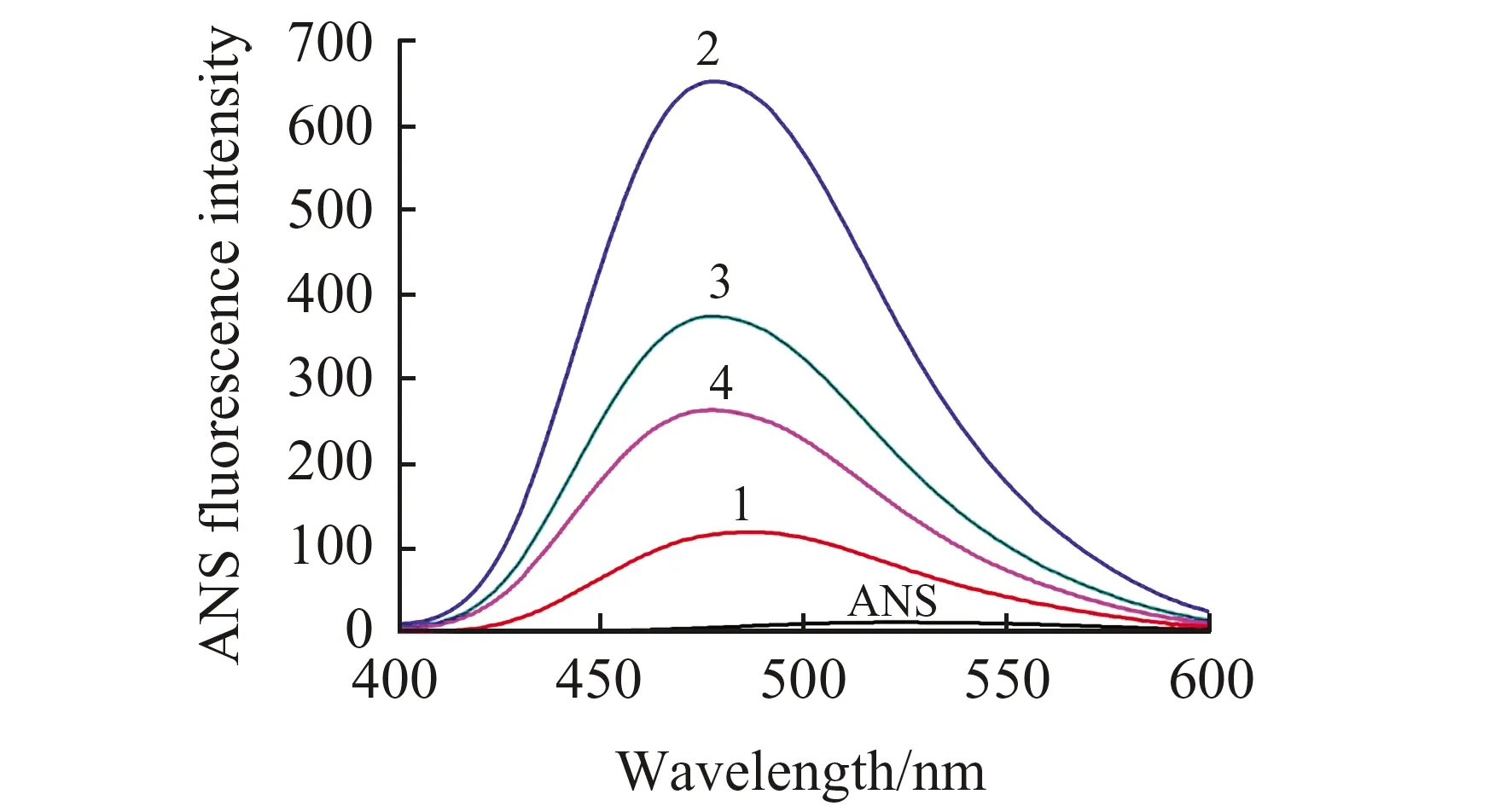
图2 不同浓度原儿茶酸在65 ℃下孵化120 h后对HSA表面疏水性的影响Fig.2 Effect of difference concentrations of PA on the surface hydrophobicity of HSA after incubation at 65 ℃ for 120 hcurves 1 - 4:1.HSA at 25 ℃(5.0 μmol·L-1);2.HSA at 65 ℃(5.0 μmol·L-1) for 120 h;3.HSA+PA(250 μmol·L-1) at 65 ℃ for 120 h;4.HSA+PA(500 μmol·L-1) at 65 ℃ for 120 h.
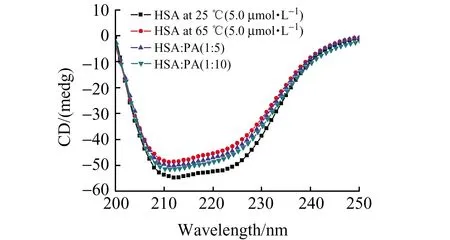
图3 不同浓度原儿茶酸在65 ℃下孵化120 h后对HSA二级结构的影响Fig.3 Effects of difference concentrations of PA on the secondary structure of HSA after incubation at 65 ℃ for 120 h
采用在线的Dichroweb软件分析[15]得到HSA的二级结构含量(表1)。由表可以看出,孵化后的HSA中α-螺旋含量明显降低(46.9%→37.9%),β-折叠含量显著增大(2.1%→11.6%),而加入原儿茶酸(500 μmol·L-1)与HSA共同孵化后,α-螺旋含量从37.9%恢复到43.3%,β-折叠含量也从11.6%降低到5.3%,进一步证实了原儿茶酸具有稳定蛋白质α-螺旋结构的能力,这也可能是其能够抑制蛋白淀粉样纤维化的原因之一。
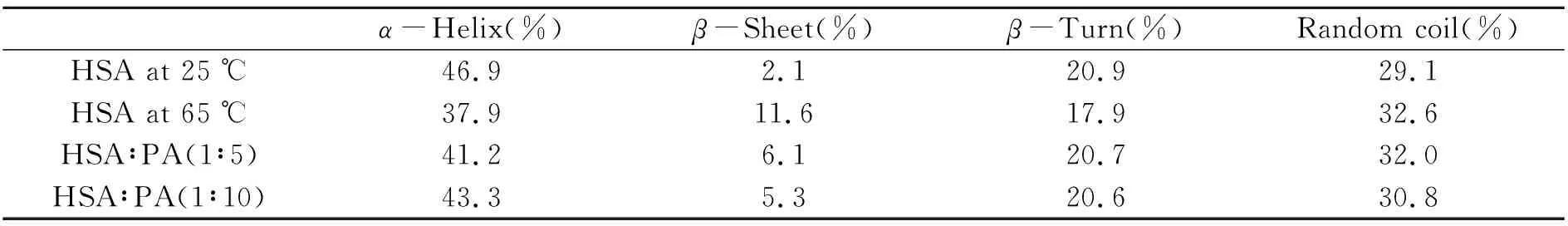
表1 HSA和原儿茶酸-HSA体系的二级结构含量
2.4 原儿茶酸对HSA淀粉样纤维形态的影响
为了更直观的观察HSA淀粉样纤维化的形成以及评估原儿茶酸对蛋白淀粉样纤维化的抑制效果,采用TEM观察HSA溶液中蛋白的形态变化[16]。如图4A所示,常温下的HSA溶液中未观察到纤维的形成,经过65 ℃孵化120 h的蛋白溶液则形成了直的成熟淀粉样纤维,并产生聚集形成浓密的网状结构(图4B)。在加入原儿茶酸孵化后该蛋白溶液的纤维化程度明显减弱,当加入的原儿茶酸浓度达到500 μmol·L-1时,几乎观测不到明显的纤维状蛋白,原儿茶酸与蛋白结合形成了颗粒状的聚集体(图4C和4D)。TEM结果与ThT荧光测量结果相符,证实原儿茶酸具有良好的抑制蛋白淀粉样纤维形成的能力。
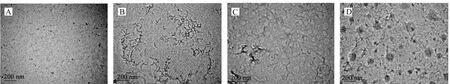
图4 HSA淀粉样纤维的TEM图像(200 nm).(A) 25 ℃的HSA;(B) 65 ℃孵化120 h的HSA;(C) HSA+PA(250 μmol·L-1) 65 ℃孵化120 h;(D) HSA+PA(500 μmol·L-1) 65 ℃孵化120 hFig.4 TEM images of HSA amyloid fibrils(200 nm).(A) HSA at 25 ℃;(B) HSA incubated at 65 ℃ for 120 h;(C) HSA+PA(250 μmol·L-1) incubated at 65 ℃ for 120 h;(D) HSA+PA(500 μmol·L-1) incubated at 65 ℃ for 120 h
2.5 原儿茶酸与HSA分子对接
原儿茶酸与HSA分子对接显示,原儿茶酸进入了HSA子域ⅢB和子域ⅠB之间的疏水空腔(图5(A)),被Glu184,Arg186,Asp187,Lys190,Arg428,Lys432,Ser435,Lys436,Lys519,Gln522,Ile523,Gln526和Thr527等氨基酸残基包围,且分别与Lys432和Lys519形成两个氢键,键长分别为2.202 Å和2.234 Å(图5(B)),表明原儿茶酸通过氢键和疏水作用力与HSA发生结合,这种结合有助于维持蛋白质结构的稳定,阻碍蛋白质的聚集,从而抑制蛋白质淀粉样纤维化的形成。Sato等[7]报道,儿茶酚型黄酮类化合物紫杉叶素通过结合Aβ42的赖氨酸残基(Lys)而抑制Aβ42多肽的聚集。由此推测原儿茶酸可能与紫杉叶素类似,通过与赖氨酸残基特异性结合而抑制蛋白质聚集和淀粉样纤维化的形成。
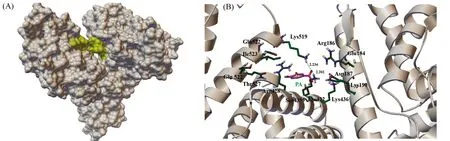
图5 (A) 原儿茶酸与HSA最可能结合位点;(B) HSA疏水性空腔中与原儿茶酸作用的氨基酸残基Fig.5 (A) The most possible binding site of PA in HSA;(B) Interaction of PA with the amino acid residues in the hydrophobic pocket of HSA
3 结论
原儿茶酸对HSA淀粉样纤维化的抑制呈现浓度依赖性,当浓度为500 μmol·L-1时,其抑制率达到了59.5%。原儿茶酸主要通过氢键和疏水作用力与HSA发生结合,减少蛋白质表面疏水性氨基酸的暴露,使得蛋白质在较高温环境(65 ℃)下也能够维持正常的构象。原儿茶酸可能通过与HSA中的赖氨酸残基的特异性结合而稳定蛋白质结构,从而抑制蛋白质聚集,减少淀粉样纤维化的形成。该研究结果可为原儿茶酸作为新型抗淀粉样蛋白抑制剂的研发提供一定的理论基础。

