旋毛虫感染对胶原诱导性关节炎小鼠 肠道菌群的影响*
庄清慧 于 艳 张 楠 杜素琴 黄京京 程喻力 诸欣平
(首都医科大学基础医学院病原生物学系,北京 100069)
类风湿性关节炎(rheumatoid arthritis,RA)是一种慢性、全身性自身免疫性疾病,主要表现为对称性小关节的慢性炎症、骨侵蚀和软骨破坏,导致关节畸形和功能丧失,严重威胁患者健康。RA的发生和发展受遗传、环境、免疫等多种因素的影响。其中,肠道菌群在类风湿性关节炎发生和发展中的调节作用近年逐步受到关注。当将关节炎小鼠的粪便悬液灌入无菌小鼠的胃中,无菌小鼠显示出更高的关节炎诱导率(Liuetal., 2016a);而使用益生菌或抗生素人为调节肠道菌群使RA患者肠道微生物群正常化,能在一定程度上抑制RA的发病及进展,甚至改善RA的病情(Monsarratetal., 2013; Ozdemiretal., 2013; Chenetal., 2016)。
研究表明,寄生虫能够与宿主的肠道菌群相互作用。一方面,寄生虫感染可以影响宿主肠道菌群组成,进而影响宿主健康;另一方面,菌群能够影响寄生虫的活力和感染力。有研究发现,蠕虫感染可以通过启动宿主免疫应答调节肠道共生菌和致病菌的平衡,并由此影响免疫相关性疾病的发生和发展(Ramananetal., 2016)。
旋毛形线虫Trichinellaspiralis简称旋毛虫,成虫主要寄生于宿主小肠粘膜,幼虫寄生在同一宿主的横纹肌细胞内,在肌肉内形成幼虫囊包,感染的不同时期能引起小鼠肠道菌群不同的变化(Liuetal., 2019)。我们前期的研究证明,在小鼠关节炎造模前,预先感染旋毛虫可有效预防小鼠胶原诱导性关节炎(Collagen-Ⅱ induced arthritis,CIA)的发生和发展(Chengetal., 2018),但旋毛虫感染对CIA小鼠关节炎的改善作用是否与肠道菌群调节有关尚不清楚。因此,本研究利用16S rDNA测序,探究预先感染旋毛虫对CIA小鼠肠道菌群的影响,再进一步分析差异菌属与关节炎评分的相关性,为深入分析旋毛虫感染对胶原诱导性关节炎的改善作用及其可能的机制提供实验依据。
1 材料与方法
1.1 实验动物与虫株
实验动物:DBA/1雄性小鼠,8~10周龄,SPF级,购自首都医科大学实验动物中心。
旋毛虫虫株:源自本实验室ICR鼠传代保种的黑龙江猪源旋毛虫 (ISS 533)。
1.2 主要试剂
牛Ⅱ型胶原、完全弗氏佐剂(Complete Freund′s adjuvant, CFA)、不完全弗氏佐剂(Incomplete Freund′s adjuvant, IFA)购自美国Chondrex公司,Gene JET胶回收试剂盒、Ion Plus Fragment Library Kit试剂盒购自美国Thermo公司。
1.3 实验动物分组及造模
将15只DBA/1小鼠随机分成3组,包括正常对照组(Control组)、胶原诱导关节炎组(CIA组)、预先感染旋毛虫关节炎组(CIA.TS组),每组5只。CIA.TS组在关节炎造模前14 d,预先按照400条/只旋毛虫肌幼虫经口感染DBA/1小鼠。造模当天,将浓度为2 mg/mL的牛Ⅱ型胶原与等体积的完全弗氏佐剂混合,超声乳化完全,在距小鼠尾根部1.5 cm处进行皮内免疫(100 μL/只);首次免疫后第21 d,将牛Ⅱ型胶原与不完全弗氏佐剂等量混合并乳化,于背部皮内多点注射加强免疫(100 μL/只),制备CIA模型。
1.4 小鼠关节炎的评分标准
从首次免疫后的第21 d开始,隔天记录各组小鼠的关节炎评分,评分标准如下:0=无关节炎症状;1=1个足趾出现红肿;2=2个足趾红肿,但未累及足掌;3=3个以上的关节红肿;4=红肿累及踝关节(Cuzzocreaetal., 2005),记小鼠4个足爪的总分为该鼠的关节炎评分。
1.5 小鼠粪便采集及DNA 提取
在关节炎造模后第50 d,在超净台中采集小鼠的新鲜粪便于无菌离心管中,迅速置于液氮罐中冷却,保存于超低温冰箱(-80 ℃)备用。使用CTAB方法提取样本总DNA,利用琼脂糖凝胶电泳检测DNA的纯度和浓度。
对一个一直在坚持做到最好的人来说,到达一个终点的意义不过是证实他的选择和坚持,于此,我更能理解他所说的拿到MS以后对工作和生活影响并不大,因为,很多的变化,早已经发生在他走向侍酒师大师的这一路,潜移默化,一步一个脚印。
1.6 16S rDNA的扩增和测序
采用16S rDNA V3-V4可变区通用引物341F (5’→3’: C C T A Y G G G R B G C A S C AG)和806R (5’→3’: G G A C T A C N N G G G T A T C T A AT) 进行特异性扩增(Klindworthetal., 2013),用2%的琼脂糖凝胶电泳检测PCR 扩增产物;然后进行PCR 产物电泳,用Gene JET 胶回收试剂盒切胶回收目的片段。最后采用Ion Plus Fragment Library Kit试剂盒进行测序文库的构建,经过Qubit 定量和文库检测合格后,交由北京诺禾致源科技股份有限公司进行HiSeq2500测序。
1.7 数据分析
为了得到可靠准确的分析结果,对数据进行拼接、过滤后得到有效数据(Clean reads),再对所有样品的全部 Clean reads 进行聚类,默认以97%的一致性将序列按操作分类单元(OTUs,Operational Taxonomic Units)进行聚类,选取OTUs的代表性序列进行物种注释和分析。使用相应软件绘制稀释曲线;计算Chao1、Simpson,ace指数进行Alpha多样性分析(Griceetal., 2009; Lietal., 2013);根据weight-unifrac 距离矩阵进行PCoA分析。最后,利用SPSS17.0进行数据分析,分析数据以均值±标准差体现,三组及以上数据的组间显著性差异采用单因素方差分析,并进行显著性分析,P<0.05认为差异具有统计学意义。
2 结果
2.1 各组小鼠关节炎评分
于首次胶原诱导后第21 d开始记录各组小鼠关节炎评分,结果显示, CIA.TS组小鼠的关节炎评分显著低于CIA组,差异具有统计学意义(P<0.05),说明预先感染旋毛虫缓解了胶原诱导性关节炎小鼠的关节炎症,即预先感染旋毛虫对胶原诱导性关节炎具有保护性作用(图1)。
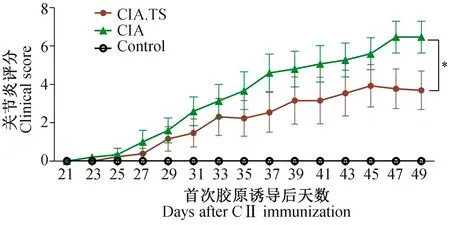
图1 各组小鼠关节炎评分结果Fig.1 The arthritic scores of mice Control:正常对照组;CIA:胶原诱导关节炎组;CIA.TS:预先感染旋毛虫关节炎组。数据用均数±标准差表示,* P<0.05;**P<0.01;ns, 表示差异无统计学意义。 Control: Control mice; CIA: CIA mice; CIA.TS: CIA mice infected with T. spiralis. The values are presented as the mean± SD. *P<0.05, **P<0.01, ns, no significance.
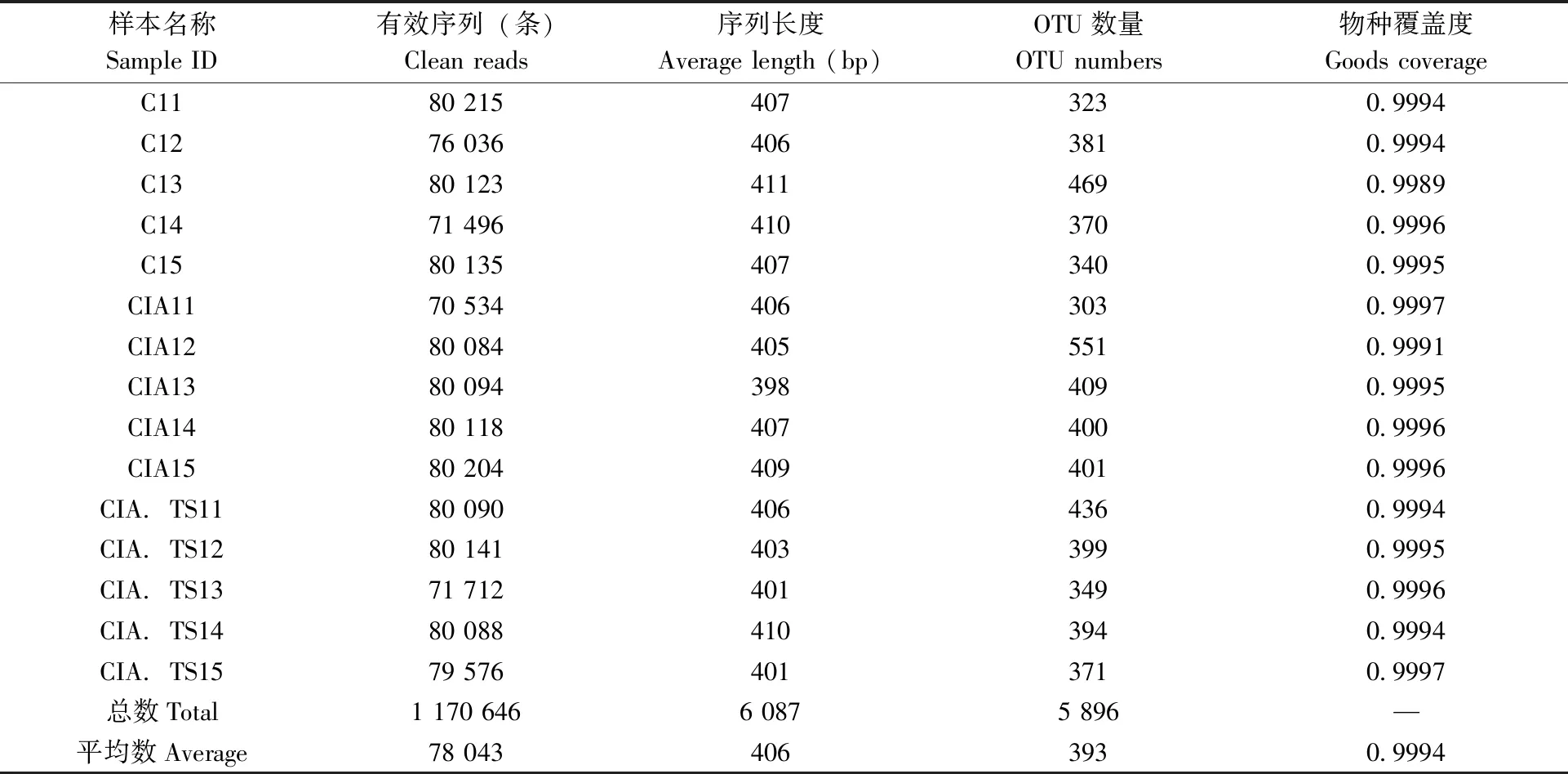
表1 各样本测序数据的统计学分析Tab.1 Statistical analysis of samples
2.2 各样本测序结果的质量分析
对15个样本的16S rDNA 基因的V3-V4 区进行扩增,从中筛选出1 170 646个优质16S rDNA基因序列,每个样本平均有78 043个序列(范围70 534~80 215),长度范围在398~411 bp,符合16S rDNA基因的 V3-V4 区序列长度。各样本的OTU 范围为303~551,肠道菌群的物种覆盖度大于0.99,表明本研究测序覆盖率和深度可满足样品16S 测序分析需求(表1)。我们随机抽取样本中一定数量的序列,并计算统计所代表的物种数目及构建稀释曲线。观察发现15个样本稀释曲线在35 000趋向于平坦,表明测序数据深度合理,加大测序量并不会产生大量的新 OTU(图2)。
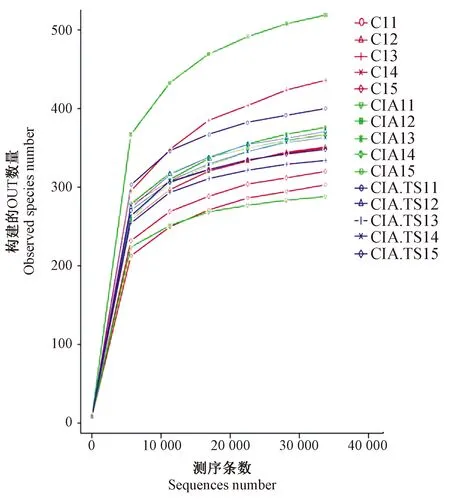
图2 各样本稀释曲线Fig.2 Rarefaction curve of each mouse C11-15:正常对照组;CIA11-CIA15:胶原诱导关节炎组;CIA.TS11- CIA.TS15:预先感染旋毛虫关节炎组。横坐标为从某个样本中随机抽取的测序条数,纵坐标为基于该测序条数能构建的OTU数量。 C11-15: Control mice; CIA11-CIA15: CIA mice; CIA.TS11-CIA.TS15: CIA.TS mice. The abscissa is the sequences number randomly selected from each mouse, and the ordinate is the observed species number that can be constructed based on the sequences number.
2.3 各组小鼠肠道菌群的Alpha多样性分析
为了解析群落内部的物种组成情况,采用Alpha多样性分析的方法对每个样品进行分析。由图3可知,与Control组相比,CIA组的Chao1、Ace和Simpson指数有上升趋势,但二者差异无统计学意义;而与CIA组相比,CIA.TS组的Chao1、Ace和Simpson指数有下降趋势,更接近Control组。该结果提示,CIA小鼠肠道菌群的丰富度和多样性有增加趋势,而预先感染旋毛虫可以在一定程度上降低关节炎小鼠肠道菌群丰富度和多样性。
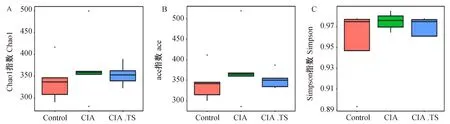
图3 各组小鼠Alpha多样性分析Fig.3 Alpha diversity of each group A:chao 1指数;B:ace 指数;C:Simpson 指数. A: chao 1 index; B: ace index; C: Simpson index.
2.4 各组小鼠肠道菌群的PCoA分析
为了对不同样本的微生物群落构成进行比较分析,我们采用主坐标分析法(PCoA,Principal Co-ordinates Analysis),每个样本以点的形式反映在图上,再通过点与点间的距离反映样本的组间差异。其中横坐标为第1主成分,其对样本差异的贡献率为54.89%;纵坐标为第2主成分,其对样本差异的贡献率为21.6%。由图4可知,CIA组与Control组小鼠肠道菌群群落之间相距较远;而CIA.TS 组小鼠的肠道群落与Control组相距较近。该结果提示,CIA小鼠肠道菌群结构发生改变,而预先感染旋毛虫改善了CIA小鼠肠道菌群结构的改变。
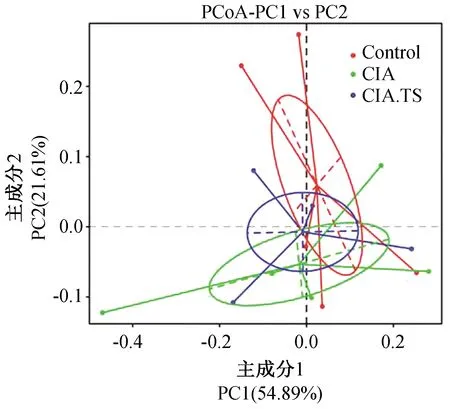
图4 各组主坐标分析Fig.4 Principal Co-ordinates Analysis of each group
2.5 各组小鼠肠道菌群在门分类水平的差异
根据测序结果中各物种在门水平 OTUs 的相对丰度数值,对各组小鼠肠道菌群中门水平排名前十的菌门进行统计学分析。由图5可知,与Control组相比,CIA组小鼠肠道菌群中的脱铁杆菌门(Deferribacteres)、变形菌门(Proteobacteria)和梭杆菌门(Fusobacteria)的丰度显著增加(P<0.05);而预先感染旋毛虫的CIA.TS组与CIA组对比,小鼠肠道菌群中的脱铁杆菌门和变形菌门的丰度显著减少(P<0.05),梭杆菌门的丰度也有减少趋势(虽无统计学差异P>0.05,但接近Control组水平)。该结果提示,CIA组小鼠肠道菌群在门水平上3种差异菌丰度显著上升,而预先感染旋毛虫部分恢复了3种菌的丰度,接近对照组水平。
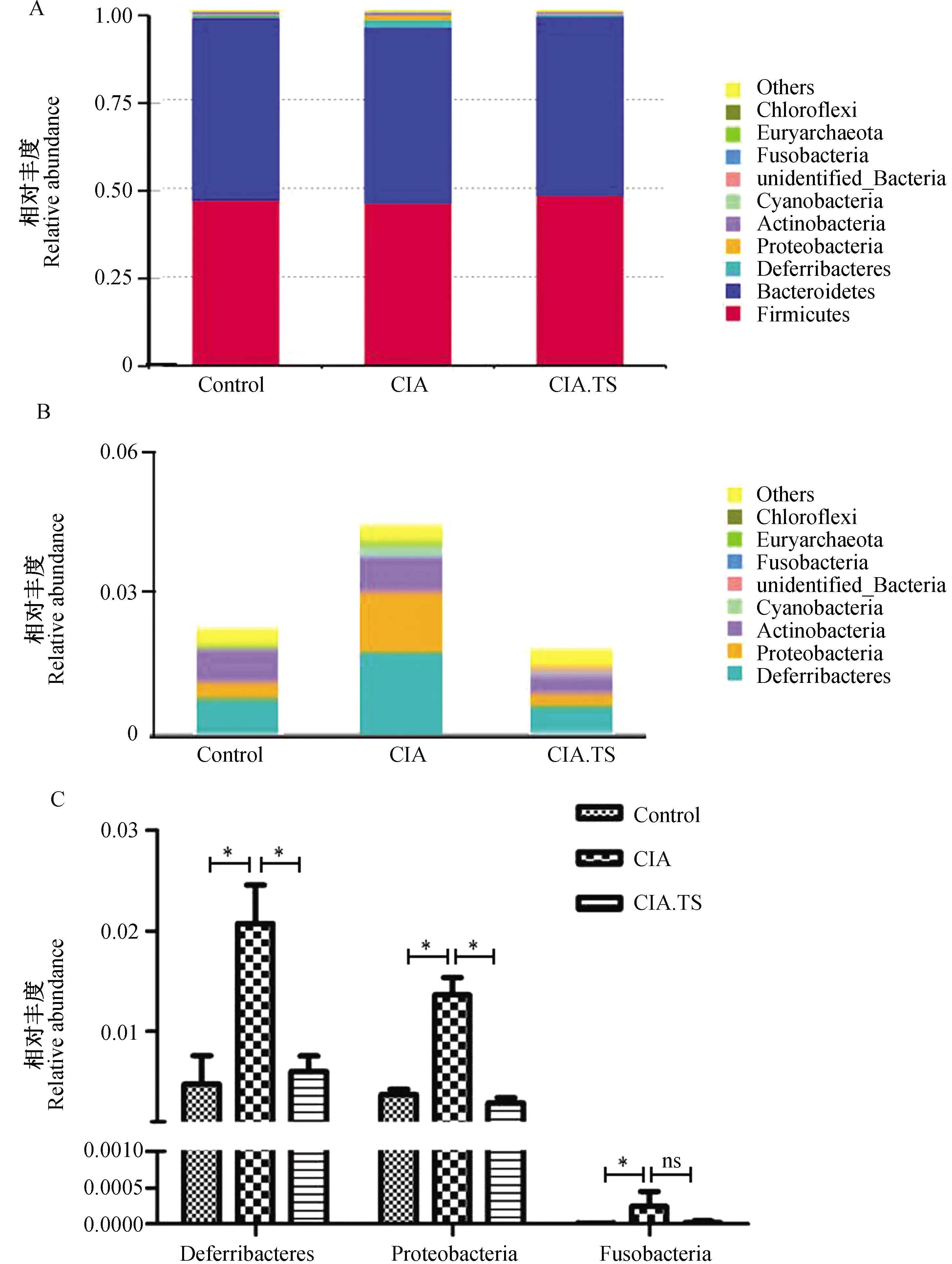
图5 各组小鼠肠道菌群在门分类水平的差异Fig.5 Differences in microbial relative abundance of each group at phylum level A:各组小鼠肠道菌群在门水平上的分布;B:各组小鼠肠道菌群在门水平上的差异分析。数据用均数±标准差表示,*P<0.05;**P<0.01;ns, 表示差异无统计学意义。 A: Distribution of the microbial communities of each group at phylum level; B: Differences in microbial relative abundance of each group at phylum level. The values are presented as the mean± SD. *P<0.05, **P<0.01, ns, no significance.
2.6 各组小鼠肠道菌群在属分类水平的差异
进一步对各组小鼠肠道菌群中物种相对丰富度排名靠前的30名菌属进行比较分析。从图6可知,与Control组相比,CIA组小鼠肠道菌群中厚壁菌门的未分类毛螺菌科(unidentified_Lachnospiraceae)、脱铁杆菌门的Mucispirillum属和变形菌门中脱硫弧菌属Desulfovibrio的丰度明显增加(P<0.05),拟杆菌门中Alistipes属和理研菌属Rikenella的丰度明显减少(P<0.05);而与CIA组相比,CIA.TS组小鼠肠道菌群中Mucispirillum属和脱硫弧菌属的丰度(P<0.05)明显减少,未分类毛螺菌科的丰度有减少趋势,理研菌属的丰度明显增加(P<0.05),Alistipes属的丰度有增加趋势。该结果提示,CIA小鼠肠道菌群在属水平上菌群结构发生改变,而预先感染旋毛虫对CIA小鼠肠道菌群失调具有明显的调节作用。
2.7 差异菌属的相对丰度与关节炎评分的相关性分析
为了进一步分析小鼠肠道菌群结构改变与关节炎疾病严重程度的关系,我们将CIA组和Control组之间的差异菌属与关节炎评分进行Spearman相关分析。由图7可知,CIA小鼠中丰度显著升高的未分类毛螺菌科、Mucispirillum属和脱硫弧菌属,其相对丰度与关节炎评分都呈显著正相关;而丰度显著降低的Alistipes属的相对丰度与关节炎评分呈显著负相关,理研菌属的相对丰度与关节炎评分也呈负相关(虽无统计学意义)。该结果提示,CIA小鼠肠道菌群结构改变与关节炎疾病严重程度具有显著相关性。
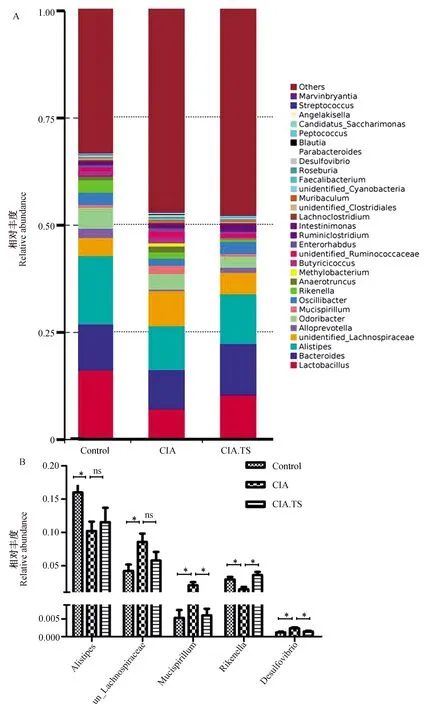
图6 各组小鼠肠道菌群在属分类水平的差异Fig.6 Differences in microbial relative abundance of each group at genus level A:各组小鼠肠道菌群在属水平上的分布;B:各组小鼠肠道菌群在属水平上的差异分析。数据用均数±标准差表示,* P<0.05;**P<0.01;ns, 表示差异无统计学意义。 A: Distribution of the microbial communities of each group at genus level; B: Differences in microbial relative abundance of each group at genus level. The values are presented as the mean± SD. *P<0.05, **P<0.01, ns, no significance.
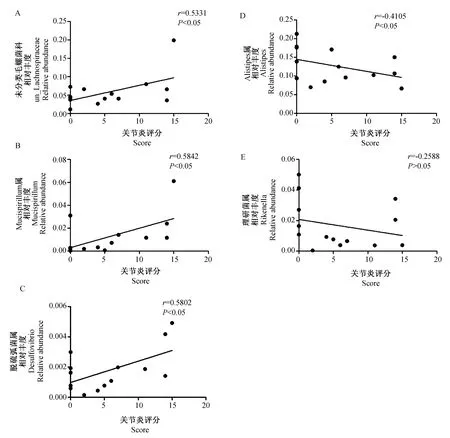
图7 属水平的差异菌相对丰度与关节炎评分相关性分析Fig.7 Spearman correlations between microbial relative abundance and arthritic scores A:未分类毛螺菌科;B:Mucispirillum属;C:脱硫弧菌属;D:Alistipes属;E;理研菌属. A: unidentified_Lachnospiraceae; B: Mucispirillum; C: Desulfovibrio; D: Alistipes; E: Rikenella.
3 讨论
近年来,大量研究报道蠕虫感染或其虫源性分子对炎症性疾病的发生和发展具有一定抑制作用。越来越多的动物模型研究表明,某些寄生虫感染对炎症性疾病的保护作用与其对宿主肠道菌群的调节作用有关(Blanderetal., 2017)。肠道菌群是一个极其复杂的生态系统,在维持机体健康方面起着至关重要的作用,被认为是携带着机体“第二基因组”的另一个“隐藏器官”(Congetal., 2015)。肠道微生物可能作为一种调节介质,通过影响黏膜及全身免疫功能而影响免疫系统疾病。本实验采用16S rDNA 测序技术对各组小鼠肠道菌群结构进行比较研究,以从肠道菌群调节的角度探究预先感染旋毛虫对小鼠胶原诱导性关节炎的改善作用。
对于关节炎患者肠道菌群多样性的改变目前尚有争论,有研究表明其菌群多样性的改变与疾病进程的不同时期相关(Liuetal., 2016b; Xiaoetal., 2018)。本研究在关节炎造模后第50 d收集小鼠的粪便,通过对16S rDNA测序分析发现,CIA组小鼠菌群的多样性较Control组小鼠有所升高。
本研究在门水平上对各菌门相对丰度统计分析结果显示,CIA组小鼠脱铁杆菌门、变形菌门和梭杆菌门的相对丰度显著增加,在属水平上未分类毛螺菌科、Mucispirillum属和脱硫弧菌属的相对丰度显著增加,Alistipes属和理研菌属的相对丰度显著减少。有研究表明,毛螺科菌与肠道炎症程度呈正相关(Liuetal., 2016b),还能够参与代谢紊乱、糖尿病和结肠癌的发生(Xieetal., 2016)。在RA患者肠道菌群的研究中也发现,在关节炎发作之后,毛螺菌科的丰度明显升高(Liuetal., 2016b)。Mucispirillum属主要寄居于肠粘液层,其主要功能为降解粘蛋白。有研究发现,Mucispirillum属与肠道炎症和自身免疫性疾病相关。例如,在感染性结肠炎的小鼠模型中,结肠表面黏液层的早期破坏与Mucispirillum丰度增加有关(Berryetal., 2015; Loyetal., 2017)。Dzierzewicz等(2006)的研究发现,脱硫弧菌是一种革兰阴性厌氧硫酸盐还原菌,能够刺激上皮免疫应答,促使巨噬细胞产生炎性细胞因子,导致人类肠道中产生有毒的硫化氢。本研究中CIA组小鼠脱硫弧菌属的相对丰度显著增加,与Dzierzewicz的研究结果相一致。另外,本研究中一个重要的发现是,关节炎小鼠中丰度显著性升高的未分类毛螺菌科、Mucispirillum属和脱硫弧菌属的相对丰度与关节炎评分呈正相关,而丰度显著性降低的Alistipes属和理研菌属的相对丰度与关节炎评分呈负相关,而预先感染旋毛虫可使CIA小鼠肠道菌群中未分类毛螺菌科、Mucispirillum属和脱硫弧菌属的相对丰度降低,Alistipes属和理研菌属的相对丰度升高,提示旋毛虫感染对CIA小鼠关节炎症的抑制作用与其对CIA小鼠肠道菌群的调节密切相关。
综上所述,CIA可导致小鼠肠道菌群严重失调,从稳态变为“炎性”状态,菌群多样性上升,尤其是一些促炎菌的丰度明显升高;而预先感染旋毛虫后,CIA小鼠的菌群丰富度有所降低,更接近正常小鼠的水平,且能有效恢复关节炎小鼠在门和属水平上肠道菌群构成和丰度的改变。因此,我们推测预先感染旋毛虫对关节炎的缓解作用与菌群调节有关,而旋毛虫感染经调节肠道菌群抑制CIA发生的可能机制还有待进一步深入研究。

