基于18S rDNA、rbcL和atpB序列的轮藻科植物的系统发育研究
任玲萱, 方 琰, 孙 双, 白 欢, 卿人韦, 兰利琼
(1.四川大学生命科学学院 生物资源与生态环境教育部重点实验室, 成都 610065;(2.国网四川省电力公司电力科学研究院,成都 610065)
1 引 言
轮藻植物(Charophyte)是一种大型的淡水藻类,其外观形态复杂,有类似“根、茎、叶”的分化.轮藻的营养体由假根(rhizoid)、茎(stem)、小枝(branchlet)构成,而茎主要由节(node)、节间(internode)、皮层(cortex)、托叶(stipulode)构成.轮藻的生殖器官为藏精器(antheridium)和藏卵器(oogonium),藏卵器顶端有5个排成一层或是10个排成两层的冠细胞(coronular cell)[1-5].上述形态均是传统轮藻植物分类的重要依据.
轮藻门(Charophyta)仅有一纲一目一科,即轮藻纲(Charophyceae),轮藻目(Charales),轮藻科(Characeae).轮藻科分为丽藻族(Nitelleae)和轮藻族(Chareae),其中前者的茎与小枝无皮层,冠细胞10个排列成2层;后者的茎与小枝有或无皮层,冠细胞5个排列成1层.又根据部分位置的细微结构,将丽藻族分为丽藻属(Nitella)和鸟巢藻属(Tolypella);将轮藻族分为拟丽藻属(Nitellopsis)、丽枝藻属(Lamprothamnium)、灯枝藻属(Lychnothamnus)和轮藻属(Chara)[1-5].轮藻科分类的研究虽是藻类中开始较早的一个类群,但因其形态结构、生殖方式比较特殊,以至于在植物分类系统中的位置以及其内部的系统分类至今还存在争论.除此之外,轮藻在水生植物向陆地植物演化的过程中也扮演着重要的角色[6],因此进一步阐述轮藻植物内部系统发育对阐释整个植物界的起源与演化历程意义重大.在传统的形态学分类研究中,常根据托叶,皮层,冠细胞和小枝的形态进行分类,但是在其亚属(subgenus)和组(section)的分类上,分类群之间有形态特征交叉重复,界线不分[2-3].因此找到合适的基因片段对轮藻物种进行鉴别,可提高物种鉴定的成功率,了解轮藻植物多样性,同时有助于进一步探讨其在植物进化过程中的地位.早在1996年Mccourt等利用rbcL基因对轮藻植物与其他植物的系统发育关系进行了研究[7].近年来,国际轮藻学者也将分子系统手段运用于轮藻植物物种再鉴定的研究中,Kato等利用rbcL序列进行分子系统发育研究,进一步验证了C. altaica的分类地位[8].Casanova从新修订了澳大利亚地区Chara-Charopsis亚属中部分轮藻藻种的分类地位,为澳大利亚今后的轮藻研究奠定了基础[9].
我国曾是轮藻资源大国[10],但对轮藻的研究较为薄弱,有长时间的研究空白阶段,仅有关于轮藻化石,轮藻与环境污染以及轮藻功能性的研究[11-14],在轮藻科植物的分类方面无详细报道.与此同时,因轮藻对生境水体的清洁度要求较高,对水质变化较为敏感[15-16],且由于近年来人类活动范围的扩大,环境污染问题日益严重,轮藻栖息地消减,使得轮藻植物正在逐年减少,变得稀有罕见,甚至濒临灭绝,很多国家将其列入濒危物种名录[17],同时也侧面说明了当今对轮藻植物研究的重要性.
本研究对中国西南地区轮藻科5个属,8种轮藻进行18S rDNA,rbcL及atpB基因扩增,并结合GenBank中其他地区轮藻的已知序列,针对中国轮藻植物的系统发育展开研究,并进一步讨论其内部分类结构.
2 材料与方法
2.1 材 料
本研究共收集到8种轮藻的12株样本,其中含轮藻族4个种,丽藻族2个种,根据《中国淡水藻志》鉴定.同时结合GenBank数据库中已知轮藻序列,共有12种轮藻的24株样本用于本研究的系统发育分析中,具体样本信息见表1.
2.2 实验方法
2.2.1 样品DNA提取、PCR扩增及测序 称取新鲜藻株前5节,称取0.5 g(湿重),经液氮充分研磨,采用植物基因组DNA提取试剂盒(Tiangen Biotech(Beijing)Co.,Ltd,Beijing,PA,China)提取全基因组DNA.以样本DNA为模板,对18S rDNA、rbcL及atpB基因进行引物设计并扩增,使用引物分别为:18S p1 (5′-GCCGAAAGACT-AAGCCATGC-3′),18S p2 (5′-CAGACACTTC ACCGGACCATT-3′),Tm=57.5 ℃;rbcL p1:(5′-TCGTGTAACTCCACAACCTG-3′),rbcL p2:(5′-TACTCGGTTAGCTACAGCTC-3′),Tm=55.4 ℃;atpB p1(5′-GCGGTCGTATTTTCAATGT ATTAGGAG-3′),atpB p2:(5′-CGCTTCTTCAGATAATTCGTCTAAACC-3′),Tm=58.2 ℃.PCR体系参照PCR反应试剂(Vazyme(Nanjing)Co.),反应条件参照文献[18-19].PCR产物进行TA克隆并送至擎科公司进行测序.
2.2.2 数据处理 将测序获得的序列采用相似性搜索法(BLAST)检查根据传统分类学鉴定方法鉴定的成功率,将鉴定正确的序列上传至GenBank.结合GenBank数据库相关序列,使用MEGA 7.0中的ClustaW软件进行多序列对比,计算和分析种内及种间的K2P(Kimura 2-parameter)遗传距离、总平均遗传距离,并分析保守位点(conserved site)、变异位点(variable site),信息位点(informative site)以及GC%[20].使用MEGA 7.0,基于18S rDNA,rbcL,atpB及18S rDNA-rbcL-atpB(3-loci)序列构建ML、NJ系统进化树[18],对系统发育树的拓扑结构的可靠性通过自展法(bootstrap, BS)进行1 000次的重复取样.使用MrBayes 3.2.5构建BI树,通过马尔科夫链(Markov Chain Monte Carlo,MCMC)随机选取进化树,以四条链(nchains=4)共运行2 000 000代,每隔1 000代保存一棵树,所得进化树的前25%被舍弃(burn-in)[21].进化树所得支持率(ML/BI/NJ)≥50%的分枝可信度较高[22],“*”表示BS值为100,“-”表示进化树拓扑结构为平行支.以上系统进化树中均已Chaetosphaeridium pringsheimii(KU130815、KJ395939、KJ395821),Chlorella sorokiniana(KP726221、KT777994、EF113498)和Chlorella vulgaris(KX495055、AB260909、D10997)作为外类群(outgroup)[23].
3 结果与分析
3.1 18S rDNA,rbcL及atpB序列多样性分析
18S rDNA,rbcL及atpB序列多样性分析结果如表2所示,18S rDNA基因的保守位点比例最高,变异位点及简约信息位点比例最小,同时GC%最高,以上均表明18S rDNA序列较为保守.且18S rDNA序列的种间遗传距离与种内遗传距离重叠,差异较小,计算得T.intricata与T.prolifera的种间距离为0.rbcL与atpB基因的分析结果相似,两者序列变异度高于18S rDNA,信息位点较多.但atpB序列种间与种内遗传距离重叠,计算得C.connivens与C.globularis的种间遗传距离为0.001.rbcL及三基因联合序列种间遗传距离与种内遗传距离无重叠,有一定差异.
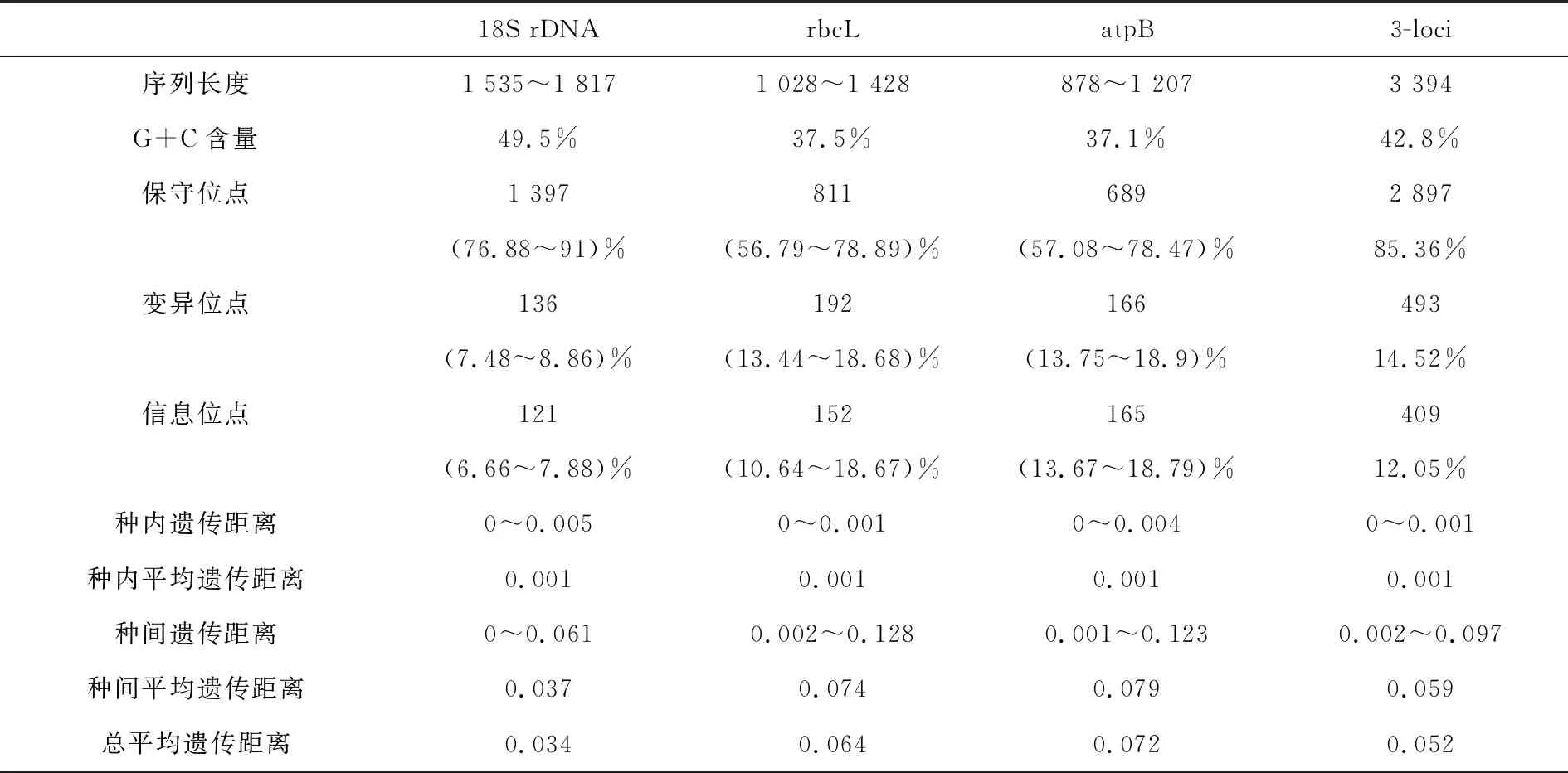
表2 18S rDNA,rbcL及atpB序列多样性分析结果
3.2 分子进化树分析
3.2.1 基于18S rDNA基因的轮藻科植物系统发育研究 基于18S rDNA基因分析所得的进化树树主要分成了两个分支(图1),第Ⅰ分支由轮藻族(Chareae)植株构成,第Ⅱ分支由丽藻族(Nitelleae)植物构成,轮藻族与丽藻族分别形成单系群,这与传统形态学分类所得轮藻科植物的分类结构一致[2-4].
在第Ⅰ分支中,轮藻属植物聚类到一支,形成单系群;灯枝藻属与拟丽藻属亲缘关系较近,成为轮藻属植物的姐妹群.轮藻属内Chara-Grovesia分支的分类结构发生混乱,其中C.connivens与C.globularis平行交错,无法分开.Chara-Chara分支的四个样本以较高的支持率聚类到一支,与其他藻种分开.在第Ⅱ分支中,丽藻族被分为丽藻属和鸟巢藻属两个分支,传统形态学分类也将丽藻族划分为两个属,分子进化树的拓扑结构支持形态学分类[2-4].鸟巢藻属内部Tolypella-Rothia与Tolypella-Tolypella以很高的支持率将鸟巢藻属分为两支,但在Tolypella-Rothia内部,由于18S rDNA较为保守,序列变异较小,导致T.intricata与T.prolifera聚类到一支,无法分开.
18S rDNA虽较为保守,无法区分属内个别藻种,但较适于轮藻科植物族与属之间的分类研究,但进一步对属内轮藻植物进行分类研究需要利用变异程度更高的序列.
3.2.2 基于rbcL基因的轮藻科植物系统发育研究 图2为基于rbcL基因的轮藻科植物系统发育分析结果,进化树的拓扑结构与18S rDNA所得分析结果有一定差异,进化树没有明显形成两大支,轮藻族和丽藻族没有聚类形成单系群,各属分支形成并系群,鸟巢藻属作为轮藻族与丽藻属的姐妹群出现,rbcL基因分析所得进化树的拓扑结构与传统形态分类结构差异较大,分子分析结果不支持形态学分类[2-4],因此rbcL基因不适用于讨论轮藻科植物科内族与属间的分类关系.
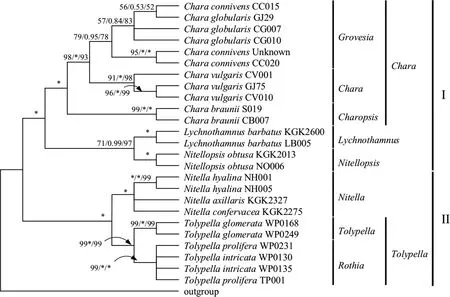
图1 基于18S rDNA基因的轮藻科植物分子系统进化分析Fig.1 The phylogenetic analysis of characeae based on 18S rDNA gene
在轮藻族分支内,灯枝藻属与拟丽藻属以100%的支持率聚类到一支,Chara-Grovesia分支的分类仍然存在混乱.在鸟巢藻属分支中,18S rDNA基因无法区分开的T.intricata与T.prolifera两种藻种,经过rbcL基因分析后,属内的分类结构得到改善,因此rbcL基因较适用于鸟巢藻属藻种的分类研究.
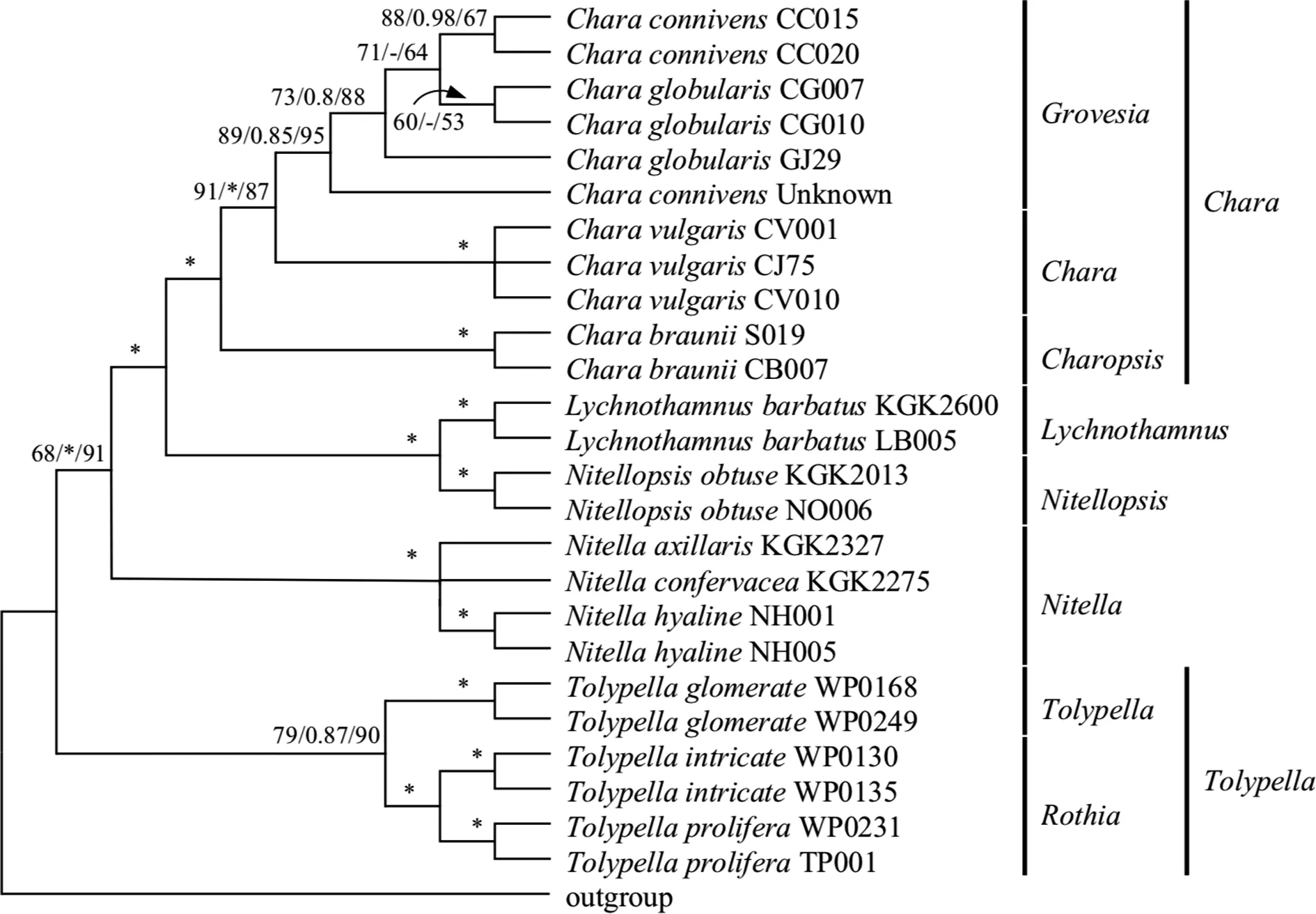
图2 基于rbcL序列的轮藻科植物分子系统进化分析Fig.2 The phylogenetic analysis of characeae based on rbcL gene
3.2.3 基于atpB基因的轮藻科植物系统发育研究 基于atpB基因的轮藻科植物系统发育分析结果(图3)与rbcL基因分析结果基本一致,轮藻族与丽藻族没有形成两大分支,且与rbcL基因分析结果相比,各分支的支持率较低,同时Chara-Grovesia分支轮藻植物的分类结果没有得到改善.综上所述,仅利用atpB单基因进行系统发育分析不能得到较好的轮藻科植物的分类结果.
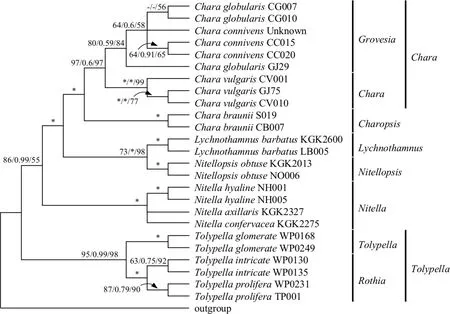
图3 基于atpB序列的轮藻科植物分子系统进化分析Fig.3 The phylogenetic analysis of characeae based on atpB gene
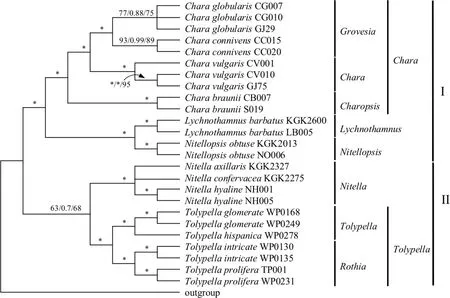
图4 基于3-loci序列的轮藻科植物分子系统进化分析Fig.4 The phylogenetic analysis of characeae based on 3-loci gene
3.2.4 基于3-loci基因的轮藻科植物系统发育研究 图4为基于18S rDNA-rbcL-atpB三基因联合(3-loci)的轮藻科植物系统发育分析结果.3-loci所得进化树的拓扑结构与18S rDNA分析所得进化树结构类似,进化树被分为轮藻族(第Ⅰ分支)与丽藻族(第Ⅱ分支)两大分支.在第Ⅰ分支中,灯枝藻属与拟丽藻属聚类到一起,作为轮藻属植物的姐妹群,三基因联合后,轮藻属中Chara-Grovesia分支分类混乱的问题得到解决,C. connivens与C. globularis分别以较高的支持率分开.在第Ⅱ分支中,丽藻族被分为丽藻属和鸟巢藻属两大分支,两属内轮藻均以各自的亚属分类到一起,得到较好的进化树结构.
通过三基因联合分析后,进化树各分支的支持率得到明显的提高,BS值多为100.同时三基因联合可以很好的解决轮藻科植物的分类问题,无论是族与属的分类关系,还是属内易混种的分类,均以较高的支持率分开,得到较完美的拓扑结构,分子分类结构与形态学分类结构基本一致,支持形态学分类结构[2-4].
4 讨 论
本研究的研究结果表明,从种内、种间遗传距离和进化树的拓扑结构来看,18S rDNA基因可将轮藻科植物分为轮藻族与丽藻族两大支,与传统形态学分类结构一致,较适用于轮藻科内族与属分类关系的研究.基于rbcL,atpB基因的分析后,进化树没有形成明显的两大支,而是轮藻科各属形成并系群,但利用rbcL与atpB基因分析后可以得到较好的鸟巢藻属植物分类结构.三基因联合后轮藻科植物得到较完美的进化树,族与属的分子分类结构与形态分类一致,同时可将易混淆的C.connivens与C.globularis区分开,从而解决轮藻属植物分类混乱的问题.C.connivens与C.globularis两者除分子分类上常存在混淆外,其外观形态也有很多相似之处:茎中等粗壮,均为三列式皮层,原生列与次生列直径相等;托叶双轮,均退化为瘤状突起;刺细胞单生,不发达.唯一较为突出的差别是C.connivens为雌雄异株,而C.globularis为雌雄同株.Wood和Imahori认为应将C.connivens视为C.globularis的一个变种,命名为C.globularis f. connivens R. D. Wood,且在形态学分类上他们认为雌雄是否异株不应作为轮藻植物分类的重要标准[2].但本研究结果表明,C.connivens与C.globularis两者虽易混淆,但经过18S rDNA-rbcL-atpB三基因联合后,可以将两者分开,在分子水平上证明二者为不同种藻类,因此在形态学分类上应将雌雄是否异株应作为轮藻形态分类的重要标准.
除此之外,在传统轮藻植物分类中,Wood和Imahori认为灯枝藻属是轮藻属与丽枝藻属的姐妹群,同时拟丽藻属作为轮藻属与灯枝藻属的姐妹群被分到较远的一支[2].Meiers认为灯枝藻属应作为轮藻属植物的一种[24].但在本研究中,18S rDNA,rbcL,atpB以及三基因联合分析所得进化树结果均表明灯枝藻属和拟丽藻属的亲缘关系最近,这与传统轮藻植物分类系统较为不同.在Pérez等人的研究中也提出灯枝藻属和拟丽藻属可能具有较强的亲缘关系[25],同时两者在外观形态上也有一定的相似之处,均为托叶单轮、无皮层等[3].但由于样本数量较少,两者在分类上的确切问题还需进一步深入研究.
在不同的环境下,轮藻植物的外观形态可能受到光强、水温、营养条件、水流速度以及生长在淡水域或淡咸水域等因素的影响,但具体的作用机制尚未明确[26-27],因此仅靠形态学对轮藻植物进行分类是不够完善的,且不同轮藻之间有形态特征交错,导致分类界限不清.因此在今后的研究中,应对轮藻植物分类开展更深入的研究,将传统形态特征分类与分子分类相结合,这是今后国内轮藻植物分类研究的方向.本研究对轮藻科植物的系统发育进行了初步研究、作出了有益的尝试,对今后轮藻分类系统的完善有一定借鉴意义,希望能够引起更多学者对日渐稀少、有濒临灭绝危险的轮藻植物研究的关注.

