药对丹参-当归作用阿尔茨海默病的网络药理学机制研究
郭小岚, 李 迪, 汪先花, 颜学玲, 熊 航, 时 政
(成都大学四川抗菌素工业研究所&医学院, 成都 610106)
1 引 言
药对,作为临床中医遣药组方常见的配伍形式,组成精炼但基本具备中药配伍的特征,临床应用行之有效,按照一定的理论依据和组合原则,将2味相对固定药物的配伍组合,以发挥协同增效或配伍减毒等的作用[1-2].丹参,双子叶植物唇形科.其药理作用、临床应用广泛,归纳得出,在治疗心血管疾病、消化系统疾病、神经系统疾病及抗菌、清除炎症方面具有重要疗效[3].当归,伞形科植物,其主要化学成分对机体的造血系统、循环系统、神经系统、免疫系统等多个系统具有显著的药理作用[4].丹参重在活血化瘀,当归作用补益略偏补血[5],中药按照“君臣佐使”的原则配伍一组药,可达到增效减毒的作用[6-7],药对丹参-当归在神经系统方面都有良好的临床作用,配伍后体外抗氧化能力优于单味药材[8],既补益又活血化瘀.众多发现,丹参和当归作为单味药材作用阿尔茨海默病的机制有了一定进展,但目前对于药对丹参-当归多成分、多靶点、多代谢途径作用阿尔茨海默病的机制尚需进一步明确.
阿尔茨海默病(Alzheimer’s disease, AD)是特征为进行性认知功能障碍和行为损害的中枢神经系统退行性病变,临床表现为记忆障碍、失语、失用和失认,以及视空间机能障碍、人格行为改变和执行功能障碍等.现治疗阿尔茨海默病的常用临床药物有多奈哌齐、加兰他敏、利斯的明、他克林等,但其毒副作用较强.目前发现,众多中药有效成分(如黄酮类、苷类、生物碱类等)对AD有较好的治疗作用且毒副作用弱[9].在AD的发病机制方面存在着很多假说,包括如下:①金属离子的代谢紊乱和信号通路的改变;②脑供血和营养的不足;③淀粉样蛋白前体蛋白(amyloid precursor protein,APP)、早老素基因(presenilin,PSEN)的突变和载脂蛋白E(Apolipoprotein E,ApoE)等位基因的突变;④线粒体紊乱;⑤神经生长因子的缺乏;⑥Aβ毒性假说;⑦Tau假说等[10].虽有众多假说,但关于AD的发病机制目前尚未完全明确.现目前,主要研究乙酰胆碱酯抑制剂和N-甲基-D天门冬氨酸受体阻滞剂干预阿尔茨海默病,但其并不能逆转疾病过程,且存在副作用较多.因此,对其治疗仍然存在很多问题.单一靶点治疗疾病临床效果欠佳,而中药具有多成分、多靶点、调节方式多样的特点,其次相对比西医单靶标、单成分的传统研究思路来研究中药,难以体现中药的系统性[11].因此我们可以利用一个分析平台,系统地研究中药作用某一疾病的机制,进行探讨研究.现目前网络药理学在我国已经被广泛应用,包括数据收集、靶点预测、网络分析与可视化、多组分相互作用和信号通路预测等[12].其主要思想与传统中医药的整体观相互补,系统而透彻的分析了中药治病的作用机制.本文采用此想法,对药对丹参-当归作用阿尔茨海默病的机制进行探讨研究.
本文采用类药性(drug-likeness,DL)评估,DL≥0.18,口服利用度(oralbioavailability,OB)≥30%作为筛选标准,然后通过中药系统药理学分析平台(TCMSP)寻找与候选化合物相关的潜在靶点,进而在数据库中查阅相关文献收集阿尔茨海默病相关靶点,人工检索候选化合物的潜在靶点是否与阿尔茨海默病相关,最后利用Cytoscape3.5.1软件构建候选化合物-靶点网络、靶点-通路网络以及化合物-靶点-通路网络,为药对丹参-当归作用阿尔茨海默病的网络药理学机制提供理论依据.
2 材料与方法
2.1 材 料
化学成分的筛选利用中药系统药理学分析平台(TCMSP)(http://lsp.nwsua.edu.cn/tcmsp.php)得到丹参、当归两味中药相关的所有化学成分,其中丹参有202个活性成分,当归有125个活性成分.目标活性成分的筛选标准主要依据TCMSP数据库中的建议药物筛选标准:类药性(Drug-likeness,DL)≥0.18、口服利用度(Oralbioavailability,OB)≥30%等.
2.2 方 法
2.2.1 化学成分靶点预测和阿尔茨海默病靶点的收集 通过TCMSP平台寻找丹参、当归18个化学成分的相关潜在靶点.根据TCMSP平台所提供的阿尔茨海默病潜在靶点,以及对大量有关阿尔茨海默病发病机制文献的调研,人工检索剔除无关靶点,作用于阿尔茨海默病发病机制的相关靶点在Uniprot数据库将靶蛋白校正为官方名称,潜在靶蛋白信息见表3.
2.2.2 作用网络分析 将上一步骤获取的靶点蛋白信息通过注释、可视化和整合发现的数据库(database for annotation,visualization and integrated discovery,DAVID)数据库进行GO(Gene Ontology)及KEGG通路注释.候选化合物-靶点网络、靶点-通路网络以及化合物-靶点-通路网络的构建均使用Cytoscape软件.
3 结 果
3.1 化学成分的筛选
通过条件筛选,选取了丹参的16个化学成分,当归的2个化学成分,共有18个化学成分,当归的主要活性成分是β-谷甾醇,豆甾醇,见表1;丹参的主要有丹参酮Ⅱ、丹参新酮、隐丹参酮等,见表2.
表1 当归活性成分及类药性值
Tab.1 The active components and medical value of Angelicasinensis.

编号Mol IDMolecule NameMWOB/%DLM01MOL000358beta-sitosterol414.7936.910.75MO2MOL000449Stigmasterol412.7743.830.76

表2 丹参活性成分及类药性值

表3 药对丹参-当归活性成分作用潜在靶蛋白的信息
3.2 化学成分靶点预测和阿尔茨海默病潜在靶点
丹参、当归18个化学成分通过TCMSP分析平台找到430个靶点.筛选出丹参当归中与阿尔茨海默病相一致的靶点18个,将这18个靶点投入到Uniprot数据库,得到所有靶点对应编号.
3.3 作用网络分析
综合以上得到的数据,用软件Cytoscape3.5.1构建候选化合物-靶点网络,见图1;靶点-通路网络,见图2;使用Merge功能将其合并成为化学物-靶点-通路图,见图3;结合KEGG数据库进行通路分析.

图1 化合物-靶点作用网络图
内圈椭圆形表示的是药对中的活性成分,外圈四边形表示靶点.
预测药对丹参-当归中具有潜在作用阿尔茨海默病活性成分的化合物-靶点作用网络图如图1.当归中的主要作用成分为β-谷甾醇,豆甾醇,丹参的主要有丹参酮Ⅱ、丹参新酮、隐丹参酮、二氢丹参酮等.这些化学成分当中含有BCL2、NOS2、PTGS2、CHRM1、CHRM2、CHRNA7、HTA2、HTA3等18个靶点作用于阿尔茨海默病.分析发现得,甾醇、丹参酮作为潜在化学成分在抗阿尔茨海默病作用中发挥着重要作用.

图2 靶点-通路网络图
靶点-通路图可见图2,GSK-3β参与Wnt信号通路、细胞周期、磷酸化途径、海马发育等通路;CHRM1、CHRM2、NOS2参与钙离子信号途径,神经受体-配体相互作用;CHRM1、CHRM2作用肌动蛋白骨架调节;还有作用于胆碱能突触的ACHE、CHRNA7、CHRM2;显示了不同通路之间也有共同作用的靶点,结果映射了药对丹参-当归作用阿尔茨海默病多个靶点、多个代谢途径共同协调的特点.
从图3中可以看到,药对丹参-当归中的CHRNA7,CHRM1,PTGS2,ACHE,APP,GSK-3β,HTR2A,NOS2为高纬度节点,这些节点在AD治疗过程中扮演者重要的角色.GO生物学通路及KEGG代谢通路富集分析,药对丹参-当归的活性成分主要作用通路为钙信号通路、Wnt信号通路、神经受体-配体相互作用、海马发育、胆碱能突触、血清能突触、磷酸化调控等.说明药对丹参-当归通过多成分、多靶点、多种调节方式作用阿尔茨海默病.
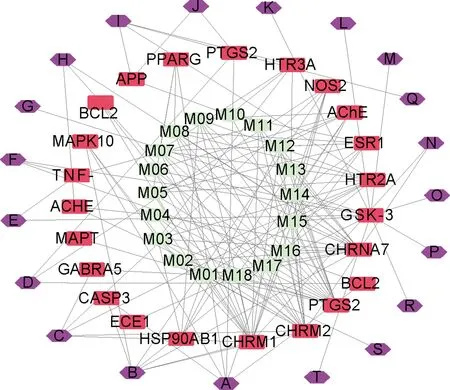
图3 化合物-靶点-通路图
其中外圈六边形表示参与的通路,中圈四边形表示作用的靶点,内圈椭圆形表示药对的活性成分
4 讨 论
目前,乙酰胆碱酯酶是AD治疗的重要靶点.已知美国FDA批准的5个AD治疗药物,其中有4个为AChE抑制剂.它们主要通过抑制AChE催化位点,以减少突触间隙乙酰胆碱的降解,从而进一步提高ACh水平,促进胆碱能神经传递功能,进而改善患者的认知和记忆功能[13].治疗AD经典的靶蛋白胆碱酯酶(CHE)主要有两类:一为乙酰胆碱酯酶(ACHE),主要作用水解神经递质乙酰胆碱(ACH);二为BCHE.因此存在一种假说:应采用针对ACHE以及BCHE的胆碱酯酶抑制剂以治疗阿尔茨海默病.
M1受体激动剂(CHRM1),其通过干预β淀粉样蛋白的生长,产生神经生长因子样作用,减弱CHRM1产生的神经毒性和tau蛋白的过度磷酸化,以及缩短后超极化的时间等途径来保护神经元细胞[14].M1受体还可以通过与BACE1的直接相互作用,作用BACE1蛋白,降低Aβ的形成,再经过蛋白酶体-泛素通路的降解,进一步抑制Aβ的生成和累积,减少具有神经毒性的淀粉样斑沉积[15].CHRM1通过调节淀粉样β前体蛋白APP的代谢,以及作用于tau蛋白,减少过度磷酸化,有助于延缓AD的病情的发展,提高患者学习记忆能力[16].
GSK-3β是GSK-3的一种亚型,GSK-3作为主要的tau激酶,在AD病程发展中的记忆障碍、小胶质细胞介导的炎症、tau蛋白磷酸化、炎性因子的释放以及突触丢失和神经元死亡等方面,从多途径发挥抗AD的作用[15,17].APP代谢异常和tau蛋白异常磷酸化过度是影响阿尔茨海默病(Alzheimer’s disease,AD)发展的重要因素.GSK-3β在参与淀粉样蛋白质前体(amyloid precursor protein,APP)代谢的前提下,还作用于tau蛋白过度磷酸化过程,GSK-3β的表达与活性的异常是导致神经元细胞凋亡的常见原因[18-19].故GSK-3β与AD的病理变化有密切的联系.APP具有抗Aβ神经毒性作用,阻止脑组织神经元数目的减少、斑块沉积与神经元凋亡.
KEGG代谢通路富集分析结果见图3,主要作用通路为MAPK激酶途径,钙离子信号途径、肌动蛋白细胞骨架的调节、神经性的配体-受体相互作用Wnt信号通路、细胞周期、细胞凋亡调控、磷酸化途径等[20],这代表药对丹参-当归中的活性成分作用于多个靶点及多条代谢通路来干预AD的发生发展.在MAPK激酶途径中,MAPK信号转导刺激引起细胞产生相应反应进而调节细胞分化、增殖、凋亡,来保护神经元组织细胞[21].
从靶点-通路网络作用图中看出APP,GAK-3β对海马发育、细胞周期有一定的调节作用,而CHRM1.CHRM1,GABRA5,NOS2在神经性的配体-受体相互作用上发挥着重要作用;Wnt信号通路和钙离子信号途径,减轻炎症反应,加大细胞存活率,中枢神经系统受到损伤后机体会启动Wnt信号通路,进而促进中枢神经系统的再生修复[22-23],在某种程度上对阿尔茨海默病有着治疗作用.
中药成分多样,多靶点多通路协同作用,通过以上数据显示:药对丹参-当归作用于钙信号通路、Wnt信号通路、神经受体-配体相互作用、海马发育、胆碱能突触、血清能突触、磷酸化调控等代谢通路,其可以调节细胞的周期、抗凋亡、抗炎、抗氧化及保护神经元细胞和抑制胆碱酯酶活性,增强突触形态改善学习记忆障碍从而发挥改善学习记忆的能力,发挥抗阿尔茨海默病作用,但本研究预测的药对丹参-当归潜在化学成分及其靶点蛋白需要进一步的实验验证.

