基于表面等离子共振技术的抗体浓度检测方法建立及验证*
王永智,叶华跃,聂利芳,雷高新,李磊,彭福中,乔正
(1.泰州医药高新技术产业园区疫苗工程中心,泰州 225300;2.江苏大同盟制药有限公司,泰州 225300)
单克隆抗体药物因其具有特异性强、疗效好、副作用少等优点逐步成为肿瘤、自身免疫疾病、心血管等疾病的理想治疗药物[1-4],已成为生物医药领域发展的最热门方向[5]。而单克隆抗体作为复杂的蛋白大分子药物,不但相对分子质量大,而且还存在蛋白翻译后修饰,因此药物的质量控制是其研发和生产过程中不容忽视的环节[6],也成为全球药品监管机构关注的热点[5]。其中,单克隆抗体药物的含量测定是其质量控制中一个重要参数,准确的含量测定对单克隆抗体药物残留杂质的限量控制、比活性的计算及产品的分装等环节均具有重要意义[7]。表面等离子体共振(surface plasmon resonance,SPR) 是一种物理光学现象[8-9],由Wood在1902年首次发现[10],近年来逐步成为生化分析领域重要的分析手段和研究工具[11]。SPR法可检测出几乎所有的生物大分子物质,广泛应用于蛋白质组学、细胞生物学和药物研发等领域的研究[12]。
Protein A(Staphylo coccal Protein A)来源于金黄色葡萄球菌,可以与IgG的Fc片段发生特异性的结合反应[13]。因此,本研究采用Protein A芯片,利用Protein A可以与IgG的Fc片段发生结合的特性,基于SPR技术建立一种高通量的快速、简便、准确的测定单克隆抗体含量的方法。
1 材料与方法
1.1仪器与试剂 生物分子相互作用分析仪(BIAcore T200,GE公司);S系列Protein A芯片(GE公司,批号:10268296);10×HBS缓冲液(GE公司,批号BCBV7063);Surfactant P20(GE公司,批号:8072939);10 mmol·L-1pH值1.5盐酸甘氨酸缓冲液(GE公司,批号:10259550);人IgG1对照品(Abcam公司,批号:GR3218380-4);RPMI1640无血清培养基(Gibco公司,批号:1991640);单抗Mab1(江苏某制药公司,批号:B20180912)。
1.2方法建立与优化 将仪器温度设置为25 ℃,待仪器温度稳定后,将样品以10 μL·min-1的流速注入仪器,样品与Protein A芯片结合时间设为30 s,读取Ru值。上样结束后,以pH值1.5、浓度10 mmol·L-1盐酸甘氨酸溶液以30 μL·min-1的流速再生30 s。
1.3方法验证
1.3.1专属性考察 本研究考察了空白辅料溶液、RPMI1640无血清培养基及上样缓冲液(1×HBS缓冲液)对抗体测定是否有影响。将单抗Mab1溶液、人IgG1对照品以1×HBS缓冲液分别稀释至1 000 ng·mL-1,空白辅料溶液、RPMI1640无血清培养基、上样缓冲液(1×HBS缓冲液)按同样条件进行稀释,按照建立的方法进行检测分析,考察空白辅料溶液、RPMI1640无血清培养基及上样缓冲液是否对抗体检测有干扰,确定方法的专属性。
1.3.2线性范围 取人IgG1对照品,以1×HBS缓冲液依次稀释至20 000,10 000,5000,2000,1000,500,200,100,50,20 ng·mL-1按照建立的方法进行检测分析,每个浓度测试3次,以人IgG对照品浓度为横坐标,以响应值(RU)值为纵坐标,绘制标准曲线,确定线性范围。
1.3.3检测限及定量限 以0浓度的抗体样品对应的平均Ru值作为仪器噪音,以信噪比3:1对应的抗体浓度作为该方法的检测限,以信噪比10:1对应的抗体浓度作为该方法的定量限。
1.3.4准确度 取人IgG1对照品,以空白辅料缓冲液分别稀释至高、中、低(5000,500,50 ng·mL-1) 浓度,每个浓度平行制成3份,按照建立的方法进行检测分析,计算每个准确度溶液浓度及回收率。
取IgG对照品,以RPMI1640无血清培养基分别稀释至高、中、低(5000,500,50 ng·mL-1) 浓度,每个浓度平行制成3份,按照建立的方法进行检测分析,计算每个准确度溶液浓度及回收率。
1.3.5重复性实验 取单抗Mab1溶液以1×HBS缓冲液稀释至高、中、低(5000,500,50 ng·mL-1) 浓度,每个浓度平行制成3份,按照建立的方法进行检测分析,计算样品的平均浓度及RSD值。
1.3.6中间精密度实验 由两名不同实验人员A、B各自独立操作,分别取单抗Mab1溶液稀释至1000 ng·mL-1,按照建立的方法进行检测分析,各重复检测6次,计算样品的平均浓度及变异系数(coefficient of variation,CV)。
1.3.7耐用性 取单抗Mab1溶液稀释至1000 ng·mL-1,通过计算流速改变(8,10,12 μL·min-1),结合时间改变(25,30,35 s)以及样品处理后室温放置不同时间(0,2,4,6,8 h)后进行检测,计算得出样品平均浓度及RSD值。
2 结果
2.1方法建立与优化 在建立基于SPR技术的抗体浓度测定方法时,需要考虑的参数主要有上样速度、结合时间及再生条件。上样速度及结合时间两个参数共同影响建立的方法检测抗体浓度的线性范围。适宜的再生条件则需满足每次再生将Protein A结合的抗体分析物全部洗脱下来并不影响芯片表面Protein A结合抗体Fc端的活性。经过摸索,建立的检测方法条件如下:仪器温度设置为25 ℃,上样速度为10 μL·min-1,结合时间为30 s,芯片再生条件为以pH值1.5浓度为10 mmol·L-1的盐酸甘氨酸溶液以30 μL·min-1的流速再生30 s。
2.2专属性考察 见图1,IgG1对照品、Mab1抗体溶液均与Protein A芯片产生结合信号,空白辅料溶液、RPMI1640无血清培养基、上样缓冲液均无结合信号。结果表明空白辅料溶液、RPMI1640无血清培养基均与Protein A芯片无非特异性结合,对抗体检出无干扰,该方法专属性强。
2.3线性范围 以人IgG1对照品浓度为横坐标,以相应单位(Ru)为纵坐标作图,绘制标准曲线。结果表明,抗体浓度在20~20 000 ng·mL-1的范围内,响应单位(RU)与IgG1浓度呈现良好的线性关系,R2为1,见图2。
2.4检测限及定量限 经实验,0浓度抗体样品平均Ru值为0.14,以0.14作为仪器的噪音。以仪器3倍噪音对应的抗体浓度作为此方法的检测限,以仪器10倍噪音作为此方法的定量限。经计算,该方法的检测限为2.07 ng·mL-1,定量限为11.16 ng·mL-1。
2.5准确度 以空白辅料溶液稀释人IgG1对照品,按照建立的方法进行检测分析的结果见表1。经计算,人IgG1对照品5000,500,50 ng·mL-1高中低3个浓度在空白辅料中回收率分别为102.68%,102.68%,99.26%,9份样品平均回收率为101.54%,RSD值2.23%。以RPMI1640无血清培养基溶液稀释人IgG1对照品,按照建立的方法进行检测分析的结果见表2。
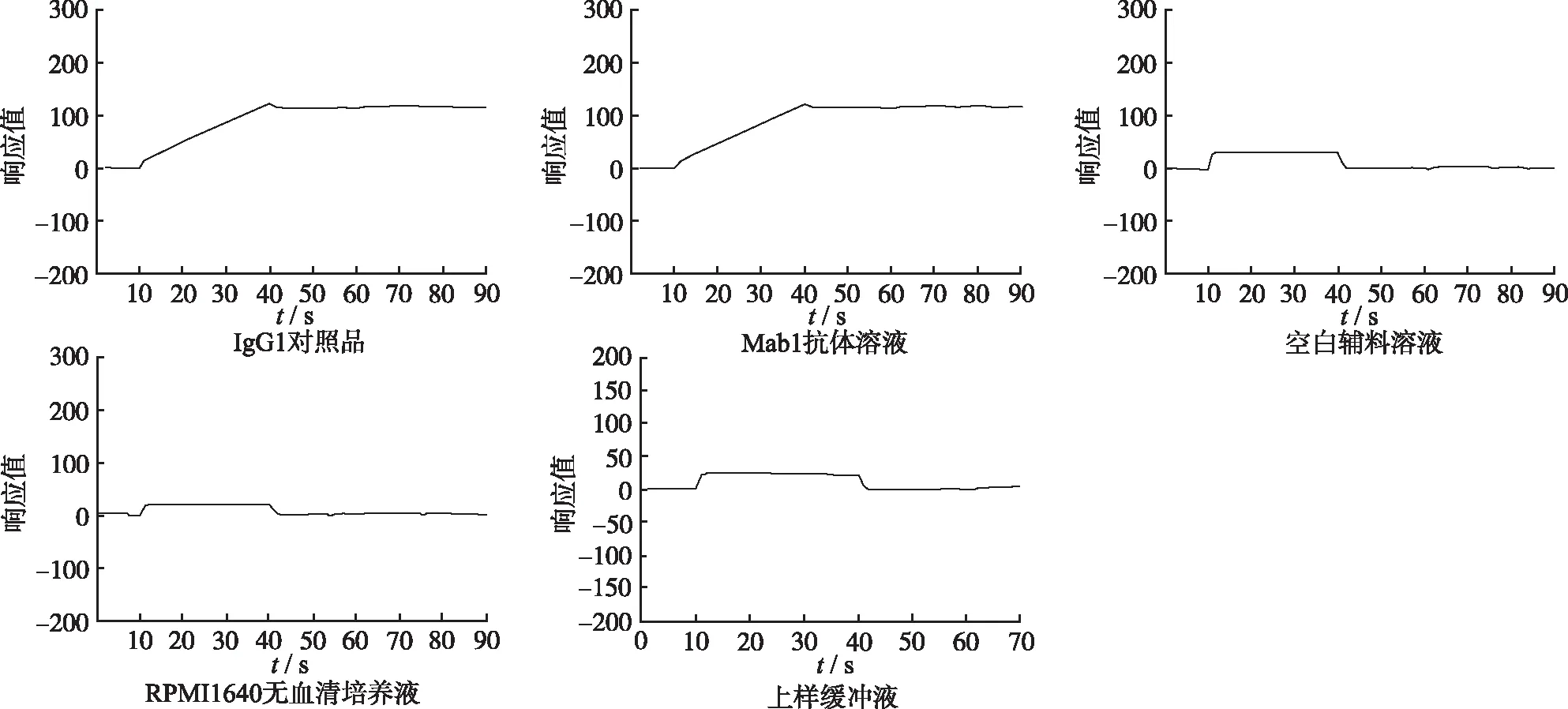
图1 专属性考察结果
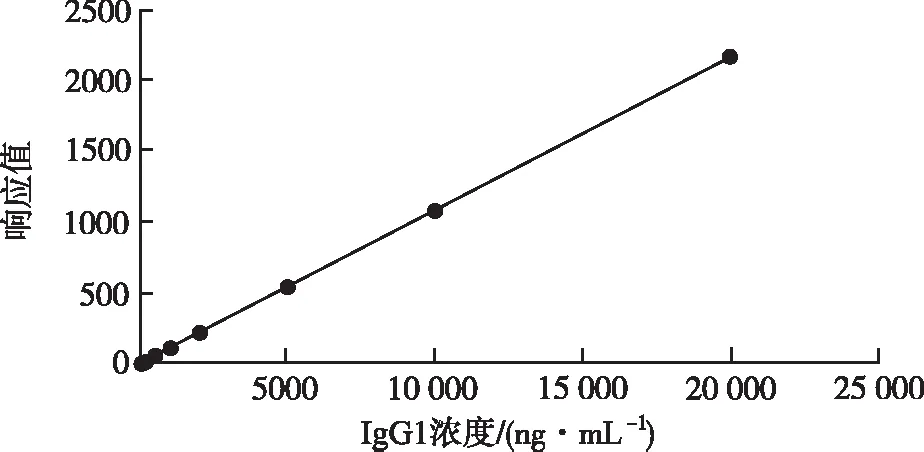
图2 方法线性范围考察结果
Fig.2Theanalysisresultsoflinearrangeofthemethod
表1 空白辅料加标回收率
Tab.1TherecoveryrateofIgG1standardinblankexcipient
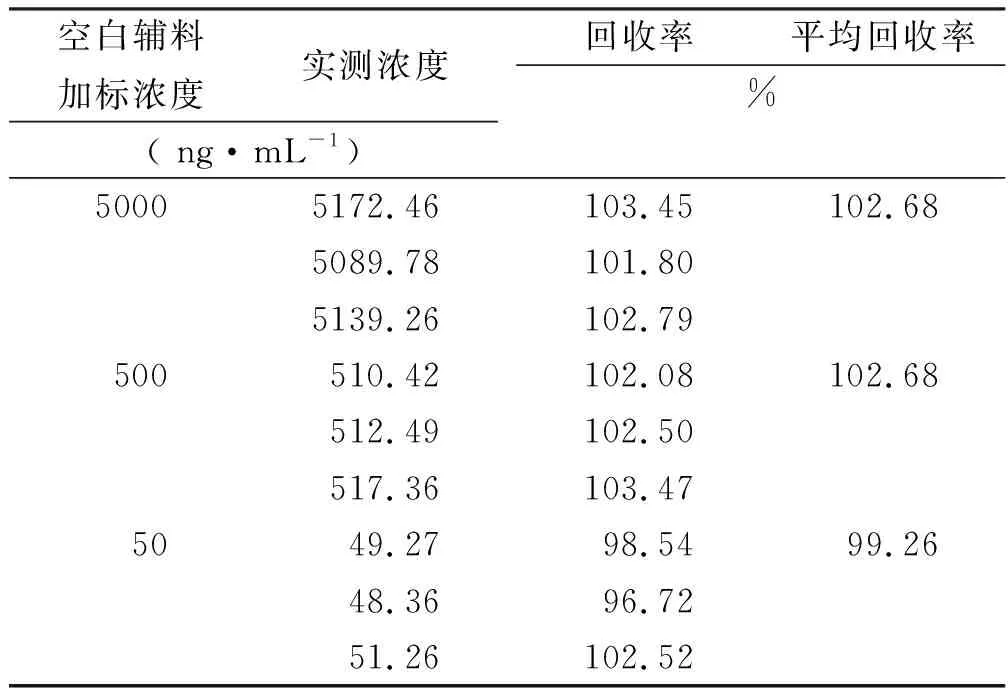
空白辅料加标浓度实测浓度( ng·mL-1)回收率平均回收率%50005172.46103.45102.685089.78101.805139.26102.79500510.42102.08102.68512.49102.50517.36103.475049.2798.5499.2648.3696.7251.26102.52
经计算,5000,500,50 ng·mL-1人IgG1对照品在RPMI1640无血清培养基中的回收率分别为105.07%,100.88%,96.22%,9份样品平均回收率为100.72%,RSD值4.23%。上述结果表明,该方法加标回收率好,准确度高。
表2 RPMI1640无血清培养基加标回收率
Tab.2TherecoveryrateofIgG1standardinRPMI1640medium(serumfree)
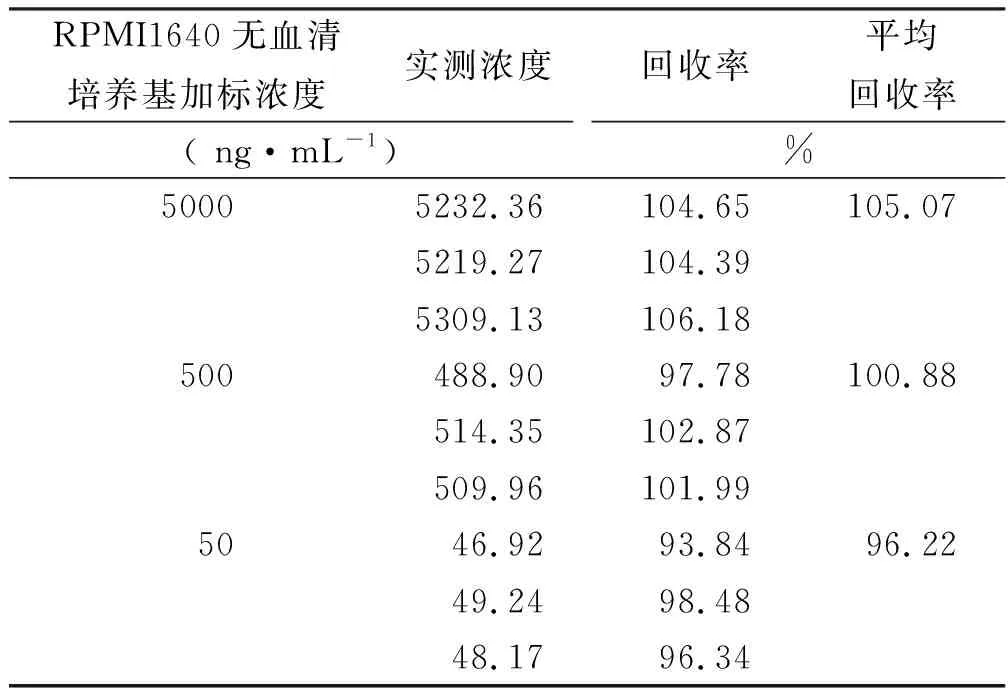
RPMI1640无血清培养基加标浓度实测浓度( ng·mL-1)回收率平均回收率%50005232.36104.65105.075219.27104.395309.13106.18500488.9097.78100.88514.35102.87509.96101.995046.9293.8496.2249.2498.4848.1796.34
2.6重复性实验 取单抗Mab1溶液以1×HBS缓冲液稀释至高、中、低(5000,500,50 ng·mL-1)浓度,每个浓度平行检测3次,经计算,5000,500,50 ng·mL-1单抗Mab1样品重复性所得RSD分别为2.04%,2.37%,2.27%(表3)。表明该方法重复性好。
2.7中间精密度 两名不同实验人员各重复检测6次,结果见表4,经计算,变异系数为0.49%。表明该方法中间精密度高。
表3 重复性实验结果
Tab.3Theanalysisresultsofrepeatabilitytest

样品浓度实测浓度(ng·mL-1)RSD/%50005092.532.045219.225303.71500523.792.37526.64504.075048.722.2747.9750.16
表4 中间精密度实验结果
Tab.4Theanalysisresultsofintermediateprecisionng·mL-1

实验人员123456A1043.631041.771038.071040.851038.071039.92B1038.241035.281039.461052.421034.361032.68
2.8耐用性 本研究考察了流速(8,10,12 μL·min-1),结合时间(25,30,35 s)以及样品处理后室温放置不同时间(0,2,4,6,8 h)等条件的微小改变对检测结果的影响。结果显示:流速改变检测结果平均值为1005.01 ng·mL-1,RSD值为4.39%;结合时间改变检测结果平均值为993.40 ng·mL-1,RSD值为6.03%;样品处理后室温放置0~8h之内,检测结果平均值为1017.12 ng·mL-1,RSD值为2.64%(表5)。结果表明,该方法耐用性好,实验条件微小改变对检测结果无影响,抗体Mab1溶液在8h之内保持稳定。
3 讨论
抗体药物作为一种大分子药物,由于其结构的高度复杂性,对其产品的质量控制和管理更加严格。抗体含量测定为抗体药物质量控制及抗体表达株筛选、评价的一个重要参数。目前,常用的单抗药物含量测定方法有消光系数法、酶联免疫吸附法、高效液相色谱法等,但是这些方法尚存在一些不足,如易受样品基质干扰、样品前处理复杂、方法灵敏度低、重复性差、定量范围窄等。不能满足抗体药物质量控制的高要求[6,14]。近年来,一些新的检测方法也被用于抗体含量的测定。邓春平等[15]建立了一种均相时间分辨荧光法(HTRF)用于单克隆抗体含量的测定,该方法抗体含量测定范围为25~1000 ng·mL-1,线性相关系数在0.99以上,平均回收率为98.9%。该方法将荧光共振能量转移技术(fluorescence resonance energy transfer,FRET)与时间分辨荧光技术(time-resolved fluorescence,TRF)两者的优点结合起来,建立了一种高灵敏度、高通量的抗体含量测定方法。但该方法需要对抗原进行标记,样品前处理复杂,同时需要用到镧系元素(如Eu)标记的抗人IgG(Fc)的抗体,限制了该技术的应用。曾秀引等[6]建立了一种采用生物膜干涉技术(bio-layer interferometry,BLI)的高通量抗体浓度快速检测方法,线性范围0.781~400 μg·mL-1,准确度范围94.46%~114.00%。但该方法线性范围窄、定量限较高(1 μg·mL-1),不能用于低浓度抗体样品的浓度测定,限制了该检测技术的应用范围,不适用于表达量较低单克隆抗体细胞株前期筛选工作。本研究利用表面等离子共振技术建立的单克隆抗体药物浓度测定方法,专属性好,重复性好,准确度高,耐用性强并且检测线性范围较宽。该方法在空白辅料及RPMI1640无血清培养基中3个浓度水平平均回收率较高,方法不易受到样品基质影响,对样品基质要求较低。因此,相比较于传统的消光系数法、酶联免疫吸附法、高效液相色谱法等,本法具有以下优势:样品处理简单,仅需要经过滤过、稀释、离心等步骤即可直接上机检测,简化实验流程,提高实验效率。同时该方法线性范围宽(20~20 000 ng·mL-1),检测限(2.07 ng·mL-1)及定量限低(11.16 ng·mL-1),既适用于单克隆抗体药物制剂、中间品样品的含量测定又适用于单克隆抗体发酵上清等样品中抗体浓度测定。另外,BIAcore T200支持96和384孔板,可实现抗体浓度的高通量测试,因此也特别适合单克隆抗体细胞株筛选阶段大批量抗体样品浓度的检测及评估。
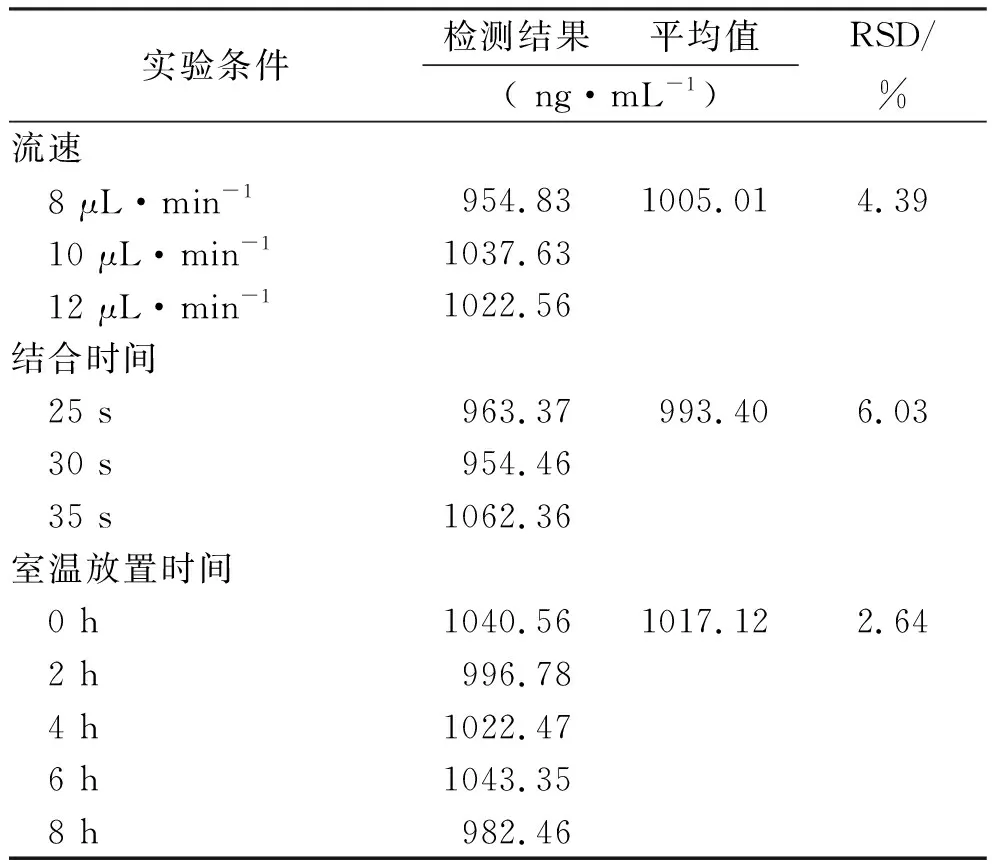
表5 耐用性考察结果

