胰腺囊性瘤的预测和诊治策略
苏小茉,郭明洲
中国人民解放军总医院消化内科,北京 100853
随着人口的老龄化,胰腺癌的发病率呈快速增长趋势,已成为危害人类健康的常见肿瘤。多数胰腺癌是通过胰腺囊性瘤(pancreatic cystic neoplasm,PCN)的恶性演变而发生,随着影像学检查水平的提高,PCN的诊断率不断提高,其临床偶然发现率为10%,而年龄大于70岁的偶然发现率可高达30%[1]。根据从正常-上皮内瘤变-胰腺癌-转移癌的克隆演变数学模型的分析[2-4],从胰腺癌变的起始阶段发展为胰腺癌平均需要11.7年,然后,需要另外6.8年时间发展为转移癌,最终死亡时间平均需要延后2.7年[4]。因此,积极开展对PCN的研究,深入了解胰腺癌变的早期事件及机制,有望获得积极有效的防治策略。本文将对PCN的防治策略进行讨论。
1 PCN的发病情况及分类
胰腺囊性疾病主要通过CT和磁共振检查发现,在人群中的发病率为2.4%~19.6%[5-6]。按照胰腺囊性病变的性质可分为非肿瘤性囊性病变(假性囊肿)和肿瘤性囊性病变/PCN[7]。因为胰腺假性囊肿占胰腺囊性病变的绝大多数,而面临鉴别诊断和处理困难的PCN仅占10%[8]。另一项对300例患者的尸检中发现,约50%的患者发现小的囊性病变,且其发生率随着年龄的增长而增加。尽管大多数囊性病变是非肿瘤性的,但其中3.4%患者的囊性病变具有上皮的不典型增生[9-10]。随着年龄的增长,PCN发病率呈增加趋势,PCN可能通过分子水平的累积性改变而发生恶变成为胰腺癌。预计到2030年胰腺癌将成为全球第二位的致死性肿瘤[11-12]。PCN分为胰腺浆液性囊腺瘤(serous cystic neoplasm, SCN)占32%~39%,黏液性囊性瘤(mucinous cystic neoplasm,MCN)占10%~45%,导管内乳头状黏液瘤(intraductal papillary mucinous neoplasm, IPMN)占21%~33%,实性假性乳头状瘤(solid pseudopapillary neoplasm, SPN)<10%,胰腺囊性神经内分泌瘤(pancreatic cystic neuroendocrine neoplasm, PCNN)<10%,导管腺癌囊性蜕变(ductal adenocarcinoma with cystic degeneration, DACD)<1%,腺泡细胞囊腺癌(acinar-cell cystadenocarcinoma, ACC)<1%[8]。
来自韩国全国范围的一项调查报道显示,在1 064例PCN中,IPMN占41.0%,MCN占 25.2%,SPN占18.3%,SCN占15.2%,腺泡细胞囊性瘤(acinar-cell neoplasm, ACN)占0.2%,成熟的畸胎瘤(mature teratoma, MT)占0.1%[13]。而来自美国Memorial Sloan-Kettering 癌症中心的一项报道显示,1995年1月至2010年1月在该研究所注册的1 424例PCN患者中,主胰管导管内乳头状黏液瘤(main duct intraductal papillary mucinous neoplasm, MD-IPMN)占25%,分支胰管导管内乳头状黏液瘤(branch duct intraductal papillary mucinous neoplasm, BD-IPMN)占26%,MCN占11%~18%,SPN占5%,PCNN占4%~7%,SCN占13%~23%。PCN的发病率以每年约8%的速度呈直线上升趋势[1]。最近发表的PCN欧洲循证指南认为,在普通人群中PCN的发生率为2%~45%[5, 14-17],其中PCN的CT发现率为2.1%~2.6%[18-19],MRI/MRCP的发现率为13.5%~45%[6, 16, 20]。目前PCN的真正发病率尚不清楚,而在临床上的最大挑战是如何鉴别其属于哪个类型,因为PCN的生物学行为可以表现为良性、交界性或恶性病变。在诊断PCN大小方面,超声内镜(endoscopic ultrasonography, EUS)与CT/MRI相似,但是EUS识别囊壁结节的效果优于CT/MRI;而仅仅依靠EUS不能鉴别非黏液性囊性瘤和IPMN、MCN及恶变的良性病变[21]。
2 常见PCN的临床特征
尽管70%的PCN患者在临床上无任何症状,但也可表现为腹部或背部疼痛、无法解释的消瘦、黄疸、脂肪泻或触摸到腹部肿块,这些症状和体征均不是PCN的特征性表现。来自Memorial Sloan-Kettering 癌症中心的一项报道表明,其临床偶然发现率为10%,而年龄>70岁的偶然发现率可高达30%,平均诊断年龄为67岁(15~95岁),在15年时间里(1995年1月至2010年1月)发病率以每年8%的速度呈直线增加[1]。
2.1 IPMNPCN中IPMN占25%,且IPMN占手术切除胰腺恶性病变的20%~30%[22]。IPMN是一个老年性疾病,其发生率随着年龄增长而增加。与结肠腺瘤-结肠癌的演变过程相似,IPMN可通过渐进性恶变而成为PAC。Yachida等依据基因突变的分子事件,提出了一个从正常-上皮内瘤变-胰腺癌-转移癌的克隆演变数学分析模型[2-4]。按照该模型的分析结果,从胰腺癌变的起始阶段发展为胰腺癌平均需要11.7年,然后,需要另外6.8年时间发展为转移癌,最终死亡时间平均需要延后2.7年[4]。因此,明确胰腺癌变的早期事件有望获得积极有效的防治策略。
IPMN在1982年被首次报道,其组织形态学特征是胰腺导管囊性扩张,并伴随着乳头状的突出和产生大量黏液。典型的IPMN表现为多囊性的肿块且与扩张的主胰管或分支胰管相通,约50%发生在胰头部,也可发生于胰腺的任何部位[23]。一般情况下,主胰管IPMN发生浸润性癌的概率明显高于分支胰管IPMN。主胰管IPMN发生浸润性癌的概率为57%~92%,而分支胰管IPMN发生浸润性癌的概率为6%~46%[9]。
MRI检查优于CT检查,特别是能够更好地显示囊肿和胰管之间的连通。下列放射影像学特征表明为恶性病变,包括主胰管或分支胰管扩张>10 mm;具有实性成分;壁上结节;或腔内成分的钙化[24-26]。EUS能够获得与MRI/CT 相似的与恶性病变相关的特征,特别是获得的CT结果模糊时,能发挥重要作用[27-28]。经内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP) 虽然可以替代MRI/CT,但与CT检查相比,在PCN的检测方面,特别是明确囊肿和胰管之间的交通情况或预测IPMN良恶性方面并不具备优势[29]。
2.2 MCN几乎所有的MCN患者都是中年女性,>90%的MCN位于胰腺的体和尾部。多数患者无症状,其主要临床症状包括全身不适、恶心和消化不良。而典型的IPMN常发生于男性、患者年龄较大、肿瘤多位于胰头部而出现胆管堵塞的症状。因此通常仅仅依赖这些临床特征鉴别IPMN和MCN。典型的MCN在形态学上常为单腔或多腔的圆形肿块,由一层厚的纤维囊壁包裹黏稠的囊液,与胰管系统无交通。其典型的组织学特点为上皮细胞下的卵巢样间质。尽管PET-CT无法准确区别浸润性癌,以及鉴别良恶性囊性瘤,但最近的研究表明,18-FDG PET对于鉴别良恶性IPMN和其他囊性瘤明显优于IAP指南(the International Association of Pancreatology指南,也称Fukuoka指南)[30]。囊液中CEA浓度(CEA>192 ng/ml)有助于鉴别MCN的良恶性。目前对于MCN良恶性的术前鉴别仍很困难,因为应用EUS下细针穿刺常常不能准确获得浸润性的MCN样品。蛋壳样钙化、存在实性成分或囊壁上的结节,以及肿瘤直径>3 cm,提示为浸润性MCN[31-33]。
2.3 SCN典型的SCN是一个蜂窝状的囊性结构,中心为纤维性的瘢痕样结构并钙化,这一结构被Compagno和Oertel 于1978年首次描述[34],绝大多数的SCN是良性肿物。在一个大样本的人群调查中,对1 735例SCN患者进行了23.5个月的随访和检测发现,那些<1 cm且无可疑风险特征的肿物仅有0.3%的恶变风险,1~2 cm的SCN有0.6%的恶变风险,2~3 cm的SCN有1.3%的恶变风险[35]。另一项研究对719例最初被选定为非手术治疗的患者(囊肿的平均大小为1.5 cm且无可疑的恶性特征)进行了28个月的影像学检查随访(6~175个月),1.7%发展为浸润性癌,其中1.1%为腺癌[1]。
对于SCN瘤体较大的患者,仅仅依靠影像学分析很难与IPMN和MCN区别,需要应用EUS进一步鉴别,EUS可以进一步描述囊肿的形态,及应用细针穿刺获得囊液并分析囊液的CEA水平。有时,良性的SCN和癌前的SCN在影像学上的特征重叠,因此如何鉴别这些病变是一个挑战性的问题[21,36]。
2.4 非常见的PCN
2.4.1 SPN: SPN是1934年被首次描述,对于SPN的特征缺乏深入细致的描述且被称为不同的名称,1996年WHO对其进行了统一的分类和命名。同MCN一样,SPN主要发生于年轻女性(>90%),其诊断的中位年龄<30岁,甚至可以发生于2岁儿童,可以发生于胰腺的任何部位[8,23,37]。SPN无特异的症状和体征,可表现为腹痛和腹胀[38]。SPN是低级别的恶性肿瘤,由单层内皮细胞构成的实性和假性乳头状结构组成。在显微镜下呈实性的假性乳头样成分和出血坏死假性囊性成分。SPN大体标本呈现大的、圆形的单一肿块(大小为8~10 cm)[39]。影像学的特征是呈边界清晰的包块,包含不同组成的软组织和坏死组织,这种包裹的壁较厚,约30%的囊周发生钙化。多数SPN是良性病变,约15%为恶性病变[40]。 另外一项报道认为所有的SPN均为低度恶性肿瘤。
2.4.2 PCNN: PCNN在CT检查的动脉期,在肿块的边沿可以看到血管的增生,但是SCN可能具有相似的影像学特征而影响其鉴别诊断,PET检查的特异性非常有限,因此其诊断只能依赖于组织学检查[14, 41-43]。
2.4.3 淋巴上皮囊性病变(lymphoepithelial cysts, LEC): LEC是1985年首次报道的罕见的胰腺囊性病变,男性患者较女性患者发病率高,其高发年龄为50~70岁,可能发生于胰腺的任何部位。约50%的LEC患者无任何症状,而是被偶然发现,可能发生腹痛等非特异性症状。CT等影像学检查可显示为薄壁的单叶或多分叶的囊性病变。在显微镜下呈现为淋巴组织包围的单层鳞状上皮细胞,囊内包含由细胞碎屑、角质和胆固醇结晶组成的致密物质。LEC为良性病变。
其他少见的胰腺囊性病变,如胰腺外分泌细胞癌可以表现为囊性病变,以及胰腺导管癌退行性变呈现为胰腺囊性病变[44]。
3 良恶性PCN的预测和鉴别诊断标志物
PCN在临床上的最大挑战是良恶性的鉴别诊断,目前胰腺癌仍缺乏准确有效的诊断标志物。1979年首次发现的CA19-9 (carbohydrate antigen 19-9) 是唯一被批准用于胰腺癌诊断的标志物。CA19-9是由胰管上皮细胞、胃肠道上皮细胞及胆道系统产生。CA19-9也可由胰胆管肿瘤和胃癌产生。CA19-9被广泛用于胰胆和胃肠道肿瘤的筛查、诊断、分级、早期复发的监测和治疗效果的预测。CA19-9在胰腺癌中常常并不升高(敏感性为77%),特别是在早期阶段,且>15%的患者肿瘤体积已明显增大,但仍不能检出CA19-9或在正常范围内。CEA不常用于PAC的诊断,因为其敏感性明显低于CA19-9(敏感性为37%),但CEA的检测能够协助判断胰腺癌的进展情况,CEA结合CA19-9能够反映胰腺癌患者的治疗效果及复发情况[45-47]。
3.1 蛋白质标志物SCN发生恶性转化的比例很低,常被认为是良性囊性瘤。鉴别SCN和黏液分泌性囊性瘤(IPMN和MCN)能够准确地制定治疗和检测方案。
目前临床常用的血清学肿瘤标志物检测均无法鉴别SCN和黏液分泌性囊性瘤。在EUS下穿刺获得囊液,有研究发现,CEA和CA724的水平在黏液分泌性囊性瘤的囊液中升高,囊液的CEA>192 ng/ml提示为黏液分泌性囊性瘤(其敏感性为79%),但CEA结合其他肿瘤标志物并不能提高其准确性,且通过检测CEA并无法鉴别IPMN和MCN。更重要的是,CEA的水平与不典型增生的程度和恶变情况无对应关系[48-49]。最近一项报道表明,SCN囊液中的VEGF-A水平较黏液分泌性囊性瘤(IPMN和MCN)的囊液水平明显升高[50-51]。Maker等报道,囊液中的MUC2和MUC4以及血清中MUC5AC升高表明为高危性的IPMN(恶性)[52]。Cao等发现MUC5A和endorepellin的糖基化形式能够鉴别黏液分泌性和非黏液分泌性的PCN[53]。30%~40%的胰腺癌表达HER2,而最近应用Trastuzumab治疗PAC的临床试验并未获得有效的结果[54]。
3.2 基因突变绝大多数的胰腺癌是由显微镜下被称为胰腺上皮内瘤变(pancreatic intraepithelial neoplasia, PanIN)的癌前病变演变而来,而PanIN是源于小的终末胰腺导管(<5 mm)。根据不典型增生的程度,PanIN又可分为PanIN-1、PanIN-2、PanIN-3。PanIN-1是由正常的导管上皮细胞转化为高的柱状细胞,细胞内可以看到黏液成分;PanIN-2可以看到明显的细胞异型增生和核浓染(nuclear crowding);PanIN-3可以看到广泛的核浓染、核型不规则、核分裂象、假性乳头状生长和管腔内的坏死成分[55-56]。而IPMN和MCN则是肉眼可见的囊性瘤,IPMN和MCN也可表现为低级别、中等和高级别的上皮内瘤变(PanIN-1、PanIN-2和PanIN-3)[57]。最终,这些癌前病变可能发展为PAC[1,57]。
胰腺癌的恶变过程同结肠癌一样呈渐进性过程,其分子水平的异常也呈现为累积性的改变。PanIN-1遗传学异常包括端粒的缩短、KRAS的激活性突变和CDKN2A缺失;PanIN-2表现为CDKN2A缺失和TP53灭活性突变;而PanIN-3则表现为TP53、SMAD4和BRCA2的灭活性突变[58-60]。Wu和Furukawa等通过测序分别在IPMN的囊液和组织中发现17个基因的突变,包括KRAS和GNAS的高频突变[61-62]。Sugiura等[63]发现RNF43在IPMN中发生突变。MCN同IPMN一样存在RNF43和KRAS的突变,但MCN无GNAS基因突变。与IPMN和MCN不同,SCN和SPN从未发现RNF43、KRAS或GNAS的突变。SCN含有Von-hippel-Lindau(VHL)基因的突变,而SPN存在CTNNB1的突变,而这些突变在MCN和IPMN中从未出现。KRAS、TP53、SMAD4、CDKN2A、RNF43、ARID1A、GNAS、RREB1、PBRM1和TGFβR2等基因在胰腺导管癌中频繁发生突变[64-65]。最近的研究发现,约10%的胰腺癌组织标本在一个DNA损伤修复基因中(ATM、BRCA1、BRCA2和PALB2)存在种系或体细胞的突变,这些突变可能增加顺铂和poly-(ADP-ribose) polymerase(PARP)抑制剂治疗的敏感性[65]。尽管上述研究发现了BRCA1/2和PALB2的突变,但这些突变组织并无相应的基因表达缺失,可能与肿瘤细胞含量较少或肿瘤异质性相关[66]。
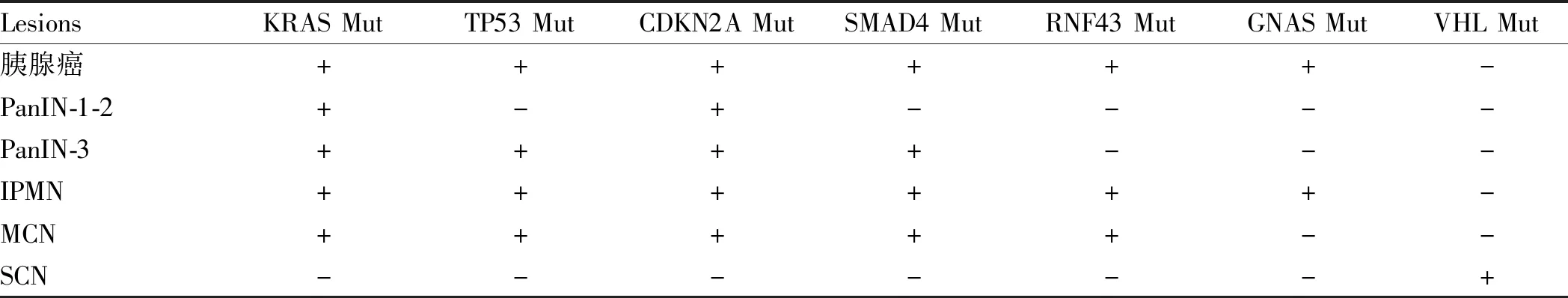
表1 PanIN、IPMN、MCN、SCN基因突变特点Tab 1 Characteristics of gene mutation of PanIN, IPMN, MCN, SCN
由于PCN的恶变机制尚不清楚,目前仍缺乏胰腺癌防治的分子靶向药物。Shibata等发现,单独的KRAS激活性突变不足以诱导小鼠的IPMN模型,在KRAS突变的小鼠模型中过表达HER2可以诱导IPMN[67]。Taki 等应用GNAS结合KRAS基因激活性突变,成功建立了IPMN的小鼠模型。但是,值得注意的是仅仅GNAS的基因突变并不能引起IPMN的发生,必须同时具有KRAS基因的激活性突变才能引起IPMN的发生[68]。
3.3 DNA甲基化我们过去的研究发现,GATA-4、GATA-5、APC、BRCA1、P16、P15、RARβ、P73、MGMT、MLH1、RASSF1A等基因在PAC中频繁发生甲基化,其中DNA损伤修复基因的甲基化频率分别为MGMT 40%、MLH1 23%、APC 50%、BRCA1 56%[69-71]。Yi等发现,BNC1和ADAMTS1在胰腺癌中频繁发生甲基化[72]。Sato等通过分析8个基因在PanIN-1、PanIN-2、PanIN-3的甲基化发现,启动子区甲基化发生于PanIN-1,其甲基化率随着癌变过程而增加[73]。 Hong等通过分析7个基因(SPARC、SARP2、TSLC1、RELN、TFPI2、CLDN5、UCHL1)的甲基化,在IPMN到胰腺浸润性导管癌的恶变过程中,其甲基化率呈增加趋势[74]。我们过去的研究通过对15个抑癌基因在IPMN中甲基化的分析发现,与细胞周期调控相关的基因p16、APC和p73,以及DNA损伤修复基因MLH1和MGMT频繁发生甲基化[75]。
3.4 非编码RNARyu等发现,miR-21、miR-217、miR-17-3p在SCN囊液中的水平较MCN和IPMN囊液的水平明显升高[76]。Farrell等进一步验证了miR-21在黏液分泌性囊性瘤的囊液中升高并发现miR-221在黏液分泌性囊性瘤中升高[77]。另外的一些研究还发现miR-216和miR-217在MCN中升高[78-79]。这些具有潜在应用价值的miRNA标志物能否成为临床诊断/鉴别诊断标志物,有待进一步扩大样本进行验证。
4 PCN的监测和处理策略
处理PCN的关键是鉴别哪些PCN是良性的,哪些PCN具有恶性倾向,然后采取相应的监测和预防措施。同时,应尽量避免因过度治疗而造成不必要的疾病状态。关于PCN的处理原则,已经形成不同的共识和指南。虽然这些指南之间有一些争议的观点,但对于如何判断其恶性倾向,其基本内容非常相似。但由于多数指南并不是依据循证医学证据获得的共识,对于最佳治疗和随访策略仍无清晰的共识。这些共识/指南包括the International Association of Pancreatology (IAP; Fukuoka guidelines, FG),这是第一个关于IPMN处理的指南,最初发表于2006年,随后于2012年和2017年进行了2次更新[5,80-81];The American Gastroenterological Association (AGA)指南发表于2015年[82];The European Study Group on Cystic Tumor of the Pancreas[11,83]指南发表于2013年;American College of Gastroenterology (ACG)指南发表于2018年[84]。目前普遍认为对于怀疑IPMN或MCN的PCN患者均应进行监视。具有恶性倾向的特征包括囊壁结节或实性成分、囊壁增厚、瘤体>3 cm、胰管直径的短期变化及远端胰腺的萎缩、生长速度>2 mm/年及主胰管扩张>5 mm,均应进行认真监视或切除。主胰管扩张>10 mm是手术的绝对适应证。由于SCN很少恶性转化,目前也只有少数的文献报道。如果SCN的诊断非常明确且无症状,不需要进一步的处理和监视。MCN主要发生于年轻女性,且绝大多数位于胰体或胰尾,其恶变的风险为11%~38%,所以手术治疗是最佳方案[44]。IAP指南认为主胰管IPMN恶变概率为70%[80];而AGA指南认为主胰管IPMN恶变概率为42%[85]。如果EUS下穿刺活检确定具有囊壁结节、主胰管壁增厚并含有管内黏液、或主胰管壁有结节、阳性或可疑的细胞学证据,IPMN≥3 cm,以及所有的MCN均应手术切除[80]。IAP指南建议对于无恶性倾向特征的分支胰管IPMN,<1 cm应进行2~3年的MRI随访检查;1~2 cm IPMN应进行2年的随访;对于MRI检查2~3 cm的IPMN每3~6个月做一次EUS检查[80]。AGA指南则建议,手术仅限于细胞检测阳性和/或存在EUS证实以下3个特征中的2个特征:实性成分、扩张的胰管(>5 cm)和瘤体>3 cm,该指南同时建议切除具有症状患者的囊性瘤[82]。对于无高风险特征的<3 cm的囊性瘤,AGA指南建议1年内进行MRI监测,然后每2年检查一次,共5年,如无变化可停止监测。而>3 cm的囊性瘤则推荐第1年末进行一次检查,然后每2年检查一次。内镜下摘除的适应证包括<4 cm的单个或单叶,与主胰管不通,且仅限于无法外科手术切除的PCN患者,并且应由非常有经验的内镜医师操作[44]。
对于非浸润性的MCN,手术是根治疗法,不需要术后监测,而浸润性的MCN应同胰腺癌一样进行术后监测[80]。对于IPMN,术后监测主要根据切沿不典型增生的程度,AGA指南建议切沿无不典型增生的患者不需要监测,切沿有不典型增生或恶性病变应每年进行MRI检查。IAP指南认为,切沿有重度不典型增生的IPMN应再次手术达到切沿至少为中度不典型增生,并每2年随访一次[44,86]。EUS引导下应用酒精和/或紫杉醇摘除(ablation)PCN可能发生2%~10%的并发症,包括胰腺炎、腹膜炎、静脉栓塞和腹痛;另外,几乎所有的患者可能发生酒精造成的炎症和毒性作用。因为该方法并不是完全摘除囊性瘤,因此不能阻断这些患者进一步发展为PAC的可能性;由于目前仍缺乏大样本的研究,该技术的应用尚不成熟[87-88]。
5 挑战与展望
目前对于PanIN(<5 mm)应用影像学手段仍无法检测,SCN、IPMN、MCN、SPN的鉴别诊断有时非常困难,因此寻找诊断和鉴别诊断的分子标志物是亟待解决的问题。目前对于PCN恶变的分子机制、重要的信号通路尚不清楚,这些关键问题的回答有望获得胰腺癌防治的分子靶标。PCN/癌“异质性”的存在,对我们过去的经典研究手段提出了新的挑战。对DNA损伤修复系统的深入研究,特别是在PCN恶变过程中,DNA损伤修复基因的表观遗传异常改变的认识,有望应用“协同致死”原理进行PCN/胰腺癌的防治。

