重组高迁移率组蛋白N2蛋白入胞与细胞定位研究
马 骁, 徐恩杰, 尹 佳, 周许辉
海军军医大学附属长征医院脊柱四科,上海 200003
骨肉瘤是儿童和青少年中最常见的恶性肿瘤之一[1-2],特点为易早期转移。15%~25%的患者在确诊骨肉瘤时可检测到肺部转移[3]。骨肉瘤的主要治疗方法为肿瘤切除术和非特异性联合化疗[4-5]。随着肿瘤治疗技术的发展,骨肉瘤患者的长期生存率有所提高[6],但合并远处转移患者的生存率仍很低[7-9]。因此,抑制其转移仍是抗肿瘤治疗的关键。
高迁移率组蛋白N2(high mobility group chromosal protein N2,HMGN2)的异常表达与多种肿瘤的发生、发展相关[10-14]。研究[15-16]发现,HMGN2能抑制膀胱癌细胞和口腔鳞状细胞癌细胞的生长,并促进其凋亡。本课题组以往研究[17]也表明,在骨肉瘤细胞中以慢病毒感染的方式过表达HMGN2会抑制细胞的转移,提示HMGN2是一类抗肿瘤转移因子,促进其在肿瘤细胞内的表达可作为一种治疗骨肉瘤的临床策略。但是,慢病毒过表达方法有潜在危险性。
有研究[18-20]表明,人外周血单核细胞和淋巴细胞可在受到外界刺激后向胞外分泌HMGN2。这种分泌的HMGN2可能也具有抑制骨肉瘤转移的功能,而能否自行入胞是其发挥功能的基础,目前鲜见相关研究。因此,本研究探讨了外源性HMGN2蛋白能否进入骨肉瘤细胞及其细胞定位,期望能为未来研发类HMGN2结构药物或刺激HMGN2释放的药物提供思路。
1 材料与方法
1.1 研究材料 U-2OS骨肉瘤细胞和HEK-293FT细胞购自上海中国科学院科院细胞库。慢病毒载体以及病毒包装质粒购自吉凯基因。PVDF膜购自Millipore公司,牛血清白蛋白、FLAG M纯化试剂盒、4’,6-二脒基-2-苯基吲哚(DAPI)购自Sigma-Aldrich公司,一抗及ELISA试剂盒购自Abcam公司,二抗购自CST公司,ECL曝光液购自Pierce公司,DMEM购自Hyclone公司,胎牛血清(FBS)购自Gibco公司,TRIzol试剂、Lipofactamine 2000、双抗(青霉素、链霉素)均购自Invitrogen公司,PrimeSTAR HS DNA聚合酶、SYBR Green预混液购自Takara公司,反转录试剂盒购自Applied Biosystems公司,NE-PER核蛋白提取试剂盒购自Thermo Fisher公司。
1.2 细胞培养 将U-2OS骨肉瘤细胞和HEK-293 FT细胞置入含10% 胎牛血清、青霉素 (100 U/L) 和 链霉素(100 mg/L)的DMEM培养基中,于含5%CO2的37℃细胞培养箱中培养。
1.3 HMGN2 过表达慢病毒载体构建与包装 过表达慢病毒载体元件顺序:Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin,以BamHI和AgeI内切酶进行酶切后,切胶回收。用TRIzol提取U-2OS细胞的总RNA,使用反转录试剂盒将mRNA反转录成cDNA,并以获得的cDNA为模板扩增HMGN2片段。扩增引物序列正向:5′-AGG TCG ACT CTA GAG GAT CCC GCC ACC ATG CCC AAG AGA AAG GCT GAA G-3′,反向:5′-TCC TTG TAG TCC ATA CCC TTG GCA TCT CCA GCA CCT TC-3′。PCR扩增反应体系包括PrimeSTAR HS DNA聚合酶0.5 μL、模板1 μL、上游扩增引物1 μL、下游扩增引物1 μL、dNTP Mix 4 μL、5×PS Buffer 10 μL、无酶水32.5 μL。PCR反应条件:98℃预变性5 min;98℃变性10 s,55℃退火10 s,72℃延伸60 s,共30个循环。PCR产物在2%琼脂糖凝胶上电泳并切胶回收。
将PCR产物交换入酶切后的GV492载体并进行转化。将菌落PCR结果为阳性的菌落接种于LB培养基。菌落PCR引物序列正向:5′-GGG TCA ATA TGT AAT TTT CAG TG-3′,反向:5′- CCT TAT AGT CCT TAT CAT CGT C -3′。将菌液于37℃培养12 h后取适量进行测序。用DNA序列无误的菌液抽提质粒。过表达组:将过表达质粒与包装质粒共转染至HEK-293FT细胞;空白组:将空载体和包装质粒共转染至HEK-293FT细胞。转染后将细胞继续培养48 h后,收取培养基上清,0.45 μm滤器过滤,以30 000 r/min 4℃离心3 h。离心结束后弃上清,加入Opti-MEM培养基1 mL吹打重悬,深低温(-80℃)保存病毒液。
1.4 HMGN2 的过表达和蛋白纯化 用过表达慢病毒(HMGN2-flagoe组)和空白慢病毒(oeCON组)感染HEK-293FT细胞。通过预实验确定U-2OS细胞病毒感染的最佳感染复数(MOI)为10。为了增加阳性细胞的比例,在细胞感染3 d后进行流式分选,并继续培养携带绿色荧光的细胞。当细胞培养至70%~80%融合时,收集并提取RNA,通过实时荧光定量PCR(RT-qPCR)检测过表达效率。确认HMGN2过表达效率后,收集过表达HMGN2的细胞,用NE-PER核蛋白提取试剂盒提取核蛋白,并应用FLAG M纯化试剂盒纯化HMGN2-flag蛋白。通过ELISA法(ab49763)检测HMGN2的浓度。
1.5 RT-qPCR 使用SYBR Premix ExTaq和ABI Prism 7900HT进行RT-qPCR,定量测定HMGN2的表达水平。应用TRIzol提取每组细胞的总RNA,并使用反转录试剂盒将mRNA反转录成cDNA,用特异性引物进行扩增(以人β-actin基因为内参)。PCR引物序列:HMGN2正向为5′-CGA TTG TCT GCC CAT GTC CT-3′,反向为5′-GCA GAA CGT ACC CTG TTC CA-3′; β-actin正向为5′-ACC GAG CGC GGC TAC AG-3′,反向为5′-CTT AAT GTC ACG CAC GAT TTC C-3′。采用2-ΔΔCt法分析并统计数据。用相同的样品和相同的引物重复RT-qPCR实验3次。
1.6 Western印记 使用NE-PER核蛋白提取试剂盒提取核蛋白。获得的蛋白溶液在SDS-PAGE凝胶上电泳,分离的蛋白质条带转移到PVDF膜上,并在5%牛血清白蛋白中封闭,分别用抗HMGN2(1∶1 000稀释,ab199679)和抗DDDDK(1∶1 000稀释,ab49763)在4℃下孵育过夜,然后在室温下用二抗孵育膜1 h。使用ECL曝光液显影,并进行观察、拍摄。
1.7 免疫细胞化学 用浓度为10 μg/mL的纯化HMGN2蛋白处理骨肉瘤细胞24 h,然后将细胞用4%多聚甲醛固定30 min,用含0.1% Triton X-100的PBS溶液透化5 min,用1% BSA封闭细胞2 h。将细胞用抗DDDDK抗体(1∶100稀释,ab49763)在4℃孵育过夜,然后用二抗孵育1 h,PBS洗涤后用DAPI封固。在共聚焦显微镜下观察HMGN2-flag的细胞定位并拍摄。
2 结 果
2.1 HMGN2过表达慢病毒质粒构建 将获得的HMGN2片段与慢病毒过表达质粒(图1A)连接后进行转化,获得8个阳性菌落(图1B,泳道5~12);糖凝胶电泳显示成功获得HMGN2的基因片段(图1C),PCR产物大小为314 bp。将阳性菌送测序,结果显示序列无误,提取质粒进行慢病毒包装。
2.2 HMGN2蛋白过表达与纯化 以慢病毒感染的方式在HEK-293FT细胞中过表达HMGN2,以流式分选出阳性细胞后继续培养,荧光显微镜下显示细胞带绿色荧光(图2A)。RT-qPCR结果显示,HMGN2-flagoe组HMGN2-mRNA的表达水平显着高于oeCON组(P<0.001,图2B)。Western印记结果显示,HMGN2-flagoe组与oeCON组均有HMGN2表达,HMGN2-flagoe组HMGN2表达大于oeCON组,HMGN2-flagoe组HMGN2因带标签分子量较oeCON组稍大(图2C);HMGN2-flagoe组和Flag-BAP组中有flag表达,在oeCON组中未检测其表达(图2D)。
2.3 外源性HMGN2转运骨肉瘤细胞及定位 用10 μg/mL的纯化HMGN2-flag蛋白处理骨肉瘤细胞24 h后,免疫细胞化学检测结果显示,外源性HMGN2蛋白转入骨肉瘤细胞,主要定位于细胞核(图3)。
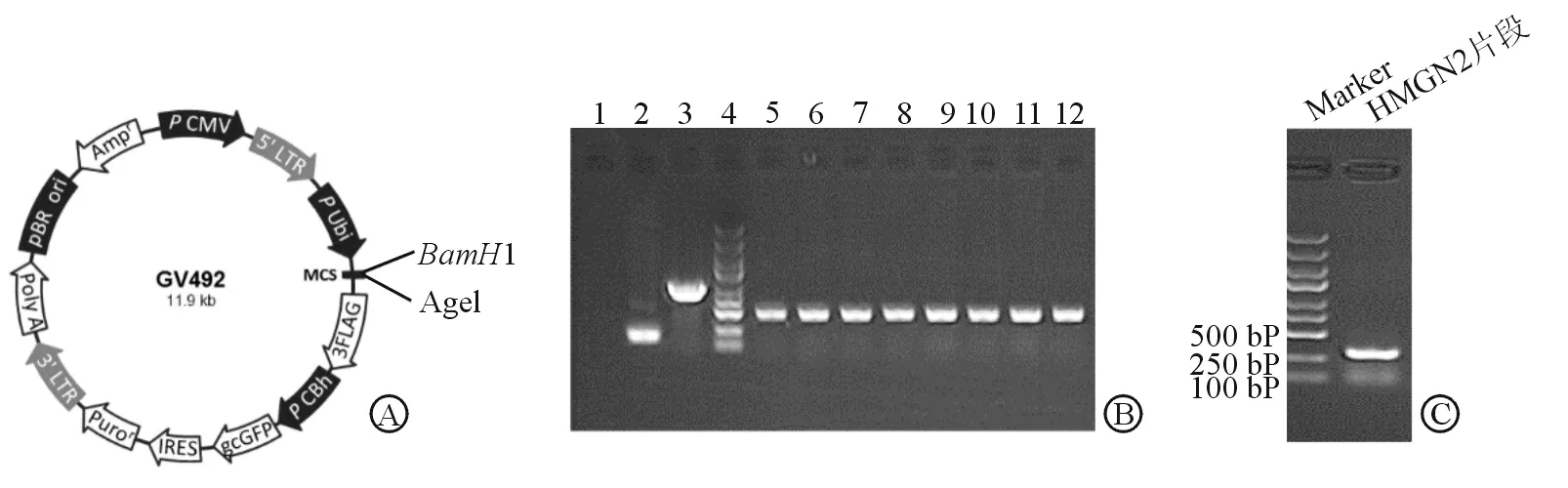
图1 HMGN2过表达慢病毒质粒的构建
A: 质粒图谱;B: PCR扩增凝胶电泳结果;C: 构建好的质粒转化细菌后的菌液PCR验证. 1:ddH2O空白对照;2:空载体对照;3:连接GAPDH的对照;4:Marker;5~12:8个阳性菌落结果
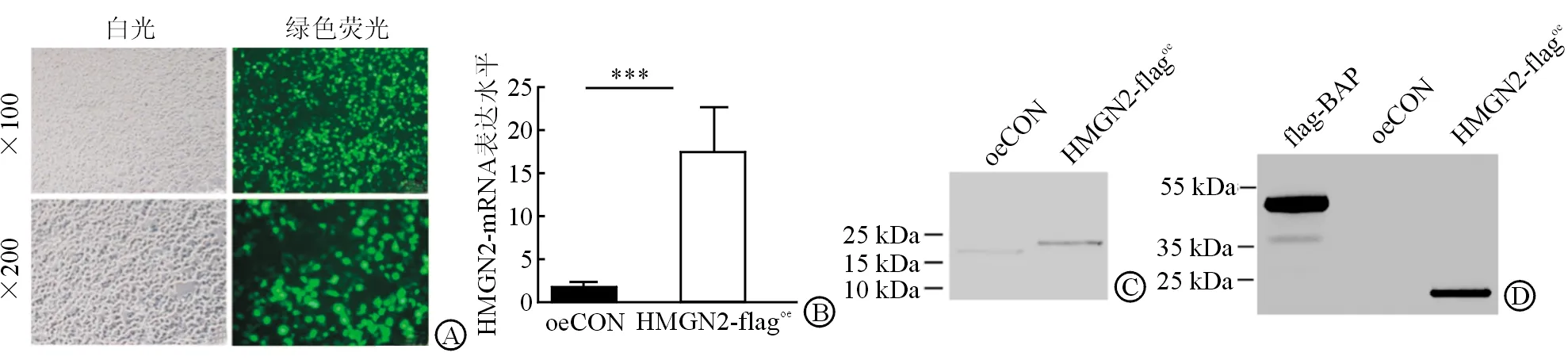
图2 HMGN2蛋白过表达与纯化
A: 白光下和绿色荧光下慢病毒感染的骨肉瘤细胞;B: 荧光定量PCR检测HMGN2过表达效率;C: Western印记检测纯化HMGN2的表达;D: Western印记检测flag的表达. oeCON组:空白载体对照;HMGN2-flagoe:带有flag标签的HMGN2纯化蛋白; flag-BAP:携带flag标签的融合蛋白,大小49.3 kDa.***P<0.001
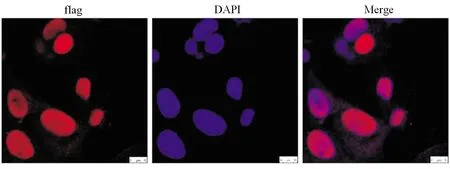
图3 免疫细胞化学实验检测外源性HMGN2细胞定位
3 讨 论
骨肉瘤是一类极易在早期转移的恶性肿瘤,约20%的骨肉瘤患者在明确诊断时即发现有转移,而大多数患者即使在初诊时未见转移,也会随着病情发展出现转移[22]。骨肉瘤的主要治疗方法是化疗和外科手术,但是目前没有有效的抗骨肉瘤转移的治疗策略,大部分患者仍会发生转移,导致死亡[23-25]。因此,抗骨肉瘤转移的研究成为这类肿瘤治疗的重点。
HMGN2是高迁移率族蛋白(HMG)的一员,主要定位于细胞核,且仅在真核生物中表达,具有稳定核小体形态和调节基因转录的功能[26]。其是一种非组蛋白核蛋白,在脊椎动物和无脊椎动物的细胞中广泛表达[27-28]。HMGN2蛋白含有核小体结合域(NBD),其NBD的N末端与组蛋白结合,而C末端与DNA结合并调节转录[28]。HMGN2能增加DNA在核小体上的缠结角度,促进核衣壳结构重塑[29]。HMGN2功能缺陷能增加DT40细胞对紫外线的敏感性,使细胞凋亡率增加[30]。较多研究[10-15]显示,HMGN2的异常表达与多种肿瘤的发生、发展有关联。HMGN2高表达还具有抑癌效果。研究[16]表明,HMGN2可抑制口腔鳞状细胞癌细胞系Tca8113的生长并诱导其凋亡。本课题组以往研究[17]发现,过表达HMGN2能抑制骨肉瘤细胞的转移。除了直接抑制肿瘤细胞转移外,Porkka等[19]还发现,HMGN2与肿瘤血管生成相关。
肿瘤转移抑制和肿瘤靶向肽研究[31-32]表明,HMGN2可能是治疗肿瘤转移的潜在靶标。研究人员从牛肝中提取了一种含21个氨基酸的肽,称为侵袭抑制剂2(IIF2),且鉴定显示其与HMGN2的C末端片段一致[31-32]。体外研究[32-34]显示,该肽能抑制多个肿瘤细胞的转移。而动物研究[32]表明,同时将IIF2和肺癌细胞经小鼠尾静脉注射可使肿瘤细胞转移减少50%~60%。 IIF2与白蛋白结合可提高其稳定性,并使转移减少86%[33, 35]。上述研究表明,HMGN2可作为一类抑癌因子,应用于抗恶性肿瘤转移。
重组慢病毒载体是一种常用且有效的将外源蛋白基因导入细胞的手段[36],但是慢病毒载体的转录“通读”现象可导致其整合位点附近原沉默基因被激活,这可能有潜在的危险性。因此需要寻找更为有效和安全的方式来增加肿瘤细胞内的HMGN2的含量。HMGN2能被某些细胞以外分泌的方式释放到胞外。白细胞介素2(IL-2)可刺激人外周血单核细胞释放HMGN2[19-20];一些肿瘤细胞的表面抗原也能刺激CD8+T淋巴细胞释放HMGN2[18]。这些研究提示,有可能通过外界刺激促使肿瘤旁正常组织或肿瘤附近的免疫细胞释放足量的HMGN2,从而发挥其抗肿瘤作用。而这类外分泌的HMGN2转运入肿瘤细胞是其发挥功能的基础。本研究用纯化HMGN2-flag融合蛋白处理骨肉瘤细胞,免疫细胞化学检测显示该外源性HMGN2能转运入骨肉瘤细胞并定位于细胞核。此外,内源性HMGN2蛋白在细胞核的定位已被多项研究[37-38]证实,而外源性HMGN2蛋白入胞是其入核的先决条件,对其机制的深入研究能为未来相关药物的研发提供依据。
综上所述,过表达的HMGN2在人骨肉瘤细胞系中表现出抗肿瘤活性,而本研究成功制备了HMGN2蛋白,并经免疫细胞化学实验证实外源性HMGN2能转运入骨肉瘤细胞,从而为进一步研究其抗肿瘤转移功能及新药研发提供了基础。下一步研究将对外源性HMGN2入胞后的抗肿瘤转移能力和机制进行探索。
——一道江苏高考题的奥秘解读和拓展

