碘催化甲烷气-液氧化反应本征动力学研究
师博辉,武 娜,张秀成
(1. 北京石油化工工程有限公司西安分公司,陕西 西安 710075;2. 西北大学化工学院,陕西 西安 710069)
以碘系列化合物为催化剂,在发烟硫酸溶剂中进行甲烷液相选择性氧化制取甲醇的研究,陈立宇等[2]已作了研究。 但对该项技术的本征动力学研究尚未涉及。 本文在前人研究的基础上[3-5],对以发烟硫酸为溶剂、碘催化甲烷气-液氧化反应过程进行了本征动力学的研究,为化学反应器选型、操作方式和操作条件确定及反应过程优化提供依据。
1 碘催化甲烷反应机理
碘催化甲烷气-液氧化反应化学表达式可写为:
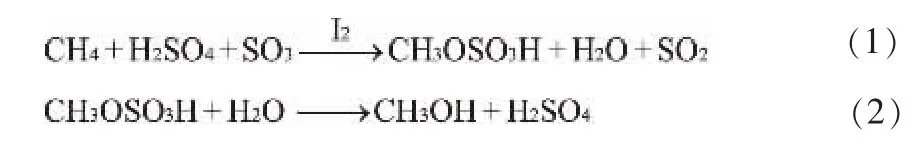
陈立宇等[2,4]研究已证明第二步水解反应是一个经典水解反应,几乎完全进行。 所以,本文仅讨论前半部分,即碘催化甲烷生成中间产物硫酸氢甲酯的反应。 该气-液相反应为不可逆反应,且实际表现出来的反应速率是包括传递在内的宏观反应速率,测定气-液相本征反应速率的方法与均相反应时不同之处是实验时要排除气相和液相中的扩散阻力,使反应在本征动力学区域内进行,为此,需要使气-液两相处于全混状态。
2 实验部分
2.1 实验材料
甲烷(99.99%)、氩气(0.01%),北京特种气体公司;发烟硫酸(w(SO3)=50%)、碘,均为分析纯试剂,西安化学试剂厂;250mL不锈钢高压反应釜,大连自控设备厂。
2.2 实验过程
在250mL高压搅拌反应釜中加入70mL发烟硫酸和4.0mmol碘作为催化剂, 以甲烷和氩气的混合气置换三次后,再充压至3.0MPa,即0.3mol甲烷,加热至预设温度后开动搅拌,反应温度由反应釜内的热电偶测得,反应过程中,用气相色谱对气相样按固定的时间间隔在线进行检测。 反应进行至预定反应时间后停止。
2.3 测定方法
试验是在搅拌釜中进行的间歇非均相反应,充分搅拌能使釜内温度和浓度达到完全均匀。 在此无返混或者返混极小条件的情况下,可以将预先假设的反应动力学进行积分,得到浓度与时间的函数关系。 这样,就可以对假定的函数关系采用实验数据进行标绘,若符合线性关系就可以进一步确定反应级数和反应速率常数。
2.4 分析方法
整个反应在高压反应釜中进行,液相样品中硫酸氢甲酯混溶于硫酸中,迄今尚未找到有效的方法对其进行定量测定。 故选择对气相进行分析:气相产物中有甲烷和二氧化碳,在以甲烷为计算基准的选择性关联上存在一些困难,为此采用甲烷原料气中加入内标气-氩气的方法,对气相产物加以定量分析,得到反应过程中甲烷转化率的即时值,换算成甲烷气相浓度。 反应前后的氩峰面积为A1、A2,甲烷峰面积为B1、B2。
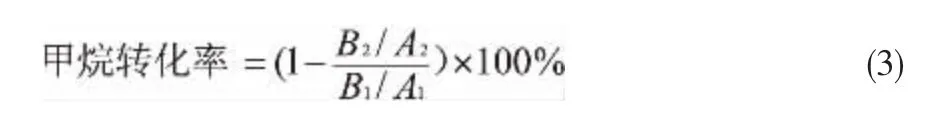
气相产物的分析采用GC900A气相色谱仪进行分析,TCD检测器, 分离柱为填充Porapak Q的不锈钢填充柱。 六通阀进样,进样量0.5mL。 由于甲烷在液相中的溶解度很小,符合亨利定律。 测得的甲烷气相含量,根据亨利定律,换算为溶液中的甲烷浓度,即可关联反应速率方程。
随着世界全球化趋势的不断加强,我国与世界各国之间的交流也日益频繁,英语作为世界上适用范围最广的语言,对我们的生活发挥着越来越重要的影响。因此,学校的英语教学效果备受关注,高中阶段的英语教学是培养学生英语语言能力、文化意识、思维品质和学习能力的关键途径,其教学效果影响着学生的英语学习兴趣、知识水平和运用能力,对学生未来的英语学习有着难以磨灭的影响。利用微课的教学形式,可以有效地提高教学的质量,促进学生英语阅读、口语、写作等多种能力的发展。因此,教师要积极转变自身的教育理念和教学方式,将教学内容与微课有机地结合起来,设计出符合学生学习特点和发展需求的教学方案,以促进高中英语教学效果的提高。
3 结果与讨论
3.1 扩散影响的消除
高压搅拌釜中进行的甲烷气-液氧化反应,甲烷是以气相形式加入反应器,发烟硫酸是以液相形式加入反应器,二者在高压搅拌釜中的反应属于典型的气-液反应。 由非均相反应的过程分析可知,反应分子经扩散传递过程后才能相互发生反应。 为测定该反应的本征动力学, 必须排除传递过程的影响。根据双膜理论,对甲烷-发烟硫酸的气-液相反应,经多次试验,选择搅拌速率在500r/min(如图1),以消除气相主体到气-液界面的传质阻力;双膜的距离非常小以至可忽略;液相中传质阻力,在该环境下可以忽略不计。 所以,该反应可以看成本征动力学过程,即反应过程控制。
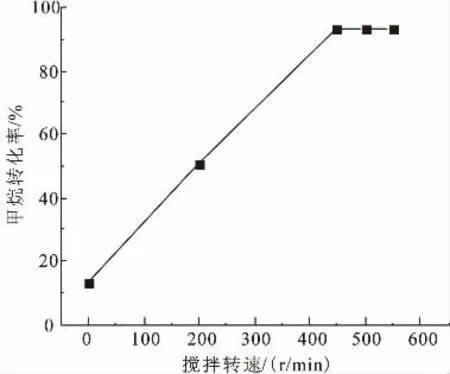
图1 搅拌速度对甲烷转化率的影响Fig. 1 Effect of stirring speed on conversion of methane
3.2 数据分析
化学反应式(1)的宏观动力学方程:

式中:k为反应速率常数;A、B、C分别是CH4、发烟硫酸和SO3。
应当指出的是,此反应发烟硫酸过量,即CB>>CA, 故反应中B和C的浓度变化很小,可忽略不计。这种情况下, 反应速率可看作与B和C的浓度无关,又因为消除气相主体到气-液界面的传质阻力,速率关系就简化为只和CH4有关的本征动力学方程。 即:

假设,α=1,并且根据亨利定律(PA=kA·CA),上式可化简为:

则在0→t的定义域内,对应的积分式为:
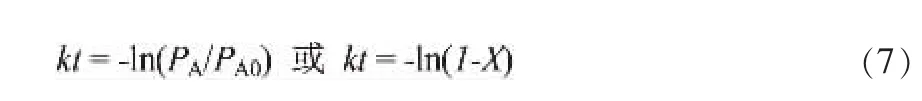
按照公式(7)的内标法,计算得出各温度下对应时间的瞬时转化率(X/%)数据见表1。
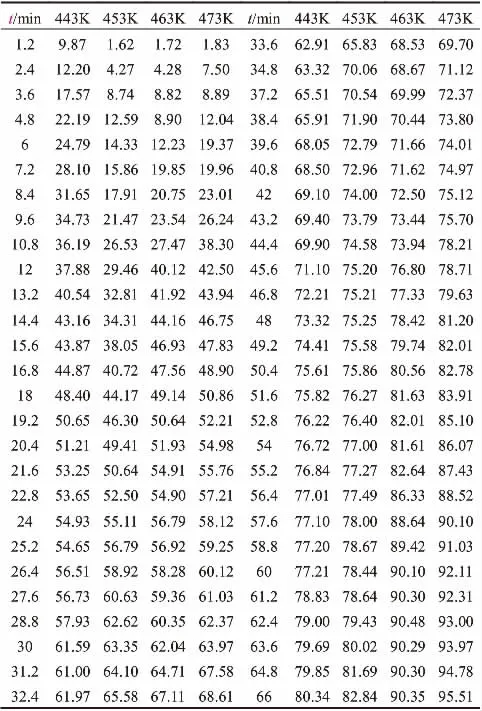
表1 反应温度、时间对甲烷气-液氧化反应甲烷转化率的影响Table 1 Effect of reaction temperature and time on methane conversion in gas-liquid oxidation of methane
3.3 速率常数k的确定
一级反应的PA0/PA或-ln(1-X)对t作图,直线的斜率为k。 在实验室中进行了不同温度下,甲烷转化率与反应时间的测试实验,实验数据处理后的结果如图2所示。
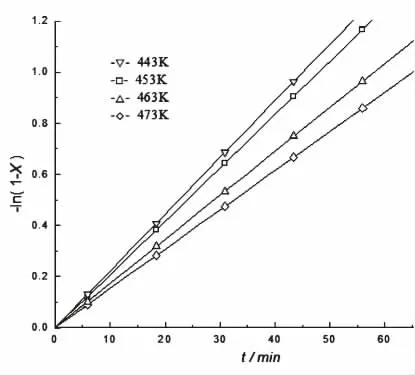
图2 反应时间对反应速率的影响Fig. 2 Effect of reaction time on velocity constant
在实验数据拟合计算中, 将甲烷转化率X与反应时间t进行拟合,得到关于-ln(1-X)与t的方程式:

R2=0.9454,说明模型对于实验数据的拟合是准确的,拟合的数学模型可用,甲烷在发烟硫酸中的I2催化部分氧化是一级反应假设成立。 反应速率方程为:

故,当反应温度453K时,直线的斜率即为反应速率常数k=0.0284min-1; 其他反应温度下反应速率计算结果见表2,求取方法同上。

表2 反应温度对反应速率的影响Table 2 Effect of reaction temperature on velocity constant
3.4 反应活化能的确定
在等温条件下确定反应级数的同时, 也获得了该温度下的反应速率常数k。 改变实验测定的温度水平,可以得到一组反应速率常数k与温度T的实验数据。 根据反应速率常数k 与反应温度关系的Arrhenius公式:

同样也可以用图解法来确定E和k0。 若有一系列不同温度T下的速率常数k值, 可作图lnk-1/T图,应得一直线,斜率为-E/R,截距为lnk0,就可以得到反应活化能E与频率因子k0的值。根据表2数据的lnk和公式(10),作出图3。
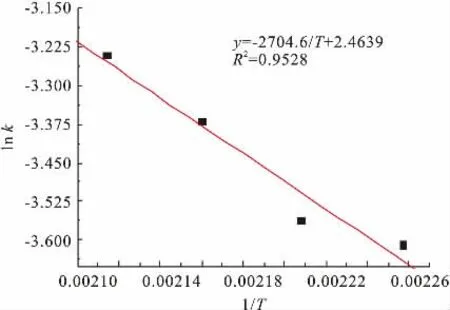
图3 活化能数据整理图Fig. 3 Curve of disposal based on Arrhenius activation energy
由线性拟合可知,lnk=-2704.6/T+2.4639,R2=0.9528。 回 归 可 用, 经 计 算E=22.49kJ·mol-1;k0=11.75min-1。
4 结论
(1)碘催化的甲烷气-液氧化反应经实验测得为一级反应, 在443~473K,3.0MPa下反应速率方程为:,其中,温度443K、453K、463K和473K下的反应速率常数k分别为0.0271、0.0284、0.0344和0.0391,活化能E为22.49kJ·mol-1,频率因子k0为11.75min-1。
(2)反应速率常数随着温度的升高而增大。
(3)根据亨利定律PA=kA·CA,采用气相甲烷的压力或者液相中甲烷的转化率表示碘催化甲烷气-液氧化一级反应的本征动力学方程是可行的。

