肉芽肿性小叶性乳腺炎12例临床病理分析
谷丽娟,佟桂珍,卫 伟,范永红
(北京市延庆区医院 北京大学第三医院延庆医院病理科,北京 102100)
肉芽肿性小叶性乳腺炎(granulomatous lobular mastitis,GLM)是少见的乳腺炎症性疾病。陈玲等报道于2015-01—2017-11月病理诊断300例GLM,说明其发病率在国内有增加趋势[1]。临床和病理医师(尤其是基层医院)对GLM认识不足,也缺乏相互之间必要的沟通,使得许多患者得不到及时有效的诊治。我们回顾性分析了12例GLM,结合相关文献,对其临床和病理特征及鉴别诊断等进行分析,以期提高临床对该病的认识和诊断水平。
1 材料与方法
1.1 材料
收集北京市延庆区医院2005-02—2019-09月病理诊断为GLM的标本12例,经2位高年资病理医师重新阅片,查阅相关病历资料并进行电话随访。病历资料由本院病案统计室提供。
12例GLM患者均为女性,年龄18~41岁,平均(33.4±5.9)岁;左乳病变7例,右乳病变5例;其中1例未生育,其余均有生育史,距最近一次妊娠11个月~5年;12例患者均因乳腺肿块伴疼痛就诊。
1.2 方法
标本均经10%中性缓冲福尔马林固定,取材后常规脱水、石蜡包埋;4 μm切片,苏木素-伊红染色,显微镜观察。
2 结 果
2.1 临床特征
12例GLM患者中10例肿块位于周边部,1例位于乳头下方,1例病变范围较大,行区段切除;1例伴腋下淋巴结肿大,1例于术后2年患侧复发。乳腺肿块均界限不清,活动度差。在电话随访过程中告知患者检测催乳素,仅3例患者进行了催乳素检测,且无升高。12例中首次诊断均未诊为肉芽肿性小叶性乳腺炎,2例怀疑为乳腺癌,其余10例诊断为乳腺肿物、乳腺炎。超声结果为不规则低回声区和稠厚液性暗区。
2.2 病理学检查
2.2.1 巨检
肿块多位于乳腺外周部,直径3~12 cm,界限不清,切面灰白、灰黄、灰红色,或黄白、红白相间,质地较硬韧;4例切面见小脓腔或小囊腔,直径0.5~2.5 cm,腔内有灰红坏死样物或黄色脓性分泌物;1例见黄色粟粒样病灶,有沙粒感。
2.2.2 镜检
病变界限不清,主要累及乳腺小叶,表现为以终末导管小叶单位为中心的慢性化脓性肉芽肿性炎症为特点,可见小叶中心性肉芽肿以及混合性炎性细胞浸润(图1)。小叶内可见最具特征性的大油囊、油囊外为或窄或宽的中性粒细胞聚集带,其外周区可见上皮样细胞和多核巨细胞形成的肉芽肿以及淋巴细胞、浆细胞、中性粒细胞等浸润(图2~4)。肉芽肿病灶大小、多少不等(图5)。病变发生融合时,小叶结构消失,形成大片状和结节状慢性化脓性肉芽肿性病灶(图6)。病变较轻的小叶内可见残存的终末导管和腺泡成分,提示病变发生于终末导管小叶单位。
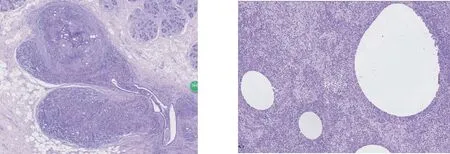
图1GLM病变沿乳腺小叶分布化脓性肉芽肿形成(HE低倍放大)图2小叶内可见特征性的大油囊(HE 中倍放大)

图3油囊周围伴中性粒细胞聚集带,外周见上皮样组织细胞、单核细胞、淋巴细胞等混杂炎性细胞浸润(HE 高倍放大)图4肉芽肿由上皮样细胞和多核巨细胞构成,周围有淋巴细胞、浆细胞、中性粒细胞等混杂性炎细胞浸润(HE 高倍放大)
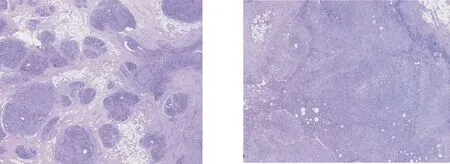
图5 肉芽肿病灶大小、多少不等(HE 低倍放大)图6 病变发生融合,小叶结构消失(HE 低倍放大)
3 讨 论
GLM是一种较少见的良性慢性炎症性疾病,由Milward于1970年首次报道,随后于1972年由KESSLER和WOLLOCH报道[2-3],病因不清,临床易误诊为乳腺癌[4]。明确诊断有赖于组织病理学检查,许多基层医院病理医师对GLM缺乏诊断经验,常不能做出明确病理诊断,而笼统的将其诊断为急慢性炎症或肉芽肿性炎(不除外结核),导致延误治疗甚至错误治疗。
3.1 GLM临床特征
GLM多发生于年轻经产妇,通常与妊娠和哺乳有关[5-6]。少数发生于哺乳期、孕妇或无生育史的妇女,国内外文献尚无男性病例报道。发病年龄为19~47岁,平均年龄约34岁,距离末次分娩1个月至8年。无生育史的患者中,大多数有服用抗精神病药物史[7]。本研究12例病例中,发病平均年龄33.4岁,1例未生育,其余有生育史。GLM临床表现为乳腺肿块,常单侧乳腺受累,左乳多见,多发生在乳腺的外周部。可伴疼痛、皮肤红肿、皮肤破溃、窦道形成、乳头溢液、乳头变形、内陷,少数患者伴同侧腋下淋巴结肿大[8]。本研究中,12例患者均因乳腺肿块伴疼痛就诊,病变位于左侧7例,右侧5例;1例伴有同侧腋窝淋巴结肿大。所有病例均行手术切除并术后抗生素治疗,其中1例于术后2年复发。GLM缺乏特异的临床表现和影像学特征,易与乳腺癌混淆[9]。超声表现为不规则低回声肿块,与周围界限不清,钼靶检查提示不规则肿块;本组12例行超声检查,2例为BIRADS 4A类,性质未定,临床术前检查因肿块界限不清而疑为恶性病变,其余病例诊断为炎性病变。
3.2 GLM病理学特征
GLM有其独特的病理特征,病变多位于乳腺外周部,切面灰白、灰黄色,边界不清,质硬韧,可有沙粒感。可见小脓腔或小囊腔,腔内有灰红坏死样物或黄色脓性分泌物,也可见黄色粟粒样病灶。在组织病理学上,表现为以小叶为中心的化脓性肉芽肿性炎,肉芽肿中央区可见最具特征性的大油囊、油囊周围为或窄或宽的中性粒细胞聚集带,其外周区可见上皮样细胞和多核巨细胞形成的肉芽肿及混合性炎细胞浸润,肉芽肿多发,大小不一,并可发生融合,使原小叶内腺管结构不清或消失,在病变较轻的部位,可见残存的小叶结构。
3.3 GLM鉴别诊断
①导管扩张症:又称导管周围性乳腺炎,是一组以导管扩张为基础的乳腺慢性炎症,发病年龄较GLM大,多见于中老年女性,表现为乳头及乳晕下肿块;早期病变局限于乳晕下输乳管及大导管,后期可累及乳腺区段导管,病变不以终末导管小叶单位为中心;导管有不同程度扩张,管壁及其周围不同程度纤维化,浆细胞、淋巴细胞、嗜酸性粒细胞及泡沫状组织细胞浸润;文献报道GLM可合并导管扩张症,BHASKARAN等[10]曾报道10例GLM与导管扩张并存,程涓等[11]报道32例,陈玲等[1]报道16例,并认为其发病可能为小叶病变逆行累及导管所致。②乳晕下脓肿:又称Zuska病、输乳管鳞状上皮化生、乳腺导管瘘,主要发生在非哺乳期女性,可能与吸烟有关;大多数出现乳晕区肿胀或肿块;病理改变的主要特征是:输乳管鳞化、角化物阻塞导管,管壁可破裂导致内容物外漏并继发感染,形成以输乳管为中心的乳晕下脓肿及异物巨细胞反应。③硬化性淋巴细胞性小叶炎:又称淋巴细胞性乳腺病及硬化性淋巴细胞性乳腺炎,部分患者是长期患糖尿病的女性,故又称糖尿病型乳腺病[12],也有学者认为其是一种自身免疫性疾病;此病多见于中青年妇女,其病理组织学具有特征性改变,表现为乳腺小叶内及其周围有大量成熟淋巴细胞(主要为B淋巴细胞)、浆细胞浸润,腺泡及导管上皮层内可有淋巴细胞浸润;间质纤维化透明变,其内常见有淋巴细胞性小血管炎及血管周围炎。④IgG4相关硬化性乳腺炎:IgG4相关硬化性病变是最近认识的一种综合征[13],可以在各种器官中形成肿块性病变,其特征为致密的淋巴细胞和浆细胞浸润伴间质硬化,以外周血IgG4升高和组织中表达IgG4的浆细胞增多为特征;病理学特点为淋巴浆细胞呈结节性弥漫浸润,伴有间质硬化和乳腺小叶缺失;ALLEN等[14]提出了关于该病的诊断标准,包括5个阳性指标和3个阴性指标,其中阳性指标为:致密的淋巴浆细胞浸润、席纹状纤维化、闭塞性脉管炎、>10个IgG4阳性细胞/HPF、IgG4/IgG>40%;阴性指标为:上皮样组织细胞、肉芽肿形成及巨细胞,阳性指标中满足4个或以上且阴性指标中缺少2个或以上可诊断。⑤结核性乳腺炎:原发性结核性乳腺炎极为少见,常有其他部位结核病史,特征性改变为伴干酪样坏死的肉芽肿性炎,病变无沿乳腺小叶分布的特征,抗酸染色和病原学检查有助于明确诊断。
3.4 GLM病因
GLM发病原因不明,大部分学者认为GLM是一类自身免疫性疾病[15-17],其他可能的原因还有妊娠与哺乳、口服避孕药、服用抗精神病药物、高泌乳素血症、乳汁刺激诱发的超敏反应、垂体腺瘤、外伤、血IgG4升高。也有学者认为GLM与感染相关,陈玲等[1]研究发现棒状杆菌仅存在于脂质溶解囊泡中,并认为棒状杆菌感染可能是含有脂质溶解囊泡的GLM的主要致病因素。本组12例均具有特征性的大油囊。
3.5 GLM治疗与预后
GLM尚无理想治疗方案,多采用激素、免疫抑制剂等治疗方法,是否需要手术治疗仍存在争议。但抗生素治疗无效,切开引流易导致切口难愈合及窦道形成[18-19]。本研究12例均行手术切除,术后给予抗炎治疗,其中1例于术后2年患侧复发。
综上,GLM的诊断有赖于组织病理学检查,充分认识这种疾病,精准诊断,正确指导临床治疗,对减轻患者痛苦具有重要意义。

