基质金属蛋白酶对结核肉芽肿形成及免疫调控作用的研究进展*
刘莉, 马沁梅, 于嘉霖, 邓光存, 吴晓玲
· 综述 ·
基质金属蛋白酶对结核肉芽肿形成及免疫调控作用的研究进展*
刘莉, 马沁梅, 于嘉霖, 邓光存, 吴晓玲△
(西部特色生物资源保护与利用教育部重点实验室,宁夏大学生命科学学院,宁夏 银川 750021)
结核分枝杆菌;肉芽肿;基质金属蛋白酶
结核病(tuberculosis, TB)是由结核分枝杆菌(, Mtb)感染引起的具有高致病性及死亡率的人畜共患传染病[1]。作为一种胞内致病菌,Mtb通过气溶胶等途径感染肺部,随后被驻留在肺泡中的巨噬细胞识别、吞噬并发生复杂的相互作用[2]。一方面,当Mtb感染巨噬细胞时,巨噬细胞会通过其模式识别受体(pattern recognition receptors, PRRs)开启免疫反应,然后激活细胞凋亡和自噬等途径以消灭病原菌。另一方面,在长期的进化过程中,Mtb也进化出了一套免疫逃逸机制,从而逃避机体的免疫识别和杀伤。在这个过程中,机体引发的炎症反应会逐渐导致TB肉芽肿的形成,肉芽肿一般会在机体内稳定并长期存在,当机体免疫力下降或病原菌感染时,肉芽肿内部会发生干酪样坏死,导致Mtb的逸散,感染进一步扩大[3]。肉芽肿作为一种组织有序的多类型免疫细胞集合,其形成受到多种因素调控,而基质金属蛋白酶(matrix metalloproteinases, MMPs)在肉芽肿形成过程中发挥了重要作用。
MMPs是一类依赖Zn2+的蛋白水解酶,可以特异性地降解细胞外基质(extracelluar matrix, ECM)并参与ECM的重构[4]。同时,MMPs在各种生理和病理过程中起着关键作用。当机体免疫力低下时,MMPs会发生上调,并引起风湿性关节炎、牙周炎、恶性肿瘤等多种疾病。另外,MMPs还可能参与Mtb感染后的机体免疫调节。Mtb感染通过激活细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)/丝裂原活化蛋白激酶(motogen-activated protein kinase, MAPK)通路来调控MMPs的表达,同时诱导肺组织重塑和肉芽肿形成[5]。由此可见,MMPs的表达水平可能会影响Mtb感染后肺部肉芽肿的形成及病理变化,而MMPs可能是治疗TB的潜在靶点。
1 肉芽肿的特点及其功能
早在1679年,肉芽肿就作为肺TB的主要特征被提及。这一发现比确定Mtb是引起TB的主要致病菌早了近200年。肉芽肿的形成过程比较复杂,当Mtb侵入机体后首先被巨噬细胞吞噬,然后被感染的巨噬细胞发生细胞坏死导致Mtb逸散出来感染其他的细胞或组织,造成感染的进一步扩大。与此同时,机体为了防止病菌逸散也会分泌一些炎症因子去募集免疫细胞,被招募来的免疫细胞将被感染的细胞团团围住,逐渐形成一个致密的结构,这种结构便是肉芽肿[6]。肉芽肿主要包括干酪样坏死型肉芽肿、非坏死型肉芽肿和纤维型肉芽肿三类,其中干酪样肉芽肿具有干酪样坏死的中央区,周围伴有增生的上皮样细胞、多核巨细胞、淋巴细胞、成纤维细胞等免疫细胞[7]。作为一种有组织、有结构的免疫细胞的集合,肉芽肿在机体免疫调控中发挥着重要作用。
肉芽肿在TB的发病过程中起着双刃剑的作用。首先,肉芽肿的免疫微环境可将Mtb控制在一定的范围内,有效控制和防止Mtb的进一步扩散和传播;但从另外一方面来说,这样的微生态微环境也保证了Mtb能继续生长和存活,而不能被机体完全杀死。在感染部位Mtb的生长与抑制达到一种平衡[8]。但是当机体免疫力下降时,这种平衡会被打破,Mtb会突破局部防御而逸散出来造成二次感染,加重病症[9]。由此可见,TB肉芽肿是Mtb与机体免疫细胞相互作用最为直接的部位,并在很大程度上决定Mtb的扩散和繁殖程度,因此其发展转归决定了TB的发展进程及最终结局。而肉芽肿形成过程中MMPs的参与及其在肉芽肿形成过程中的作用越来越受到人们的关注,这对破译Mtb感染后肉芽肿形成的潜在驱动因素有重要意义。
2 MMPs概述
MMPs是一类含锌金属肽酶的总称,具有激活或降解多种ECM、促进细胞迁移等作用[10-11]。MMPs在1962年首次被报道,它们主要参与蝌蚪变态过程中的尾部再吸收。目前已有26种MMPs被发现,其中人体内大约有23种,各成员之间结构相对比较保守,几乎在所有器官和组织中都有表达,在炎症细胞迁移、组织修复、趋化因子和细胞因子信号传导、基质和非基质蛋白降解等免疫反应中均起着关键作用[12-13]。
根据特异性,MMPs可分为胶原酶(MMP‐1、MMP‐8和MMP‐13)、明胶酶(MMP‐2和MMP‐9)、金属酶(MMP‐3、MMP‐10和MMP‐11)和弹性酶(MMP‐7和MMP‐12)四大类。在机体内,多数MMPs都以其前体(proMMPs)的非活性形式存在[14]。proMMPs的激活机制非常复杂,目前比较公认的是“Zn2+-半胱氨酸学说”,具体内容为:MMPs被激活之前,首先形成proMMPs,此时机体内的半胱氨酸会与proMMPs结构上的Zn2+相互结合,以保持proMMPs一直处于非活性形式;而当Mtb侵入机体,会促使一些蛋白酶(如丝氨酸蛋白酶、纤溶酶和中性粒细胞弹性蛋白酶)作用于半胱氨酸和proMMPs之间的化学键,去除半胱氨酸开关,激活proMMPs[15-16]。proMMPs被激活后,其活性受到金属蛋白酶组织抑制剂(tissue inhibitors of metalloproteinases, TIMPs)的调节[17]。TIMPs是一种内源蛋白,也是人体内主要的MMPs抑制剂[18]。目前已经鉴定出4种TIMPs(TIMP1-4),它们具有相似的结构,可与MMPs的催化活性区特异性结合来调控其活性[19-20]。
目前已被证实的是,Mtb感染会导致MMPs上调,并调节机体免疫应答,同时,MMPs的分泌主要受核因子κB(nuclear factor-κB, NF-κB)和MAPK信号通路的调控[21]。但是目前关于MMPs调控肉芽肿形成及发展的机制尚不完全明晰,且后续针对MMPs的靶向疗法也尚不成熟,有待进一步研究。因此,探索MMPs的功能及其在肉芽肿中的作用可以为TB的防治及新药研发提供理论基础。
3 MMPs对TB肉芽肿形成的调控作用
3.1TB肉芽肿中MMPs的表达调控MMPs的表达调控机制比较复杂,由图1可以看出,MMPs可由上皮细胞、巨噬细胞及T细胞等分泌,并且其表达受到一些细胞因子的调控。(1)在TB肉芽肿中,不同细胞对MMPs的调控是多样的。机体单核细胞与单核细胞、成纤维细胞和小胶质细胞之间,以及呼吸道上皮细胞与成纤维细胞之间相互作用均可上调MMPs表达[22-23]。Mtb可通过这些细胞之间的网络连接而增强MMPs活性,且这些细胞网络结构可能会增强免疫细胞和基质细胞的免疫应答。(2)多种细胞因子被证明在肉芽肿形成过程中参与调控MMPs的表达。当机体发生炎症反应时,干扰素γ、白细胞介素1β(interleukin-1β, IL-1β)以及单核细胞来源的肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)均可增加MMPs的表达[24],进而调控机体免疫应答。另外,干酪样肉芽肿中心为典型的缺氧微环境,在这种环境中,缺氧诱导因子1α(hypoxia-incucible factor-1α, HIF-1α)和血红素加氧酶1(heme oxygenase-1, HO-1)在其中起了重要的调节作用,HIF-1α可增加单核细胞和中性粒细胞MMPs的分泌[25-26],而Mtb驱动的HO-1可限制MMP-1的表达。由于海分枝杆菌感染的斑马鱼体内的肉芽肿和人类一样出现干酪样坏死,所以该模型现已在肺TB研究中被广泛应用。在斑马鱼肉芽肿模型中,依赖于Mtb毒力因子ESAT-6的MMP-10和IL-17驱动的MMP-3可能通过激活MMP-1上调其他胶原酶的表达。总之,这些研究均证明TB肉芽肿中MMPs的表达调控具有复杂性。

Figure 1. Pattern diagram of the expression of matrix metalloproteinases (MMPs) regulated by various cells and cytokines in tuberculous granuloma. TNF-α: tumor necrosis factor-α; HIF-1α: hypoxia-inducible factor-1α; IL-1β: interleukin-1β; IFN-γ: interferon-γ; HO-1: heme oxygenase-1; IL-17: interleukin-17; TIMPs: tissue inhibitors of metalloproteinases.
3.2MMPs有助于肉芽肿形成早期胶原的降解肉芽肿形成的一个重要条件是成纤维细胞合成胶原酶,其中肌成纤维细胞是一种特殊的成纤维细胞,可产生胶原蛋白酶并参与肉芽肿组织的形成。当Mtb感染时,肌成纤维细胞能通过调节纤维化相关细胞因子导致胶原酶积累,而后者对机体器官具有破坏性,从而可能会促使一些病变发展为具有广泛ECM的肉芽肿;而抑制胶原蛋白酶表达会抑制Mtb诱导的肉芽肿形成并减低细菌负荷[27]。
胶原降解是肉芽肿形成早期最显著的特点。在肺TB人体内的MMPs(尤其MMP-1和MMP-3)是降解胶原的关键酶,在肺TB发生发展进程中发挥着重要作用[28-29]。此外,中性粒细胞来源的MMP-8现已成为TB肉芽肿形成的第二种主要胶原酶。如图2所示,Mtb感染后中性粒细胞分泌MMP-8,导致胶原降解[23]。研究者在肺TB患者的肺泡腔内壁和干酪样坏死区域中心检测出含有MMP-8的中性粒细胞也证明了以上观点。由此可以看出,在TB发展进程中,巨噬细胞来源的MMP-1可能导致最初的基质分解,而中性粒细胞来源的MMP-8增加了肺组织损伤,从而导致Mtb扩散到气道中造成感染的进一步扩大。以上研究表明多种MMPs联合作用可破坏早期肺基质,加速Mtb的扩散。
3.3MMPs调控TB肉芽肿的发展进程前期许多研究已经证实,MMPs在Mtb感染后肺组织肉芽肿形成中具有重要作用,而MMPs表达量及种类不同其作用也有差异。如图2所示,Mtb感染后会诱导MMP-9和MMP‐10高表达,且MMP-9的上调与肉芽肿形成所必需的单核细胞和巨噬细胞的募集有关[30]。使用MMPs抑制剂抑制MMP-9和MMP-10的表达,可分别从细胞募集和胶原酶活性两个方面抑制肉芽肿的形成[31]。此外,MMP-12在机体免疫和肉芽肿形成过程中也发挥着至关重要的作用。结节病患者的肺组织中MMP-12表达上调。在多壁碳纳米管灌注的小鼠肉芽肿性炎症模型中,敲减-会导致肉芽肿消退,而上调MMP-12的表达会导致肉芽肿持续[32]。这些研究说明MMPs影响了肉芽肿的形成及其发展进程。
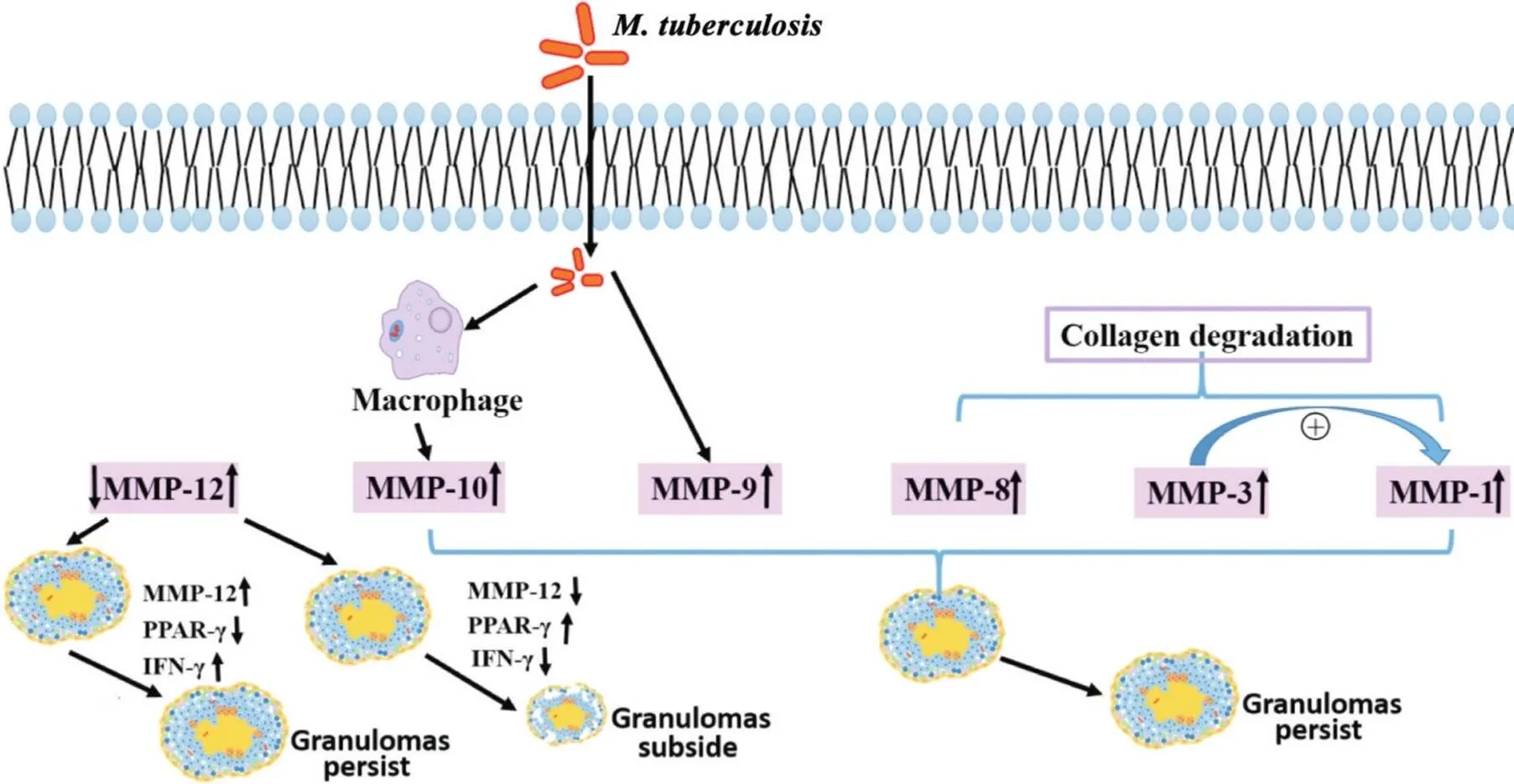
Figure 2. Regulation of the expression of matrix metalloproteinases (MMPs) in lung granuloma. PPAR-γ: peroxisome proliferator-activated receptor-γ; IFN-γ: interferon-γ.
4 MMPs在TB肉芽肿中的免疫调控作用
4.1MMPs促进了肉芽肿中Mtb的增殖和传播目前,Mtb感染后MMPs的上调被认为可能是Mtb在宿主肺组织中增殖和传播的策略之一。这主要是由于Mtb可利用自身分泌的毒力因子诱导肉芽肿的形成,从而促进其复制和传播[33]。这也就是说,肉芽肿可能为Mtb的复制提供了有利的微环境。而在这个过程中,MMPs对于早期肉芽肿形成和促进Mtb在局部微环境中的繁殖是必需的。其中,MMP-9已被证明直接参与感染部位巨噬细胞的招募,Mtb分泌的毒力因子ESAT-6可诱导上皮细胞中MMP-9的表达,从而增强巨噬细胞的募集,促进新生肉芽肿的成熟和细菌的生长,而敲除MMP-9会减弱肉芽肿的形成和细菌的生长[27]。因此,在肉芽肿组织模型中,抑制MMP-9活性可通过抑制单核细胞和巨噬细胞募集以及肉芽肿的成熟来抑制细菌的传播[25, 28]。另外,MMP-1被认为是降解ECM的主要蛋白酶,其可促进Mtb在机体内的扩散。研究表明过表达MMP-1导致肺肉芽肿的肺泡破坏和更大的胶原蛋白破坏[34]。目前大多数相关研究都认为MMPs是治疗TB的有效靶点,未来将在TB的治疗中发挥重要作用。
4.2MMPs参与调控TB肉芽肿中的炎症反应在TB肉芽肿中,MMPs作为机体炎症反应的主要调节因子,其可通过调控趋化因子、生长因子、蛋白酶、蛋白酶抑制剂等的表达而促进炎症反应改变。一般来说,早期肉芽肿以促炎环境为主,而晚期肉芽肿以抗炎环境为主。在这些复杂的过程中,MMP-1和MMP-9在炎性免疫反应中发挥重要作用。MMP-1是肺组织破坏的主要胶原酶,Mtb感染通过上调机体内MMP-1的分泌,进而导致单核细胞聚集和胶原酶活性的增加,造成机体炎性损伤[35]。MMP-9也在调节炎症反应方面有关键作用,Mtb感染THP-1细胞后会促进细胞因子的分泌,进而上调MMP-9的表达,而抑制MMP-9的表达会抑制细胞因子分泌[36],进一步降低机体炎症反应。MMP-1、-2、-3、-8和-13的循环水平在TB康复者体内显著降低[37],表明MMPs可能促进Mtb感染后的组织损伤。因此,监测这些特殊MMPs与炎症因子下调之间的相关性,将有助于抗TB新药的研发。此外,MMPs可以通过激活细胞内信号通路的生物活性来暂时调节机体炎症反应和免疫过程。
4.3多条信号通路参与调控TB肉芽肿中MMPs的分泌当Mtb侵入机体后,机体内多个细胞通路被激活,共同调控MMPs分泌。如图3所示,MAPKs作为一种磷酸化依赖的信号转导酶,是多种细胞途径中调控MMPs分泌的关键通路。已知ERK/MAPKs信号通路主要参与细胞分裂,而p38 MAPK则与过度炎症反应相关,且p38和ERK均可调控TB肉芽肿中MMPs的分泌。p38磷酸化会驱动肺TB患者体内干酪样肉芽肿周围的上皮样巨噬细胞表达MMP-1[38]。在p38的上游,Mtb通过Toll样受体2(Toll-like receptor 2, TLR2)磷酸化p38;在下游,磷酸化的p38会通过驱动环加氧酶(cyclooxygenase, COX)-Ⅱ/前列腺素(prostaglandin, PG)E2通路的表达,进而调节MMP-1的分泌[39-40]。其中,PG通路是p38活性的关键下游效应因子,在调节MMPs的表达中起着重要作用。此外,Mtb本身产生的环磷酸腺苷也参与调控MMPs的表达[41]。
如图3所示,磷脂酰肌醇二甘露糖苷(phosphatidyl-myo-inositol dimannosides, PIM2)作为Mtb胞膜的重要组成部分,其可以通过TLR2-MyD88依赖的方式激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)和Notch1信号,进一步上调巨噬细胞中COX-Ⅱ和MMP-9的表达[42, 44]。这表明,PIM2可能以Notch-PI3K-MAPK依赖的方式调控着MMPs的表达。另外,Notch1还可强烈激活NF-κB表达,从而调控炎症反应[45]。基质细胞如气道上皮细胞在Mtb侵入机体形成肉芽肿的过程中也发挥重要作用。PI3K作为一种关键的信号分子,也被认为在调控气道上皮细胞MMPs表达中发挥重要作用。PI3K/AKT/P70S6K信号通路在支气管上皮细胞源性MMP-1、MMP-3和MMP-9表达中起重要调控作用[46],证明了以上观点。这些MMPs是TB病理性ECM降解的关键。
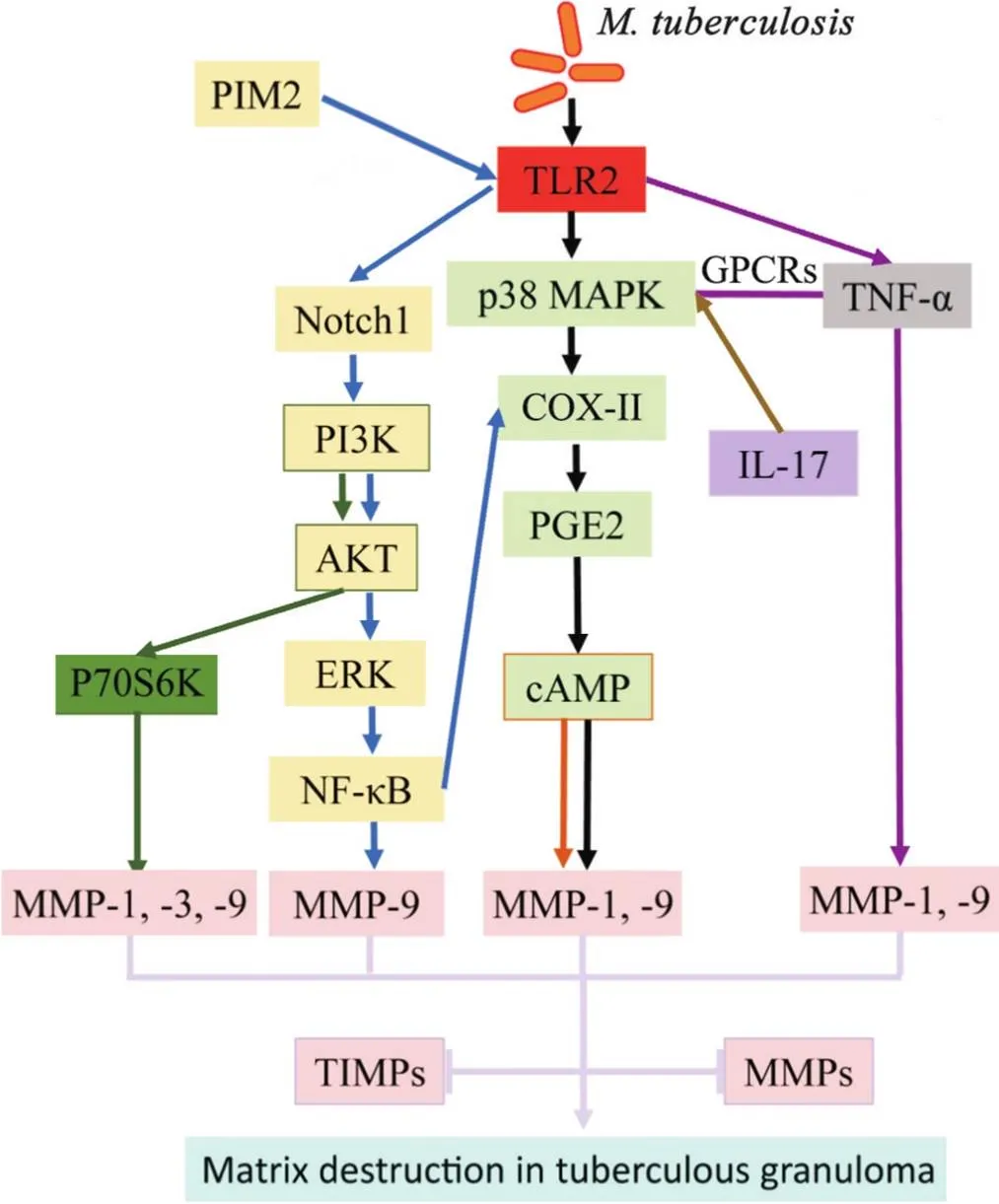
Figure 3. Multiple signaling pathways regulate the expression and secretion of matrix metalloproteinases (MMPs) in tuberculous granuloma (modified from reference [4, 45]). PIM2: phosphatidyl-myo-inositol dimannosides; PI3K: phosphatidylinositol 3-kinase; GPCRs: G-protein-coupled receptors; ERK: extracellular signal-regulated kinase; NF-κB: nuclear factor-κB; TLR2: Toll-like receptor 2; MAPK: mitogen-activated protein kinase; COX-II: cyclooxygenase-2; PGE2: prostaglandin E2; cAMP: cyclic adenosine monophosphate; IL-17: interleukin-17; TNF-α: tumor necrosis factor-α; TIMPs: tissue inhibitors of metalloproteinases.
Mtb免疫反应中还涉及许多细胞因子,其中IL-17和TNF-α均可调节肺TB病人体内MMPs的活性,这对调控肉芽肿的发生发展具有重要意义。在肉芽肿中,p38 MAPK信号通路不仅参与了Mtb感染中IL-17驱动的MMP-3上调[47-48],还可通过TNF-α协同G蛋白偶联受体信号通路上调MMP-1的表达水平,TB患者中激活的p38定位于分泌MMP-1的气道上皮细胞[39]证明了以上观点。总之,MMPs的调控涉及多种途径,其中MAPKs是调控MMPs分泌和表达最关键的途径。
5 结语和展望
肺TB是由Mtb感染引起的慢性传染病,随着病情发展,肺组织内会形成肉芽肿。其中,由MMPs分解ECM引起的组织破坏可能在TB肉芽肿的发生发展中起重要作用。完整的肉芽肿可以控制病原体并防止其传播,这对宿主是有益的。但在肉芽肿形成期间随着MMPs分泌量的增加又会导致肺基质降解,这对机体又是有害的。当机体感染Mtb后,MMP-1、-3、-8和-9均明显上调,从而降解ECM,促进Mtb扩散。此外,这些MMPs还可促进TB肉芽肿结构的破坏,而不完整的肉芽肿结构有利于Mtb增殖,大量巨噬细胞等进一步聚集,从而导致MMPs分泌量进一步增多,形成一种恶性循环。因此,患者血清中MMP-1、-3、-8和-9的表达水平可作为肺TB的辅助诊断指标,以及病情监测和治疗效果的参考指标。
目前,关于Mtb感染不同阶段特定MMPs的调节及作用仍不甚清晰。而研究者使用多种TB动物模型研究后提出,MMPs可作为未来治疗TB的有效靶点之一。通过使用MMP抑制剂和一线TB药物对TB进行辅助治疗后发现,MMP抑制剂可防止肉芽肿的形成,显著降低了Mtb在肺中的存活率。但是也面临新的挑战,例如,目前TB治疗方案需要多种药物配合,MMP抑制剂与这些药物配伍的效果仍需要进一步研究,尤其对多重耐药菌的抑制效果还不明确。
[1] Hong D, Ding J, Ouyang L, et al. Human-induced pluripotent stem cell-derived macrophages and their immunological function in response to tuberculosis infection[J]. Stem Cell Res Ther, 2018, 9(1):2-14.
[2] Bosedasgupta S, Pieters J. Inflammatory stimuli reprogram macrophage phagocytosis to macropinocytosis for the rapid elimination of pathogens[J]. PLoS Pathogens, 2014, 10(1):e1003879.
[3] Al-Mayouf SM, Albuhairan I, Muzaffer M, et al. Familial aggregation of Crohn’s disease and necrotizing sarcoid-like granulomatous disease[J]. Eur J Rheumatol, 2015, 2(3):122-124.
[4] Zhang P, Wu C, Huang XH, et al. Aspirin suppresses TNF-α-induced MMP-9 expression via NF-κB and MAPK signaling pathways in RAW264.7 cells[J]. Exp Ther Med, 2017, 14(6):5597-5604.
[5] O'Kane CM, Elkington PT, Jones MD,et al. STAT3, p38 MAPK, and NF-κB drive unopposed monocyte-dependent fibroblast MMP-1 secretion in tuberculosis[J]. Am J Respir Cell Mol Biol, 2010, 43(4):465-474.
[6] Andersson AM, Larsson M, Stendahl O, et al. Efferocytosis of apoptotic neutrophils enhances control ofin HIV-coinfected macrophages in a myeloperoxidase-dependent manner[J]. J Innate Immun, 2020, 12(3):235-247.
[7] Evans S, Butler JR, Mattila JT, et al. Systems biology predicts that fibrosis in tuberculous granulomas may arise through macrophage-to-myofibroblast transformation[J]. PLoS Comput Biol, 2020, 16(12):e1008520.
[8] Carow B, Hauling T, Qian X, et al. Spatial and temporal localization of immune transcripts defines hallmarks and diversity in the tuberculosis granuloma[J]. Nat Commun, 2019, 10(1):1823.
[9] Ramakrishnan L. Looking within the zebrafish to understand the tuberculous granuloma[J]. Adv Exp Med Biol, 2013, 783:251-266.
[10] Kim OH, An HS, Choi TY. Generation ofzebrafish mutant to investigate liver diseases[J]. Dev Reprod, 2019, 23(4):385-390.
[11] Liu H, Zeng Z, Wang S, et al. Main components of pomegranate, ellagic acid and luteolin, inhibit metastasis of ovarian cancer by down-regulating MMP2 and MMP9[J]. Cancer Biol Ther, 2017, 18(12):990-999.
[12] Miyamoto N, Pham LD, Maki T, et al. A radical scavenger edaravone inhibits matrix metalloproteinase-9 upregulation and blood-brain barrier breakdown in a mouse model of prolonged cerebral hypoperfusion[J]. Neurosci Lett, 2014, 573:40-45.
[13] DeLeon-Pennell KY, Meschiari CA, Jung M, et al. Matrix metalloproteinases in myocardial infarction and heart failure[J]. Prog Mol Biol Transl Sci, 2017, 147:75-100.
[14] Callaghan OJ, Crosbie DE, Cassidy PS, et al. Therapeutic potential of AAV-mediated MMP-3 secretion from corneal endothelium in treating glaucoma[J]. Hum Mol Genet, 2017, 26(7):1230-1246.
[15] Vandooren J, Van den Steen PE, Opdenakker G. Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9 (MMP-9): the next decade[J]. Crit Rev Biochem Mol Biol, 2013, 48(3):222-272.
[16] 欧阳谭亮,武志娟,钟金城. MMP-2和MMP-9在骨骼肌组织中的研究进展[J]. 生命科学, 2021, 33(10):1286-1295.
Ouyang TL,Wu ZJ,Zhong JC.Research pngress of MMP-2 and MMP-9 in skeletal muscle tissue[J]. Chin Bull Life Sci, 2021, 33(10):1286-1295.
[17] Fu L, Sun G, Fiorentino M, et al. Characterization of xenopus tissue inhibitor of metalloproteinases-2: a role in regulating matrix metalloproteinase activity during development[J]. PLoS One, 2012, 7(5):e36707.
[18] Nakai K, Tanaka H, Yamanaka K, et al. Effects of C-reactive protein on the expression of matrix metalloproteinases and their inhibitors via fcgamma receptors on 3T3-L1 adipocytes[J]. Int J Med Sci, 2017, 14(5):484-493.
[19] Liu Y, Liu K. Effects of spironolactone and losartan on the early neovascularization of acute myocardial infarction[J]. Exp Ther Med, 2014, 8(3):978-982.
[20] Jeong HC, Kim HY, Kim HY, et al. Changes in gene expression of cervical collagens, metalloproteinases, and tissue inhibitors of metalloproteinases after partial cervical excision-induced preterm labor in mice[J]. PLoS One, 2021, 16(4):e0250108.
[21] Wu Y, Zhu L, Liu L, et al. Interleukin-17A stimulates migration of periodontal ligament fibroblasts via p38 MAPK/NF-κB-dependent MMP-1 expression[J]. J Cell Physiol, 2014, 229(3):292-299.
[22] 谢建民,王好问,陆才生. TNF-α上调单核巨噬细胞MMP-9的活性与类风湿关节炎关节破坏的关系[J]. 中国病理生理杂志, 2009, 25(6):1181-1185.
Xie JM, Wang HW, Lu CS. Association of TNF-α upregulation of MMP-9 activation in monocyte-derived macrophages with progression of joint damage in patients with rheumatoid arthritis[J]. Chin J Pathophysiol, 2009, 25(6):1181-1185.
[23] Ong CWM, Elkington PT, Brilha S, et al. Neutrophil-derived MMP-8 drives AMPK-dependent matrix destruction in human pulmonary tuberculosis[J]. PLoS Pathogens, 2015, 11(5):e1004917.
[24] Perez-Jeldres T, Tyler CJ, Boyer JD, et al. Targeting cytokine signaling and lymphocyte traffic via small molecules in inflammatory bowel disease: JAK inhibitors and S1PR agonists[J]. Front Pharmacol, 2019, 10:212.
[25] Jayaraman P, Sada-Ovalle I, Nishimura T, et al. IL-1β promotes antimicrobial immunity in macrophages by regulating TNFR signaling and caspase-3 activation[J]. J Immunol, 2013, 190(8):4196-4204.
[26] Belton M, Brilha S, Manavaki R, et al. Hypoxia and tissue destruction in pulmonary TB[J]. Thorax, 2016, 71(12):1145-1153.
[27] Parasa VR, Muvva JR, Rose JF, et al. Inhibition of tissue matrix metalloproteinases interferes with-induced granuloma formation and reduces bacterial load in a human lung tissue model[J]. Front Microbiol, 2017, 8:e02370.
[28]王勇,杨永滨,马玉琛. MMP1、MMP2和TIMP2在雄附方干预大鼠肺间质纤维化中的作用[J]. 解放军医学院学报, 2013, 34(4):376-378+381.
Wang Y, Yang YB, Ma YC. Role of MMP1, MMP2 and TIMP2 in treatinent of pulmonary interstiltel fubrosis in rats with Xiongfufang[J]. Acad J Chin PLA Med School, 2013, 34(4):376-378+371.
[29] AlShammari B, Shiomi T, Tezera L, et al. The extracellular matrix regulates granuloma necrosis in tuberculosis[J]. J Infect Dis, 2015, 212(3):463-473.
[30] Malur A, Barna BP, Patel J, et al. Exposure to a mycobacterial antigen, ESAT-6, exacerbates granulomatous and fibrotic changes in a multiwall carbon nanotube model of chronic pulmonary disease[J]. J Nanomed Nanotechnol, 2015, 6(6):340.
[31] Poh XY, Loh FK, Friedland JS, et al. Neutrophil-mediated immunopathology and matrix metalloproteinases in central nervous system - tuberculosis[J]. Front Immunol, 2022, 12:788976.
[32] Mohan A, Neequaye N, Malur A, et al. Matrix metalloproteinase-12 is required for granuloma progression[J]. Front Immunol, 2020, 11:e553949.
[33] 张唯. 结核分枝杆菌()毒力因子Rv3033促进Mtb在巨噬细胞中存活的机制研究[D]. 苏州:苏州大学, 2016.
Zhang W. The mechanism ofvirulent factor Rv3033 on promoting the survival ofin macrophages[D]. Suzhou: Soochow University, 2016.
[34] Brilha S, Chong DLW, Khawaja AA, et al. Integrin α2β1 expression regulates matrix metalloproteinase-1-dependent bronchial epithelial repair in pulmonary tuberculosis[J]. Front Immunol, 2018, 9:e01348.
[35] Dorhoi A, Kaufmann SHE. Pathology and immune reactivity:understanding multidimensionality in pulmonary tuberculosis[J]. Semin Immunopathol, 2016, 38(2): 153-166.
[36] Fu X, Zeng L, Liu Z, et al. MicroRNA-206 regulates the secretion of inflammatory cytokines and MMP9 expression by targeting TIMP3 in mycobacterium tuberculosis-infected THP-1 human macrophages[J]. Biochem Biophys Res Commun, 2016, 477(2):167-173.
[37] Walker NF, Wilkinson KA, Meintjes G, et al. Matrix degradation in human immunodeficiency virus type 1-associated tuberculosis and tuberculosis immune reconstitution inflammatory syndrome: a prospective observational study[J]. Clin Infect Dis, 2017, 65(1):121-132.
[38] Brace PT, Tezera LB, Bielecka MK, et al.subverts negative regulatory pathways in human macrophages to drive immunopathology[J]. PLoS Pathog, 2017, 13(6):e1006367.
[39] Choi YJ, Lee WS, Lee EG, et al. Sulforaphane inhibits IL-1β-induced proliferation of rheumatoid arthritis synovial fibroblasts and the production of MMPs, COX-2, and PGE2[J]. Inflammation, 2014, 37(5):1496-1503.
[40] Yoon HY, Lee EG, Lee H, et al. Kaempferol inhibits IL-1β-induced proliferation of rheumatoid arthritis synovial fibroblasts and the production of COX-2, PGE2 and MMPs[J]. Int J Mol Med, 2013, 32(4):971-977.
[41] Lavalett L, Rodriguez H, Ortega H, et al. Alveolar macrophages from tuberculosis patients display an altered inflammatory gene expression profile[J]. Tuberculosis (Edinb), 2017, 107:156-167.
[42] Kapoor N, Bansal K, Puzo G, et al. PIM2 induced MMP-9 expression in macrophages requires PI3K and Notch1 signaling[J]. PLoS One, 2012, 4(3):e4911.
[43] 黄超,杨今实,叶晶,等. Notch1信号通过TRAF6参与TLR4介导的NF-κB激活[J]. 免疫学杂志, 2017, 33(08):673-677.
Huang C, Yang JS, Ye J, et al. Notch1 signaling enhances TILR4-mediated NF-κB activation through regulating TRAF6[J]. Immunol J, 2017, 33(8):673-677.
[44] Narayana Y, Balaji KN. NOTCH1 up-regulation and signaling involved in mycobacterium bovis BCG-induced SOCS3 expression in macrophages[J]. J Biol Chem,2008, 283(18):12501-12511.
[45] Gao F, Zhou C, Qiu W, et al. Total flavonoids from semen cuscutae target MMP9 and promote invasion of EVT cells via Notch/AKT/MAPK signaling pathways[J]. Sci Rep, 2018, 8(1):e17342.
[46] Singh S, Saraiva L, Elkington P T, et al. Regulation of matrix metalloproteinase-1, -3, and -9 in-dependent respiratory networks by the rapamycin-sensitive PI3K/p70S6Kcascade[J]. FASEB J, 2014, 28(1):85-93.
[47] Freches D, Korf H, Denis O, et al. Mice genetically inactivated in interleukin-17A receptor are defective in long-term control ofinfection[J]. Immunology, 2013, 140(2):20-31.
[48] Singh S, Maniakis-Grivas G, Singh UK, et al. Interleukin-17 regulates matrix metalloproteinase activity in human pulmonary tuberculosis[J]. J Pathol, 2018, 244(3):311-322.
[49] Moores RC , Brilha S, Schutgens F, et al. Epigenetic regulation of matrix metalloproteinase-1 and -3 expression ininfection[J]. Front Immunol, 2017, 8:602.
Progress in effects of matrix metalloproteinases on formation and immune regulation of tuberculous granuloma
LIU Li, MA Qin-mei, YU Jia-lin, DENG Guang-cun, WU Xiao-ling△
(,,,750021,)
Tuberculosis (TB) is a zoonotic disease caused by(Mtb) infection. The interaction between Mtb and the host immune system induces varieties of pathological changes in the lung. Granuloma is one of the main pathological features of TB with considerably complicated formation process. Matrix metalloproteinases (MMPs), a kind of secreted endopeptidases, are involved in the formation and immune regulation of pulmonary granulomas. Of note, MMPs participate in the immune regulation after Mtb infection, and the expression of MMPs is usually regulated by mitogen-activated protein kinases. MMPs modulate the inflammatory response in TB granuloma, and their expression affects the pathological changes of pulmonary granulomas after infection with Mtb. Inhibition of MMPs significantly reduces the granuloma formation. Inhibitors of MMPs used in the treatment of TB still need further exploration. Herein, this paper aims to provide theoretical basis for MMPs in the treatment of TB.
; Granuloma; Matrix metalloproteinases
R473.52; R363.2+1
A
10.3969/j.issn.1000-4718.2022.06.019
1000-4718(2022)06-1113-07
2022-01-07
2022-03-31
国家自然科学基金资助项目(No. 32060160);宁夏重点研发计划项目(No. 2018BFH03017)
Tel: 0951-2062129; E-mail: wuxiaol@nxu.edu.cn
(责任编辑:李淑媛,罗森)

