动脉型肺动脉高压分子标志基因的筛选与鉴定*
李洁, 刘彩莹, 严文文, 沈玉芹, 徐金媛, 徐国彤, 吕立夏, 宋浩明△
动脉型肺动脉高压分子标志基因的筛选与鉴定*
李洁1, 刘彩莹2, 严文文1, 沈玉芹1, 徐金媛2, 徐国彤3, 吕立夏2, 宋浩明1△
(1同济大学附属同济医院心内科,上海 200065;2同济大学医学院生物化学与分子生物学系,上海 200092;3同济大学医学院药学院,上海 200092)
本研究旨在筛选和鉴定参与动脉型肺动脉高压(pulmonary arterial hypertension, PAH)发病的关键基因及相关信号通路,为进一步的转化医学研究提供新靶点。从美国国立生物技术信息中心的GEO (Gene Expression Omnibus)数据库中获取人GSE113439、GSE117261、GSE48149和GSE53408基因芯片数据集,经过数据筛选后确定PAH组103例和对照组56例进行比较分析。采用NetworkAnalyst软件筛选差异基因(differentially expressed genes, DEGs),Enrichr和Metascape进行基因本体论(gene ontology, GO)和京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)分析,STRING和Cytoscape建立蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络确定潜在的枢纽基因。采用野百合碱构建PAH大鼠模型,通过测量血液动力学参数与组织形态学观察造模是否成功,RT-qPCR验证肺组织中候选基因的mRNA表达。共获得2 048个差异基因,其中1480个上调,568个下调,主要涉及炎症与细胞增殖等方面的信号通路,例如单纯疱疹病毒1感染通路、人乳头瘤病毒感染通路以及肿瘤通路等。其中最显著的DEGs依次为、、、和,枢纽基因为、、、和。野百合碱诱导4周后,PAH组大鼠右心室收缩压(right ventricular systolic pressure, RVSP)和平均肺动脉压(mean pulmonary arterial pressure, mPAP)与对照组相比显著升高(<0.05),肺组织苏木精-伊红(hematoxylin-eosin, HE)染色显示肺小动脉管壁明显增厚(<0.01),证明PAH模型建立成功。RT-qPCR结果表明,、、和的mRNA表达在PAH组显著上调(<0.05),而、、、和的mRNA表达在PAH组显著下调(<0.05),、、和的mRNA表达在两组间无显著差异(>0.05)。本研究筛选并验证了参与PAH发生的关键基因,有望为进一步的转化医学研究提供新靶点。
动脉型肺动脉高压;生物信息学;炎症;细胞增殖
动脉型肺动脉高压(pulmonary arterial hypertension, PAH)的特点是肺小动脉病变引起的肺血管阻力和肺动脉压力升高,最终导致右心室重构甚至右心衰竭和死亡。PAH对人类健康的危害极大,据统计,成人PAH人群发病率约2.4/百万人年,患病率约15/百万。未接受靶向药物治疗的PAH患者的中位生存期平均为2.8年,5年生存率仅为34%[1]。PAH的发病机制很复杂,钙、锌等离子通道和血管活性物质的失衡都参与了PAH的发展。此外,Hippo信号通路、骨形态发生蛋白7(bone morphogenetic protein-7, BMP-7)/Smads信号通路等也参与了PAH的发展[2-3]。虽然近年来对PAH的认识逐渐加深,但是目前PAH尚缺乏全面有效的治疗方法。因此,鉴定PAH关键的分子标记基因对于深入理解PAH的发病机制和开发新型治疗方法尤为重要。
近几年,随着基因测序技术的发展,基因表达总库提供了许多独立的基因表达数据集,而荟萃分析可以整合多个数据集,确定在单个数据集无法识别的分子特征,从而进一步揭示疾病深层的分子机制。目前虽有研究对GSE113439与GSE117261数据集进行生物信息学分析[4],但在本研究中整合的数据集更完整,可能揭示的分子机制也更加深入和全面。
材料和方法
1 实验动物
6~7周龄SPF级雄性Sprague-Dawley大鼠40只,体重(260±10) g,购于上海斯莱克实验动物有限公司。大鼠饲养环境温度为(22±2) ℃,明暗时间为12 h/12 h,可自由饮水摄食。
2 实验材料
野百合碱、生理盐水和多聚甲醛(Sigma-Aldrich);无水乙醇(湖北佰智昂生物化工有限公司);PCR试剂盒[天根生化科技(北京)有限公司];引物(上海生工生物技术有限公司);戊巴比妥钠(上海思域化工科技有限公司);逆转录酶试剂盒(Thermo Fisher)。
3 实验仪器
低温高速离心机(Eppendorf);实时荧光定量PCR仪(Bio-Rad);NanoDrop 2000超微量分光光度仪(Thermo Fisher);逆转录PCR仪(东胜创新公司);聚乙烯(PE)-50导管(American Health & Medical Supply International Corp.);Powerlab 8/30系统和压力传感器(AD Instruments);电子天平(上海舜宇恒平科学仪器有限公司)。
4 方法
4.1数据来源和处理从美国国立生物技术信息中心的GEO (gene expression omnibus)数据库(www.ncbi.nlm.nih.gov/geo)中获取4个mRNA表达数据集:GSE113439、GSE117261、GSE48149和GSE53408,样本均来源于人肺组织。将纳入的数据分为PAH组和正常对照(normal control, NC)组,各个数据集的特征见表1。经过log2转换和基因名注释后,将数据集上传到NetworkAnalyst(https://www.networkanalyst.ca/)[5]进行荟萃分析。将纳入的数据进行背景整合,归一化处理和数据质量检查后,使用主成分分析对结果进行去批次效应处理。用Fisher法选择差异基因(differentially expressed genes, DEGs),筛选条件为整合值<0.05。

表1 四个数据集的详细信息
4.2功能注释和通路富集分析采用Enrichr(https://maayanlab.cloud/Enrichr/)和Metascape(https://metascape.org/gp/index.html#/main/step1)[6-7]进行基因本体论(gene ontology, GO)和京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析。
4.3蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络的构建和关键基因的筛选本研究中,在STRING数据库(https://string-db.org/)[8]中对前2 000个DEGs进行蛋白质-蛋白质相互作用网络构建,并应用分子整合检测(molecular complex detection, MCODE)对DEGs进行网络成分分析,筛选degree>10的基因构建优化PPI网络。之后在Cytoscape[9]中用CytoHubba的betweenness算法筛选枢纽基因。
4.4动物分组以及干预大鼠适应1周后,分为NC组和PAH组,每组20只。操作前,将乙醇和生理盐水按2∶8的体积比混合,并将野百合碱溶于乙醇盐水中,制备野百合碱溶液。NC组大鼠在后颈部接受单次乙醇生理盐水溶液注射,PAH组大鼠接受单次野百合碱皮下注射(50 mg/kg)。两组大鼠均在同济医院特定的清洁级动物房中饲养4周,实验所涉及的大鼠操作均得到同济大学附属同济医院动物伦理委员会的审批,实验方案许可编号为2020-DW-002。
4.5血流动力学的测量4周后,大鼠禁食10 h,腹腔注射2%戊巴比妥钠(40 mg/kg)麻醉大鼠。将PE-50导管插入右心室后,用Powerlab 8/30系统和压力传感器测量右心室收缩压(right ventricular systolic pressure, RVSP)和平均肺动脉压(mean pulmonary artery pressure, mPAP)。
4.6动物处死和留取样本压力测量后,将大鼠脱颈处死,摘除肺和心脏并保存于-80 ℃冰箱。解剖左心室(left ventricle, LV)、室间隔(interventricular septum, S)及右心室(right ventricle, RV)并分别称重,计算右心室肥厚指数(right ventricular hypertrophy index, RVHI):RVHI=RV/(LV+S)。
4.7组织形态学分析大鼠左肺和心脏组织用4%多聚甲醛固定24 h,然后入石蜡切成5 μm厚的切片,进行苏木精-伊红(hematoxylin-eosin, HE)染色。通过使用Image-Pro Plus软件选取直径在50~200 μm之间的10条肺小动脉测量其血管壁面积(wall area, WA)和血管总面积(vessel total area, TA),用WA占TA的百分率(WA%)来评价肺血管重塑情况:WA%=WA/TA×100%。
4.8RT-qPCR用Trizol提取肺组织的总RNA后逆转录合成cDNA,并使用qPCR试剂盒和引物扩增待选基因的cDNA。每个样本进行3次重复并求取平均数,以GAPDH为内参照,采用2-∆∆Ct方法进行数据分析。引物序列见表2。

表2 RT-qPCR引物序列
5 统计学处理
动物实验数据用GraphPad Prism 8进行统计分析。结果用均数±标准差(mean±SD)表示。NC组和PAH组之间的差异采用检验。以<0.05为差异有统计学意义。
结果
1 数据收集和数据集分析
经过数据筛选后纳入159例患者,其中PAH组103例,NC组56例。数据处理流程,见图1A;主成分分析结果,见图1B;各个数据集的详细信息,见表1。

Figure 1. Data processing flowchart and principal component analysis. A: four datasets were downloaded from NCBI-GEO, in which 26 patients were excluded for they were not PAH; B: each point represents a sample, and the farther the distance between two samples, the greater the difference between these two samples, and the closer the distance, the smaller the difference.
2 差异基因分析
差异基因表达分析筛选出2 048个DEGs,其中1 480个上调,568个下调。前50个DEGs的热图,见图2。对前5个DEGs进行功能分析并进行动物验证,其中除GATA结合蛋白2(GATA-binding protein 2,)外,其他基因在PAH中报道较少,见表3。

Figure 2. Heatmap of the top 50 DEGs. Each grid represents the expression of a gene in a sample, where red represents genes up-regulated in PAH group, and green represents genes down-regulated in PAH group compared with NC group.

表3 前5个差异基因的功能
Positive values of the combined T stat indicate the of down-regulation genes in PAH group compared with NC group, and negative values indicate the up-regulation of genes in PAH group compared with NC group.
3 富集与通路分析
利用Enrichr和Metascape对DEGs进行的功能注释和通路富集分析。总体DEGs主要富集在单纯疱疹病毒1(herpes simplex virus 1, HSV-1)感染、人乳头瘤病毒(human papillomavirus, HPV)感染及肿瘤等通路中,见图3A;在生物过程方面主要涉及转录与DNA复制的调控、蛋白质磷酸化和RNA聚合酶Ⅱ启动子的调控,见图3B;在分子功能方面主要涉及RNA结合、钙黏蛋白结合及蛋白激酶活化,见图3C;在细胞组分方面主要涉及细胞核和中心体,见图3D。值得注意的是,本研究发现HSV-1感染通路在PAH中高度富集,然而它在PAH中的功能少有报道,因此本研究拟对HSV-1感染通路相关基因——含杆状病毒IAP重复序列蛋白2(baculoviral IAP repeat-containing protein 2,)、骨髓基质细胞抗原2(bone marrow stromal cell antigen 2,)、蛋白酪氨酸磷酸酶非受体型11(protein tyrosine phosphatase non-receptor type 11,)、(transporter associated with antigen processing 1)和进行RT-qPCR验证。

Figure 3. KEGG pathway and GO analysis of total DEGs in Enrichr. A: KEGG pathway analysis; B: GO biological process analysis; C: GO molecular function analysis; D: GO cellular component analysis. The length of the red band represents the significant degree of differential enrichment results.
上调的DEGs主要在内质网中的蛋白质加工和HSV-1感染等通路明显富集,见图4A;在GO功能方面主要涉及有丝分裂细胞周期的调控及细胞对应激的反应,见图4B。

Figure 4. KEGG pathway and GO analysis of up-regulated DEGs in Metascape. A: KEGG pathway; B: GO analysis enrichment. The different colors in the graph represent the significance of the enrichment results, and the size of the dots represents the number of enriched genes.
下调的DEGs主要在Th17细胞分化信号通路、细胞黏附分子相关通路等富集,见图5A;在GO功能方面细胞主要与对生长因子刺激的反应及血管生成相关,见图5B。

Figure 5. KEGG pathway and GO analysis of down-regulated DEGs in Metascape. A: KEGG pathway; B: GO analysis enrichment. The different colors in the graph represent the significance of enrichment results, and the size of the dots represents the number of enriched genes.
4 PPI网络的构建和枢纽基因的筛选
通过STRING和Cytoscape对DEGs构建PPI网络并筛选出枢纽基因,分别为鼠双微体蛋白2(murine double minute 2,)、热休克蛋白90α家族A类成员1(heat shock protein 90 alpha family class A member 1,)、核仁素(nucleolin,)、β-连环素(β-catenin/catenin beta 1,)和蛋白磷酸酶2催化亚基α(protein phosphatase 2 catalytic subunit alpha,),对其进行功能分析并进行动物实验验证,见图6、表4。

Figure 6. Protein-protein interaction (PPI) network of the top 2 000 DEGs. The figure shows the PPI network of the top 2 000 DEGs screened for degree greater than 10. The darker the color of the dots in the network, the greater the degree value, the more linkage with other proteins and the more important the function.
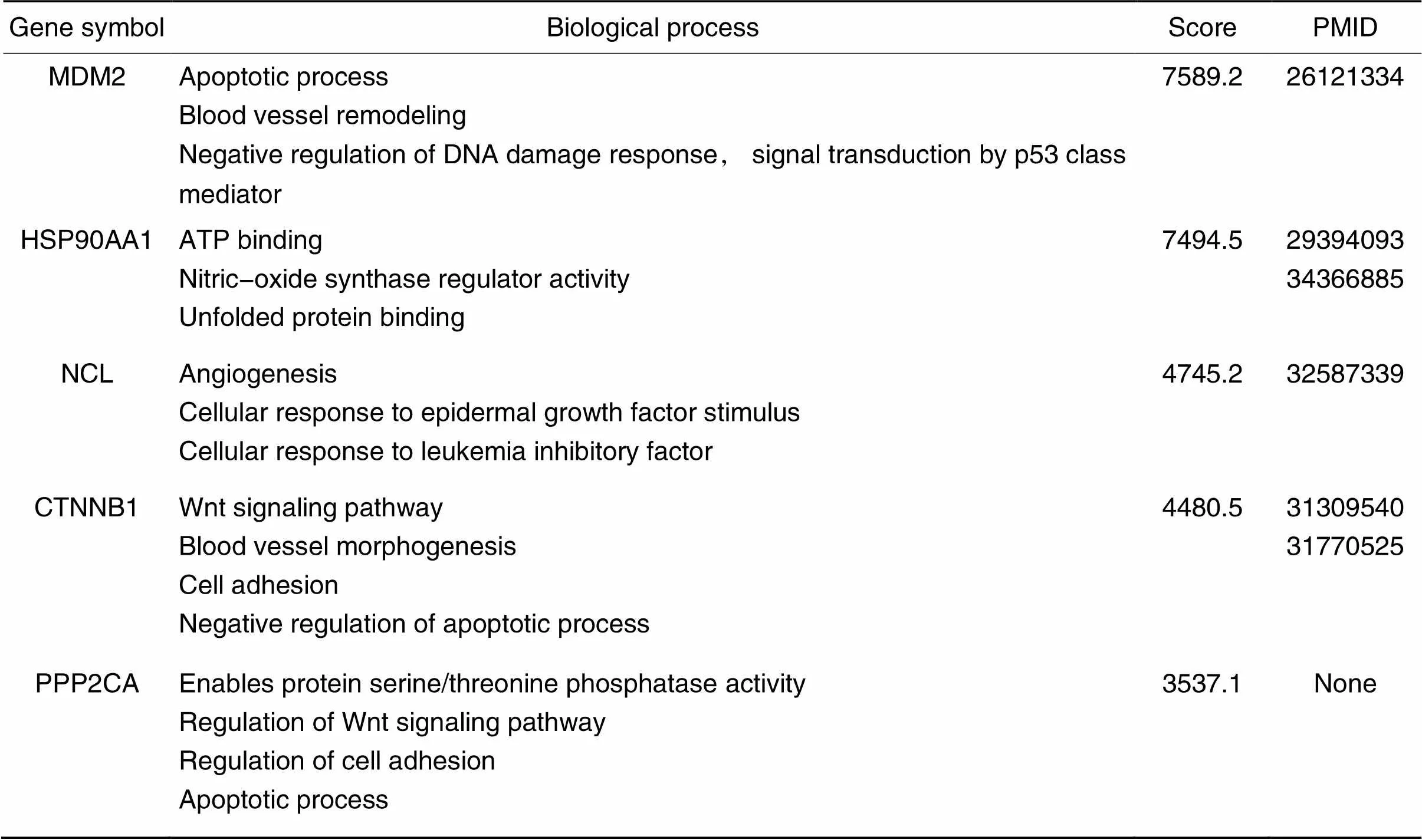
表4 Betweenness算法中排名前5位的hub基因
5 PAH模型的建立和RT-qPCR分析
4周后,与对照组相比,PAH组的大鼠出现厌食、行动迟缓、体重增长减少和呼吸急促,实验结束前均无大鼠死亡。如表5所示,PAH组所有大鼠与NC组相比,RVSP、mPAP及RVHI均显著增高(<0.05),提示造模成功。

表5 动物模型参数
*<0.05,**<0.01NC group.
于光镜下观察两组大鼠肺组织HE染色,NC组大鼠肺小动脉内皮细胞的连续性好,管壁薄,管腔面积大;PAH大鼠的肺小动脉管壁厚度明显增厚,管腔面积明显缩小,见图7。

Figure 7. Pathomorphological changes of rat lung tissues in each group (HE staining, scale bar=20 µm).
与NC组比较,PAH组大鼠肺小动脉WA%明显增高(0.01),出现明显的血管重构,见表5。
通过RT-qPCR检测差异基因在大鼠肺组织中的表达,数据显示,PAH组、、和的mRNA表达在明显上调(<0.05),而线粒体核糖体蛋白L11(mitochondrial ribosomal protein L11,)、肾上腺素受体α1A(adrenoceptor alpha 1A,)、、和的mRNA表达在PAH组明显下调(<0.05),其余基因的mRNA表达无显著差异,见图8。

Figure 8. Relative mRNA expression of key genes in PAH group and NC group. The rats in PAH group received a single injection of monocrotaline, while those in NC group received a single injection of ethanol saline solution, and then lung tissue was obtained after 4 weeks for RT-qPCR. Mean±SD. n=20. *P<0.05,**P<0.01 vs NC group.
讨论
既往大量研究已探讨过PAH的潜在机制以及内皮功能障碍、血管旁细胞增生和炎症在PAH发生发展过程中的作用,但PAH的发病机制仍未完全阐明。本研究通过生物信息学分析筛选出2 048个DEGs,并用野百合碱诱导的PAH大鼠的肺组织对15个关键基因进行检测,其中、、和的mRNA表达在PAH组中显著上调,、、、和的mRNA表达在PAH组中显著下调,大部分关键基因功能与细胞增殖及能量代谢的转变有关。此外HSV-1感染、HPV感染、Th17细胞分化信号通路、细胞黏附分子通路等炎症和免疫相关信号通路的明显富集,提示免疫炎症参与了PAH的发病机制。因此本研究将从细胞增殖和免疫紊乱相关机制方面予以阐述。
1 细胞增殖和凋亡等相关基因
MRPL11是MRP家族的成员。研究表明,下调可以导致线粒体翻译缺陷,从而引起线粒体编码蛋白的合成减少以及氧化磷酸化亚基的合成受损,最终导致细胞能量代谢的转变,抑制细胞的迁移与增殖[10-11]。既往研究提示,线粒体功能障碍通过多种途径参与PAH的发生发展,Ryan等[12]发现PAH患者的线粒体DNA缺失和线粒体ATP产生增加等会促进PAH患者的肺动脉平滑肌细胞(pulmonary artery smooth muscle cells, PASMCs)的增殖,从而导致血管松弛功能受损。在本研究中,的表达在PAH组中显著下调,同时通过对野百合碱诱导的PAH大鼠的肺组织进行检测,我们证实的表达在PAH大鼠中也明显下调。因此我们推测MRPL11可能通过调节线粒体编码蛋白的合成及细胞的糖酵解代谢状态来参与PAH的发生发展。
ADRA1A是G蛋白偶联受体超家族的成员其中的一个亚型,可调节细胞生长和增殖。研究表明,下调可能促进成纤维细胞的增殖和胶原蛋白的产生[13]。在本研究中的下调说明其可能通过调节肺小动脉成纤维细胞等细胞的增殖,在PAH的形成中起到作用。
GATA2是锌指转录因子GATA家族的成员,在调节细胞增殖相关基因的转录方面起着重要作用。唐思锋等[14]的研究结果表明干扰或的表达可以抑制基因的表达从而降低细胞自噬水平,促进细胞凋亡。本研究中的下调与既往的研究结果一致[15],说明在PAH的发生形成中,GATA2可能通过调节部分细胞的自噬从而促进PAH的发生和发展。
MDM2是一种E3泛素蛋白连接酶,在调节细胞的增殖与凋亡发挥重要作用。研究表明,抑制的表达能够负向调控血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达从而抑制肺高压小鼠肺血管内皮细胞的增殖[16]。此外,抑制的表达可使线粒体中活性氧的产生增加,导致线粒体DNA损伤,最终促进细胞凋亡[17]。在本研究中,在PAH组中显著上调可能说明其可通过调节内皮细胞的增殖参与PAH的发展。
NCL位于真核细胞核仁中,可由VEGF和细胞外基质协同介导从细胞核转移到细胞表面,参与核糖体的生物合成、成熟以及细胞增殖等生物过程。对内皮细胞表面NCL的表达进行功能性阻断或下调可明显抑制内皮细胞的增殖、迁移以及血管的生成[18]。在本研究中,在PAH组中显著上调,提示NCL可能通过促进内皮细胞等细胞的增殖与迁移从而影响PAH的发展。
2 免疫炎症相关基因
HSP90AA1是HSP90家族的一员。有研究表明,HSP90可以在PAH大鼠的PASMCs线粒体中过表达,通过维持线粒体DNA的完整性减少PASMCs的氧化损伤,促进PASMC的增殖[19]。此外,HSP90通过核因子κB(nuclear factor-κB, NF-κB)通路和NOD样受体蛋白3(NOD-like receptor protein 3, NLRP3)通路激活炎症因子,如肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白细胞介素6(interleukin-6, IL-6)和IL-1β[20]。在本研究中在肺组织中的上调,表明HSP90AA1可能通过线粒体相关通路以及NLRP3等炎症通路加重细胞氧化损伤以及炎症反应参与PAH的发生和发展。
β-catenin/是Wnt/β-catenin通路的核心成分。目前认为抑制Wnt/β-catenin通路的激活能够降低细胞周期蛋白D1、VEGF和c-Myc的表达从而抑制PASMCs的增殖,减轻PAH[21-22]。同时Wnt/β-catenin信号对T细胞的分化、效应功能和迁移至关重要[23]。因此,我们推测β-catenin/可能通过Wnt/β-catenin通路调节细胞的增殖以及T细胞的功能,从而在PAH中起到重要作用。
本研究中DEGs的富集分析结果显示PAH组的Th17细胞分化信号通路、细胞黏附分子通路和趋化因子信号通路都存在明显富集[24-26],这些信号通路与既往研究结果报道一致。其中HSV-1感染通路富集明显,而其在PAH中的功能目前则知之甚少。HSV-1是一种常见的人类病原体,其参与了多种心血管疾病的发展[27]。HSV-1感染可通过增加细胞间黏附分子1(intercellular adhesion molecule-1, ICAM-1)和一氧化氮水平导致内皮功能紊乱,从而使白细胞经过淋巴细胞功能相关抗原1(lymphocyte function-associated antigen 1, LFA-1)/ICAM-1复合体通过内皮屏障[28]。此外,HSV-1还可以通过增强三酰甘油和饱和胆固醇酯在血管平滑肌细胞(vascular smooth muscle cells, VSMCs)中的累积以介导VSMCs的增殖[29-30]。目前认为PAH的发生是由内皮屏障的破坏而启动的,因此我们认为HSV-1可能通过病毒的感染,增加ICAM-1水平引发内皮屏障功能障碍,同时导致PASMCs的增殖,从而最终促进PAH的发生和发展。在本研究中,我们也验证了HSV-1感染通路的相关基因,其中和在PAH组显著下调,其余基因没有显著性差异,但有降低趋势。研究表明,PTPN11能够通过与腺嘌呤核苷酸转运酶1(adenine nucleotide translocase 1, ANT1)结合激活caspase-1从而抑制NLRP3的过度激活[31],而抑制能够通过Akt和STAT3通路抑制PASMCs的迁移和增殖,改善肺小动脉的重塑[32]。BST2能够作为细胞黏附分子参与内皮细胞对单核细胞的招募[33],并通过激活EGFR以及NF-κB通路从而调节细胞周期蛋白cyclin A和cyclin D1,以及凋亡蛋白Bax、Bcl2与caspas-3的表达,促进细胞增殖,抑制细胞凋亡[34-35]。在本研究中,和在PAH组中显著下调,说明与可能通过对炎症的激活以及细胞周期的调节参与PAH的发生与发展。
综上所述,本研究采用生物信息学的方法对GEO数据库中的PAH基因芯片数据进行整合分析,筛选差异基因并经GO及KEGG富集分析,得到比单个数据集更加全面可靠的差异基因和信号通路。其中,HSV-1感染通路等新通路的发现可为深入研究PAH发生机制提供方向。此外,、、和等新的关键基因的发现,可能为PAH的转化医学相关研究提供新的靶点。
[1]中华医学会呼吸病学分会肺栓塞与肺血管病学组,中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会,全国肺栓塞与肺血管病防治协作组,等. 中国肺动脉高压诊断与治疗指南(2021版)[J]. 中华医学杂志, 2021, 101(1):11-51.
Pulmonary Embolism and Pulmonary Vascular Disease Group of the Chinese Medical Association, Pulmonary Embolism and Pulmonary Vascular Disease Working Committee of the Respiratory Physicians Branch of the Chinese Medical Association, National Pulmonary Embolism and Pulmonary Vascular Disease Prevention and Treatment Collaborative Group, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension in China (2021 edition)[J]. Natl Med J Chin, 2021, 101(1):11-51.
[2]朱宁,陈皓,赵旭勇,等. 野百合碱诱导的大鼠肺动脉高压对大鼠肺Hippo信号通路相关分子表达的影响[J]. 中国病理生理杂志, 2019, 35(7):1333-1338.
Zhu N, Chen H, Zhao XY, et al. Effects of monocrotaline-induced pulmonary hypertension on expression of Hippo signaling pathway-related molecules in rat lung[J]. Chin J Pathophysiol, 2019, 35(7):1333-1338.
[3]张晶晶,武垣伶,黄丹娜,等. BMP-7/Smads通路参与EndoMT在大鼠HHPH中的作用[J]. 中国病理生理杂志, 2020, 36(2):316-322.
Zhang JJ, Wu YL, Huang DN, et al. Role of BMP-7/Smads pathway in regulation of EndoMT in rats with HHPH[J]. Chin J Pathophysiol, 2020, 36(2):316-322.
[4]仲红艳,唐珊,赵飞飞,等. 肺动脉高压关键基因的筛选及生物信息学分析[J]. 中国循环杂志, 2020, 35(8):793-800.
Zhong HY, Tang S, Zhao FF, et al. Key genes for pulmonary arterial hypertension screened with bioinformatics analysis[J]. Chin Circ J, 2020, 35(8):793-800.
[5] Zhou G, Soufan O, Ewald J, et al. NetworkAnalyst 3.0: a visual analytics platform for comprehensive gene expression profiling and meta-analysis[J]. Nucleic Acids Res, 2019, 47(W1):W234-W241.
[6] Kuleshov MV, Jones MR, Rouillard AD, et al. Enrichr: a comprehensive gene set enrichment analysis web server 2016 update[J]. Nucleic Acids Res, 2016, 44(W1):W90-W97.
[7] Zhou Y, Zhou B, Pache L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nat Commun, 2019, 10(1):1523.
[8] Shannon P, Markiel A, Ozier O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Res, 2003, 13(11):2498-2504.
[9] Szklarczyk D, Gable AL, Lyon D, et al. STRING v11: protein-protein association networks with increased coverage,supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Res, 2019, 47(D1): D607-D613.
[10] Huang G, Li H, Zhang H. Abnormal expression of mitochondrial ribosomal proteins and their encoding genes with cell apoptosis and diseases[J]. Int J Mol Sci, 2020, 21(22):8879.
[11] Besse A, Brezavar D, Hanson J, et al. LONP1 de novo dominant mutation causes mitochondrial encephalopathy with loss of LONP1 chaperone activity and excessive LONP1 proteolytic activity[J]. Mitochondrion, 2020, 51:68-78.
[12] Ryan J, Dasgupta A, Huston J, et al. Mitochondrial dynamics in pulmonary arterial hypertension[J]. J Mol Med (Berl), 2015, 93(3):229-242.
[13] Drummond PD, Dawson LF, Wood FM, et al. Up-regulation of α1-adrenoceptors in burn and keloid scars[J]. Burns, 2018, 44(3):582-588.
[14] 唐思锋,王德友,赵伟. 从GATA2、GATA6探究环状RNA调控胃癌自噬和凋亡的机制[J]. 中华实验外科杂志, 2020, 37(9):1655-1657.
Tang SF, Wang DY, Zhao W. Mechanism of autophagy and apoptosis regulated by cyclic RNA in gastric cancer from GATA2 and GATA6[J]. Chin J Exp Sur, 2020, 37(9):1655-1657.
[15] Marciano BE, Olivier KN, Folio LR, et al. Pulmonary manifestations of GATA2 deficiency[J]. Chest, 2021, 160(4):1350-1359.
[16] Shen H, Zhang J, Wang C, et al. MDM2-mediated ubiquitination of angiotensin-converting enzyme 2 contributes to the development of pulmonary arterial hypertension[J]. Circulation, 2020, 142(12):1190-1204.
[17] Elkholi R, Abraham-Enachescu I, Trotta AP, et al. MDM2 integrates cellular respiration and apoptotic signaling through NDUFS1 and the mitochondrial network[J]. Mol Cell, 2019, 74(3):452-465.
[18] Huang Y, Shi H, Zhou H, et al. The angiogenic function of nucleolin is mediated by vascular endothelial growth factor and nonmuscle myosin[J]. Blood, 2006, 107(9):3564-3571.
[19] Boucherat O, Peterlini T, Bourgeois A, et al. Mitochondrial HSP90 accumulation promotes vascular remodeling in pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2018, 198(1):90-103.
[20] Li F, Song X, Su G, et al. AT-533, a Hsp90 inhibitor, attenuates HSV-1-induced inflammation[J]. Biochem Pharmacol, 2019, 166:82-92.
[21] Wande Y, Jie L, Aikai Z, et al. Berberine alleviates pulmonary hypertension through Trx1 and β-catenin signaling pathways in pulmonary artery smooth muscle cells[J]. Exp Cell Res, 2020, 390(1):111910.
[22] Yu XM, Wang L, Li JF, et al. Wnt5a inhibits hypoxia-induced pulmonary arterial smooth muscle cell proliferation by downregulation of β-catenin[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 304(2):L103-L111.
[23] Li X, Xiang Y, Li F, et al. WNT/β-catenin signaling pathway regulating T cell-inflammation in the tumor microenvironment[J]. Front Immunol, 2019, 10:2293.
[24] Szulcek R, Happé CM, Rol N, et al. Delayed microvascular shear adaptation in pulmonary arterial hypertension. Role of platelet endothelial cell adhesion molecule-1 cleavage[J]. Am J Respir Crit Care Med, 2016, 193(12):1410-1420.
[25] Bhagwani A, Thompson AAR, Farkas L. When innate immunity meets angiogenesis-the role of toll-like receptors in endothelial cells and pulmonary hypertension[J]. Front Med (Lausanne), 2020, 7:352.
[26] Hashimoto-Kataoka T, Hosen N, Sonobe T, et al. Interleukin-6/interleukin-21 signaling axis is critical in the pathogenesis of pulmonary arterial hypertension[J]. Proc Natl Acad Sci U S A, 2015, 112(20):E2677-E2686.
[27] Rauff B, Malik A, Bhatti YA, et al. Association of viruses in the development of cardiovascular diseases[J]. Curr Pharm Des, 2021, 27(37):3913-3923.
[28] Liu H, Qiu K, He Q, et al. Mechanisms of blood-brain barrier disruption in herpes simplex encephalitis[J]. J Neuroimmune Pharmacol, 2019, 14(2):157-172.
[29] Hajjar DP, Pomerantz KB, Falcone DJ, et al. Herpes simplex virus infection in human arterial cells. Implications in arteriosclerosis[J]. J Clin Invest, 1987, 80(5):1317-1321.
[30] Skelly CL, He Q, Spiguel L, et al. Modulating vascular intimal hyperplasia using HSV-1 mutant requires activated MEK[J]. Gene Ther, 2013, 20(2):215-224.
[31] Guo W, Liu W, Chen Z, et al. Tyrosine phosphatase SHP2 negatively regulates NLRP3 inflammasome activation via ANT1-dependent mitochondrial homeostasis[J]. Nat Commun, 2017, 8(1):2168.
[32] Cheng Y, Yu M, Xu J, et al. Inhibition of Shp2 ameliorates monocrotaline-induced pulmonary arterial hypertension in rats[J]. BMC Pulm Med, 2018, 18(1):130.
[33] Yoo H, Park SH, Ye SK, et al. IFN-γ-induced BST2 mediates monocyte adhesion to human endothelial cells[J]. Cell Immunol, 2011, 267(1):23-29.
[34] Liu W, Cao Y, Guan Y, et al. BST2 promotes cell proliferation,migration and induces NF-κB activation in gastric cancer[J]. Biotechnol Lett, 2018, 40(7):1015-1027.
[35] Jin H, Zhang L, Wang S,et al. BST2 promotes growth and induces gefitinib resistance in oral squamous cell carcinoma via regulating the EGFR pathway[J]. Arch Med Sci, 2021, 17(6):1772-1782.
Screening and identification of molecular marker genes for pulmonary arterial hypertension
LI Jie1, LIU Cai-ying2, YAN Wen-wen1, SHEN Yu-qin1, XU Jin-yuan2, XU Guo-tong3, LÜ Li-xia2, SONG Hao-ming1△
(1,,,,200065,;2,,,200092,;3,,,200092,)
To identify the key genes and related signaling pathways involved in the pathogenesis of pulmonary arterial hypertension (PAH), which can provide new targets for translational medicine research.GSE113439, GSE117261, GSE48149 and GSE53408 gene microarray datasets were extracted from Gene Expression Omnibus (GEO) database, and then 103 cases of PAH and 56 cases of healthy controls were identified after data screening for comparison analysis. NetworkAnalyst was used to screen differentially expressed genes (DEGs), and Enrichr and Metascape were used for gene ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) analysis. Moreover, protein-protein interaction (PPI) network was established using STRING and Cytoscape to identify the hub genes. Rat PAH model was constructed using monocrotaline, which was determined by measuring haemodynamic parameters and histomorphological observations. Changes in mRNA levels of candidate DEGs in lung tissues were validated by RT-qPCR.A total of 2 048 DEGs were obtained, in which 1 480 were up-regulated and 568 were down-regulated. These genes were mainly relevant to inflammation and proliferation, such as herpes simplex virus 1 infection, human papillomavirus infection and pathways in cancer.,,,andwere the most significant DEGs, and hub genes including,,,andwere also identified. Four weeks after the injection of monocrotaline, right ventricular systolic pressure (RVSP) and mean pulmonary arterial pressure (mPAP) of rats in PAH group were significantly higher compared to the control group (<0.05), and hematoxylin-eosin (HE) staining of lung tissues showed that the walls of small pulmonary arteries were significantly thickened (<0.01), which indicated PAH model was established successfully. The up-regulation of,,and, and down-regulation of,,andin PAH group were verified by RT-qPCR (<0.05), while the expression of,,andwere not significantly different (>0.05).Key genes involved in the development of PAH were identified, which were expected to provide new targets for translational medicine research.
Pulmonary arterial hypertension; Bioinformatics; Inflammation; Cell proliferation
R563; R363.2
A
10.3969/j.issn.1000-4718.2022.06.014
1000-4718(2022)06-1063-12
2021-12-13
2022-02-10
国家自然科学基金青年基金资助项目(No. 81700316)
Tel: 13004113931; E-mail: songhao-ming@163.com
(责任编辑:余小慧,宋延君)

