龙胆苦苷对大鼠腹膜纤维化的抑制作用及其机制研究*
李玉博, 张健, 张再媛, 李城明, 龙盘, 肖雯婧, 呼永河△
龙胆苦苷对大鼠腹膜纤维化的抑制作用及其机制研究*
李玉博1,2, 张健3, 张再媛3, 李城明4, 龙盘5, 肖雯婧6, 呼永河1,2△
(1西南医科大学中西医结合学院,四川 泸州 646000;2中国人民解放军西部战区总医院基础医学实验室,四川 成都 610083;3西南交通大学医学院,四川 成都 610031;4成都中医药大学,四川 成都 610075;5中国人民解放军西部战区总医院眼科,四川 成都 610083;6中国人民解放军西部战区总医院药剂科,四川 成都 610083)
观察龙胆苦苷对腹膜透析大鼠腹膜纤维化组织氧化应激反应和转化生长因子β(TGF-β)/Smads信号通路的影响,探讨龙胆苦苷防治腹膜纤维化的作用机制。通过4.25%高糖腹膜透析液(100 mL/kg;每天1次)联合脂多糖(0.6 mg/kg;第1、3、5、7天注射)构建大鼠腹膜纤维化模型。将30只雄性SD大鼠随机分为5组:生理盐水组、模型组及低、中、高剂量(30、60和120 mg/kg)龙胆苦苷组,每组6只。透析28 d后行1 h腹膜功能试验:测定超滤量、初始腹透液与透出液葡萄糖比值、透析液与血浆尿素氮比值及葡萄糖转运量。取大鼠壁层腹膜进行腹膜病理形态学观察,计算腹膜厚度。取腹主动脉血检测血清丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)水平。免疫组化检测各组大鼠腹膜组织中α-平滑肌肌动蛋白(α-SMA)、上皮钙黏素(E-cadherin)和I型胶原(COL I)的表达情况。Western blot检测各组大鼠腹膜组织中TGF-β1、Smad3和Smad7蛋白的表达。透析28 d后,经腹腔注射4.25%高糖腹膜透析液及脂多糖建立的腹膜纤维化大鼠模型腹膜功能显著降低(0.05),腹膜厚度显著增加(0.01),并可见炎症细胞浸润、纤维细胞及血管增生明显增多;大鼠血清中MDA含量显著增多,SOD和GSH-Px活性显著降低(0.01);免疫组化显示,α-SMA和COL I蛋白表达显著增加,E-cadherin蛋白表达显著降低(0.01);Western blot显示,TGF-β1和Smad3蛋白表达显著增加,Smad7蛋白表达显著降低(0.01)。龙胆苦苷干预能够显著降低氧化应激水平,抑制TGF-β1和Smad3蛋白的表达,提高Smad7蛋白表达水平,且呈剂量依赖性(0.05)。龙胆苦苷可减轻高糖腹透液联合脂多糖诱导的腹膜纤维化模型大鼠的腹膜纤维化病变程度,其机制与抑制氧化应激反应及腹膜间皮-间充质转化进程有关。
龙胆苦苷;腹膜纤维化;氧化应激;间皮-间充质转化
腹膜纤维化(peritoneal fibrosis, PF)是腹膜透析治疗过程中一种常见且严重的并发症,其主要病理改变为细胞外基质(extracellular matrix, ECM)堆积及间皮-间充质转化(mesothelial-mesenchymal transition, MMT),同时既往研究显示氧化应激反应在PF发生发展过程中起到重要作用[1-3]。
PF可导致腹膜超滤功能和转运功能衰竭。由PF导致的腹膜超滤衰竭是PF患者退出腹膜透析治疗的主要原因[4],给腹膜透析患者后续的治疗与生存带来极大威胁,但目前临床上仍缺乏有效治疗PF的药物。既往研究证实,龙胆苦苷(gentiopicroside, GPS)具有抗氧化和清除自由基等作用[5],在肺纤维化[6]、肝纤维化[7]、糖尿病肾纤维化[8]等纤维化疾病中发挥治疗作用,但尚未见其在PF中有相关研究。我们前期的预实验观察到GPS可有效减少PF大鼠腹膜厚度,基于此,本研究采用4.25%高糖腹膜透析液联合脂多糖建立PF大鼠模型,从腹膜功能、结构及分子生物学水平系统探讨GPS对大鼠PF的影响。
材料和方法
1 动物
30只清洁级雄性Sprague-Dawley(SD)大鼠,6~8周龄,体重170~250 g,购自成都达硕实验动物有限公司,许可证号为SCXK(川)2020-030。饲养环境:12 h光照/12 h黑暗循环;环境温度(23±2) ℃;湿度(55±5)%;通风良好;无噪音环境;供给充足食物和水。动物实验符合西部战区总医院伦理委员会标准,并获得医院动物伦理委员会的批准。
2 主要试剂
GPS单体(提取自中药龙胆草,属于裂环环烯醚萜苷类化合物,分子式C16H20O9,分子量356.32)购自南京道斯夫生物有限公司;4.25%高糖腹膜透析液(广州百特医疗器械有限公司);丙二醛(molondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)和葡萄糖检测试剂盒均购自南京建成生物工程研究所;脂多糖(lipopolysaccharide, LPS)、HE染色试剂盒、改良Masson三色染色试剂盒及尿素氮试剂盒购自北京索莱宝科技有限公司;全蛋白提取试剂盒和BCA蛋白含量检测试剂盒购自江苏凯基生物技术股份有限公司;兔抗TGF-β1单克隆抗体、兔抗Smad3单克隆抗体及兔抗Smad7多克隆抗体购自Abcam;兔抗α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、上皮钙黏素(E-cadherin)和I型胶原(collagen type I, COL I)多克隆抗体及辣根过氧化物酶标记羊抗兔IgG购自北京博奥森生物技术有限公司;小鼠抗GAPDH单克隆抗体购自武汉三鹰生物技术有限公司。
3 主要方法
3.1药品配制(1)脂多糖溶液的配制:每瓶脂多糖为10 mg,加入生理盐水10 mL充分溶解配成1 g/L的脂多糖原液;取其中0.6 mL,加入4.25%腹膜透析液99.4 mL混匀,即配制成0.006 g/L的脂多糖溶液。(2)GPS溶液的配制:取GPS固体粉末210 mg,加入生理盐水3.5 mL配制成60 g/L的GPS原液;取其中0.5、1和2 mL分别加入至99.5、99和98 mL的4.25%腹膜透析液中混匀,即配制成0.3、0.6和1.2 g/L GPS溶液。(3)GPS与脂多糖混合溶液的配制:将用生理盐水配制的脂多糖原液0.6 mL与GPS原液3.5 mL充分混合,取其中的1.1、1.6和2.6 mL分别加入到98.9、98.4和97.4 mL的腹膜透析液中混匀。
3.2动物模型建立及给药项协隆等[9]的研究显示使用4.25%腹膜透析液+脂多糖建立的PF大鼠模型,接近临床观察到的腹膜透析相关的PF,我们前期预实验采用上述方法也成功建立了PF大鼠模型。30只SD大鼠随机分为5组:生理盐水(normal saline, NS)组、模型组(model组)、低剂量(30 mg/kg)GPS组(GPS 30组)、中剂量(60 mg/kg)GPS组(GPS 60组)和高剂量(120 mg/kg)GPS组(GPS 120组),每组各6只。NS组腹腔注射无菌生理盐水(100 mL·kg-1·d-1),model组注射4.25%腹膜透析液(100 mL·kg-1·d-1),GPS组腹腔注射GPS溶液(100 mL·kg-1·d-1),model组和GPS组在给药的第1、3、5、7天联合注射脂多糖溶液(0.6 mg/kg),均采用左下腹注射,建立PF大鼠模型。
3.3动物取材于实验第28天注射上述药物1 h后腹腔注射4%水合氯醛(10 mL/kg)麻醉大鼠,先用20 mL注射器自大鼠左下腹抽取腹腔内腹液体,量取体积,然后沿腹白线打开腹腔用干燥棉球充分吸取残余液体,称取重量,最后出水量=[引流量+(棉球吸水后的重量-干燥棉球的重量)]×1 mL/g,计算透出液总量后将其以111.8×离心5 min,取上清液保存于-20 ℃;暴露腹主动脉采血针取腹主动脉血以1 006.2×离心10 min,收集血清保存于-20 ℃;连同腹壁肌肉取1 cm×1 cm腹正中壁层腹膜组织,PBS洗去残留血液及毛发后立即置于4%多聚甲醛中,并取脏层腹膜(肠系膜)组织保存于-80 ℃中以备后续做相关指标检测。
3.4腹膜功能评估取所收集的血清及腹腔透出液,使用尿素氮及葡萄糖检测试剂盒检测血清、初始腹透液及1 h后腹腔透出液,测定腹腔透出液尿素氮浓度(D)、血清尿素氮浓度(P)、腹腔透出液葡萄糖浓度(D1)及初始腹透液葡萄糖浓度(D0)。(1)1 h腹膜超滤量(ultrafiltration, UF)=最后出水量-初始注射量;(2)葡萄糖转运量(mass transfer of glucose, MTG)=透析液初始葡萄糖浓度×注入透析液体积-透析末葡萄糖浓度×终末透析液出量;(3)腹膜平衡试验(peritoneal equilibration test, PET)的测定:计算D/P urea(透出液尿素氮/血清尿素氮)和D1/D0。
3.5大鼠腹膜组织病理学观察将经4%多聚甲醛固定48 h以上的壁层腹膜组织取出,流水冲洗后进行梯度乙醇脱水、二甲苯透明、浸蜡、包埋、固定、连续切片,制作为4 μm厚的石蜡切片,烤片机上烘干1 h,二甲苯脱蜡、梯度乙醇水化、染色、分化、脱水、透明、封片后行HE及Masson染色,光镜下观察病理改变。Masson染色切片行壁层腹膜厚度测量,每组随机测量6个高倍视野,每个视野下取四个值,最后以平均值作为判定厚度的标准。
3.6大鼠血清MDA含量及SOD和GSH-Px活性的测量取所收集血清,按照MDA、SOD和GSH-Px生化试剂盒说明书加入样本及试剂,酶标仪测定吸光度(),最后计算出血清中MDA含量及SOD和GSH-Px活性。血清中丙二醛含量(μmol/L)=(测定值-对照值)/(标准值-空白值)×标准品浓度(10 μmol/L)×样品测试前稀释倍数;血清中SOD活性(U/mL)=SOD抑制率÷50%×反应体系稀释倍数(0.24 mL/0.02 mL)×样本测试前稀释倍数,SOD抑制率(%)=[(对照-对照空白)-(测定-测定空白)]÷(对照-对照空白)×100%;血清中GSH-Px活性(U/mL)=(非酶管值-酶管值)/(标准管值-空白管值)×标准品浓度(20 μmol/L)×稀释倍数×样品测试前稀释倍数。
3.7免疫组化观察PF相关蛋白表达将制作的壁层腹膜组织石蜡切片常规脱蜡、水化,流水冲洗后置于枸橼酸缓冲液(pH 6.0)中微波炉高火3 min,中火8~10 min进行抗原修复,3%过氧化氢溶液孵育20~30 min灭活辣根过氧化物酶,于磷酸盐缓冲液中洗涤3次,每次5 min,5%山羊血清封闭30 min,然后分别加入α-SMA、E-cadherin和COL I抗体(按1∶100比例稀释),4 ℃孵育过夜,次日37 ℃复温0.5~1 h,用PBS洗涤,滴加山羊抗兔Ⅱ抗(按1∶2 000比例稀释)后37 ℃孵育1 h,PBS洗涤,滴加DAB(二氨基联苯胺)进行显色3~5 min,流水冲洗后复染、分化、脱水、透明、封片。切片置于显微镜下观察并拍照,应用ImageJ软件分析,每组随机选取5个视野,计算阳性表达面积占整个视野百分比,取每组平均值作为该组最终值。
3.8Western blot法检测TGF-β1、Smad3和Smad7蛋白表达水平(1)配制蛋白裂解液:按照每100 mg加1 mL的用量计算所需裂解液总量,每1 mL裂解缓冲液加入10 μL磷酸酶抑制剂,1 μL蛋白酶抑制剂和10 μL PMSF混匀,冰上保存。(2)提取总蛋白并定量:将存于-80 ℃的脏层腹膜组织取出,称取(100±5) mg大鼠腹膜组织,加入1 mL配置好的裂解液迅速研磨匀浆,取组织匀浆液到1.5 mL预冷的离心管,于4 ℃、1 609.92×离心5 min后取上清液,BCA法蛋白定量,加入上样缓冲液,100 ℃水浴10 min使蛋白变性,分装置于-80 ℃保存。(3)电泳、转膜、免疫反应及显影配胶:上样,电泳(80 V 0.5 h, 120 V 1 h),切胶,转膜(300 mA, 2 h),5%脱脂牛奶室温封闭膜1.5 h,Ⅰ抗室温孵育膜1 h,4 ℃过夜;次日取出膜并用TBST洗3次,每次10 min,加入山羊抗兔Ⅱ抗室温孵育1 h,TBST洗,显色液显色并利用UVP成像仪成像后拍照。以GAPDH为内参照,ImageJ软件计算各条带的灰度值,半定量分析后比较各组差异。
4 统计学处理
采用SPSS 23.0软件进行统计学分析。实验数据进行正态性及方差齐性检验,以均数±标准差(mean±SD)表示。方差齐,多组比较采用单因素方差分析(one-way ANOVA),多组间两两比较采用最小显著性差异法(LSD法);方差不齐,采用Kruskal-Wallis检验。以0.05为差异有统计学意义。
结果
1 大鼠体重变化情况
大鼠实验期间腹腔注射更换注射部位,无明显硬结、皮下血肿,腹膜透析耐受性良好,各组无大鼠死亡。各组大鼠分别于第1、8、15、22天清晨空腹称重。结果显示,第1天各组大鼠体重无显著差异(0.05);第2~8天model组和GPS组由于注射脂多糖精神不佳,体重增长减慢;第9~28天各组大鼠体重持续增长;第28天,与NS组及GPS组比较,model组体重整体上偏高,但未见显著差异(0.05),见表1。
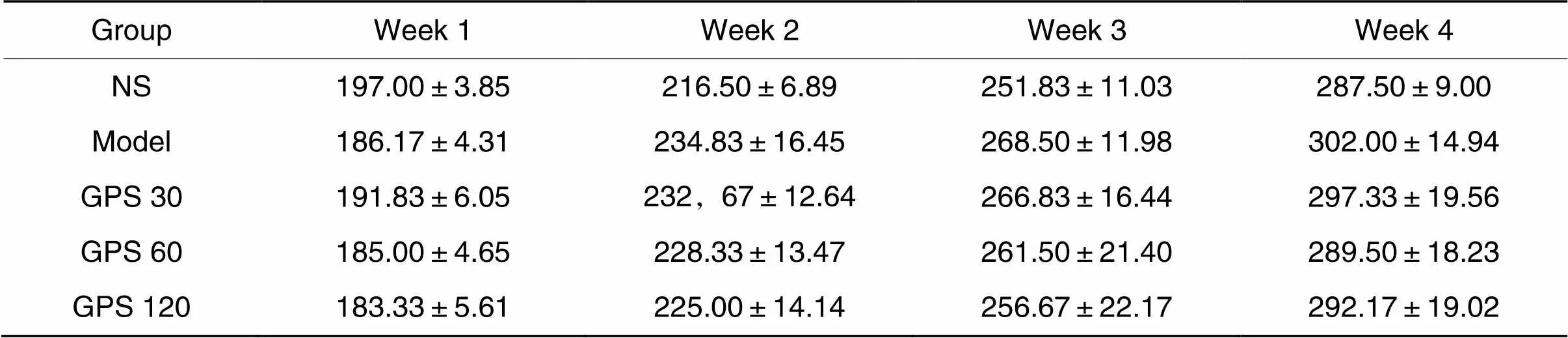
表1 各组大鼠每周体重变化情况
2 大鼠腹膜功能变化结果
大鼠腹膜功能于实验第28天进行评估,向所有大鼠腹腔内注射4.25%腹膜透析液,透析液在腹腔内停留1 h后,收集腹腔透出液,计算并分析UF、MTG及腹膜平衡试验指标(D/P urea和D1/D0)。结果显示,与NS组相比,model组UF显著下降,MTG显著升高,腹膜平衡试验model组D/P urea显著上升,D1/D0显著下降(0.05);与model组相比,GPS各组UF上升,MTG下降,腹膜平衡试验显示GPS各组D/P urea显著下降,D1/D0显著上升(0.05),见表2。
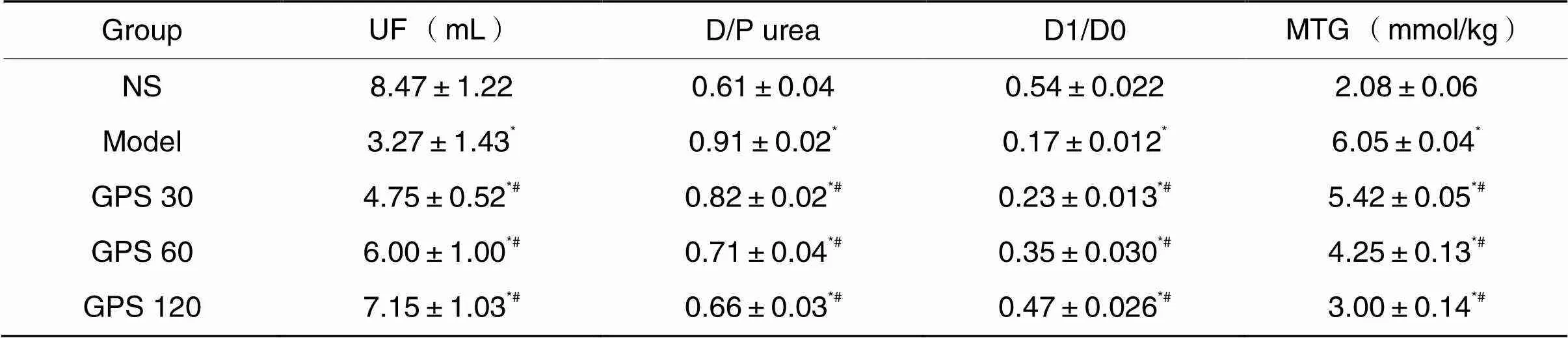
表2 各组大鼠腹膜功能测定结果
*<0.05NS group;#<0.05model group.
3 大鼠腹膜组织HE及Masson染色结果
大鼠正中壁层腹膜经HE染色后光学显微镜下观察可见,NS组大鼠壁层腹膜间皮下基质较薄,炎症细胞浸润及血管生成少,间皮下无明显胶原纤维沉积;model组可见腹膜基质明显增多、胶原纤维大量沉积,有核细胞浸润及新生血管增多;而GPS各组上述改变较PF组明显减轻,见图1。
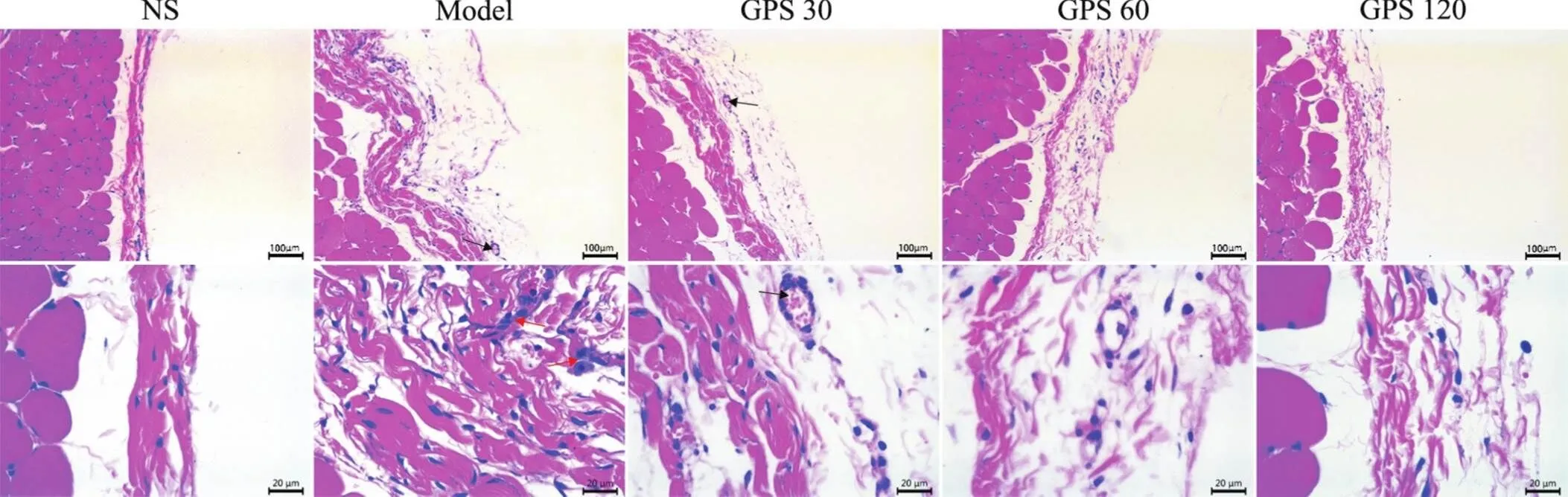
Figure 1. HE staining of peritoneal tissue of the rats in each group. The scale bar=100 μm (upper) or 20 μm (lower). Black arrow: neovascularization; red arrow: inflammatory cell infiltration.
Masson染色可见,NS组大鼠平均腹膜厚度为(26.61±5.02) μm,而model组大鼠平均腹膜厚度为(160.31±15.35) μm,较NS组显著增加(0.01),且纤维增多,结构紊乱;GPS各组腹膜厚度较model组显著降低(0.01),见图2及表3。
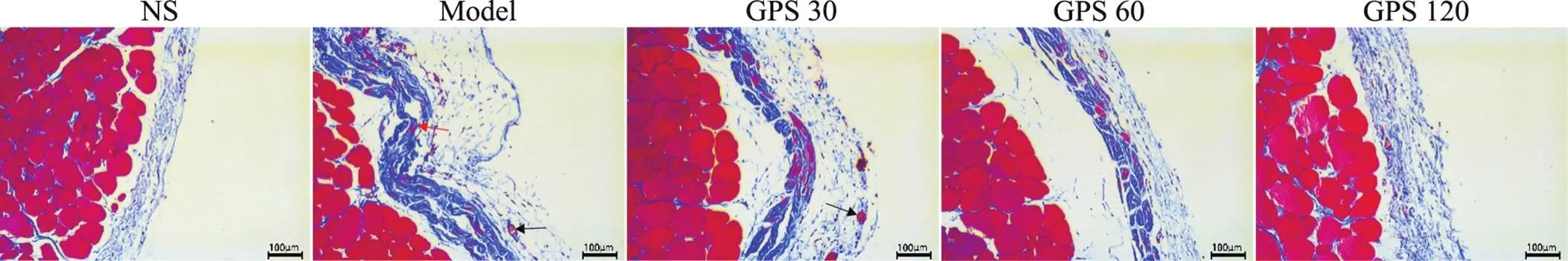
Figure 2. Masson staining of peritoneal tissue of the rats in each group. The scale bar=100 μm. Black arrow: neovascularization; red arrow: loose and disordered arrangement of peritoneal fibers.
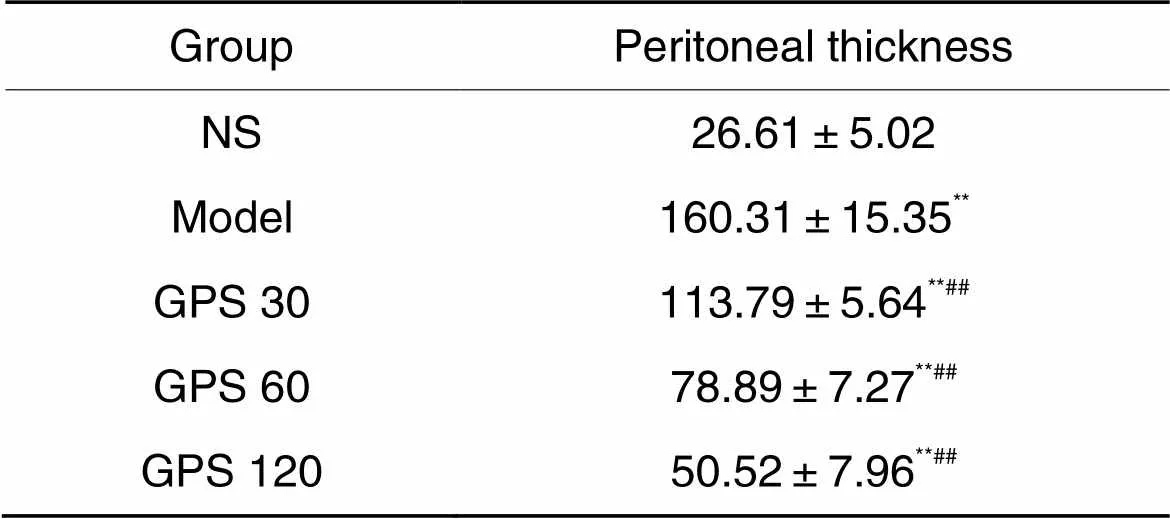
表3 各组大鼠腹膜Masson染色后厚度测量结果
**<0.01NS group;##<0.01model group.
4 大鼠腹膜组织免疫组化染色结果
大鼠正中壁层腹膜组织免疫组化染色结果显示,α-SMA主要表达于腹膜组织中血管的管壁,COL I主要集中于间皮ECM,E-cadherin主要表达在腹膜间皮细胞的细胞膜上。model组在4.25%腹膜透析液刺激与脂多糖诱导下α-SMA和COL I表达水平显著增高,而E-cadherin表达水平则显著下降(0.01),在GPS干预后可见α-SMA和COL I表达水平显著下降(0.01),E-cadherin表达水平显著上升(0.05),见图3。
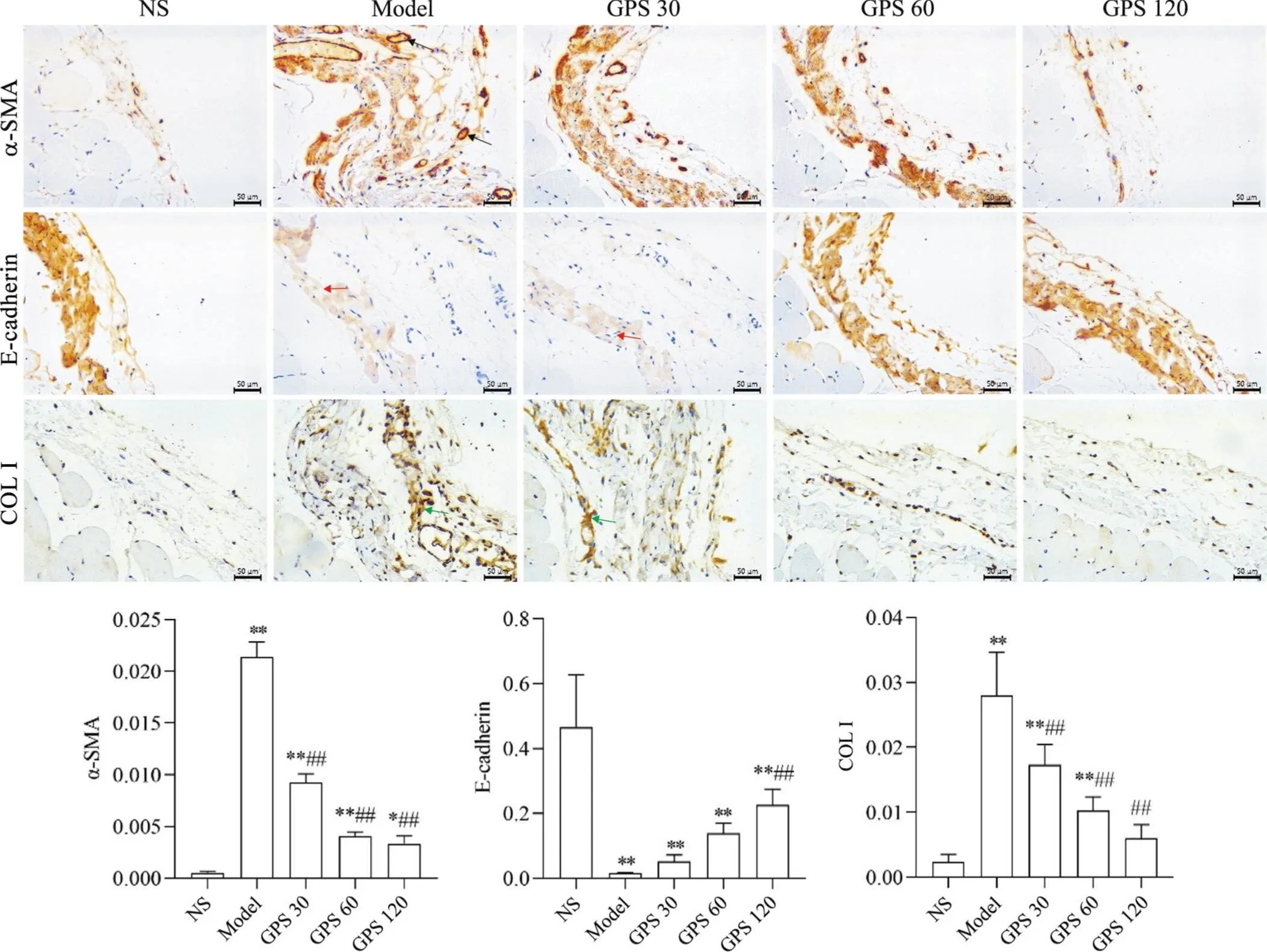
Figure 3. Immunohistochemical staining and semi-quantitative analysis of α-SMA, E-cadherin and COL I in peritoneal tissues of the rats in each group. Black arrow: the expression of α-SMA in the vascular wall of peritoneal tissue is obviously increased; red arrow: the expression of E-cadherin in peritoneal mesothelial cell membrane and intercellular decreased, cells lost connection, and peritoneal structure was destroyed; green arrow: COL I deposition of extracellular matrix in peritoneal mesothelium. Mean±SD. n=6. **P<0.01 vs NS group;#P<0.05,##P<0.01 vs model group.
5 大鼠血清MDA含量及GSH-Px和SOD活性
大鼠血清检测结果显示,NS组中MDA含量较低,model组MDA含量显著增加(0.01),GPS 60和GPS 120组MDA含量相较M组显著减少(0.01),GPS 30组MDA含量同model组比较无显著差异(0.05);NS组中SOD和GSH-Px活性较高,model组SOD和GSH-Px活性显著下降(0.01),GPS 60和GPS 120组GSH-Px和SOD活性均较model组显著上升(0.01),GPS 30组GSH-Px活性较model组显著上升(0.05),而SOD活性同model组比较无显著差异(0.05),见图4。
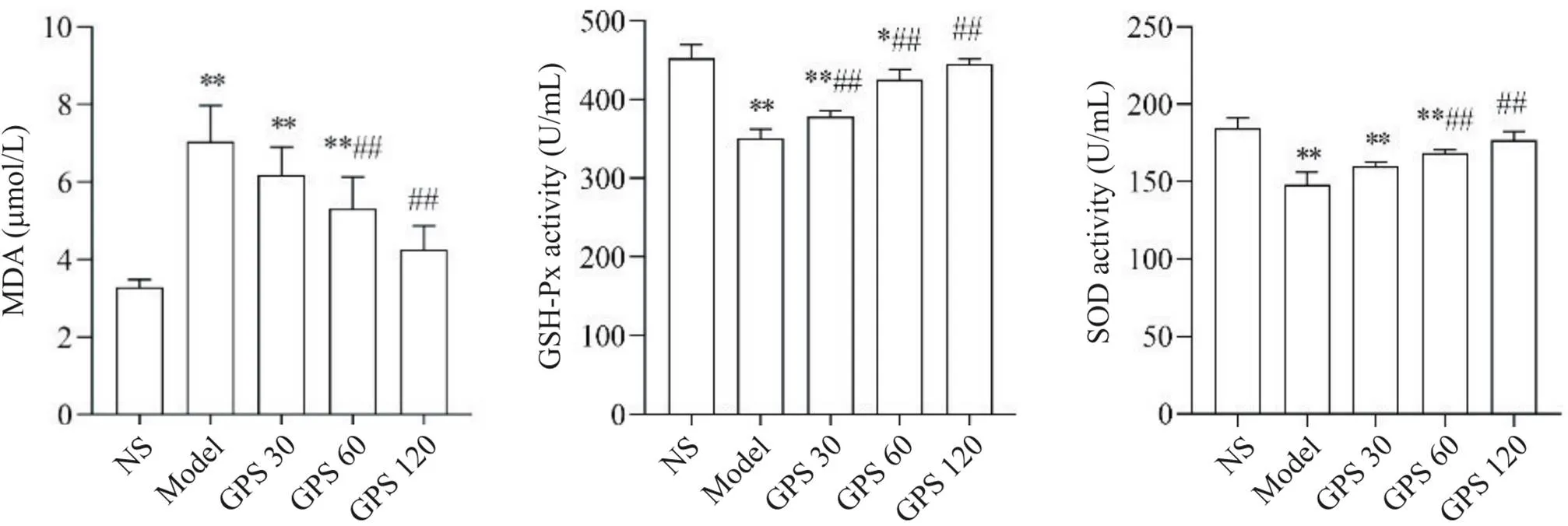
Figure 4. The content of MDA and the activity of GSH-Px and SOD in rat serum. Mean±SD. n=4. *P<0.05,**P<0.01 vs NS group; ##P<0.01 vs model group.
6 大鼠脏层腹膜组织MMT进程相关分子的表达
大鼠脏层腹膜组织Western blot结果显示,使用4.25%腹膜透析液透析后,在MMT发生发展起重要作用的因子TGF-β1及其下游分子Smad3和Smad7表达水平都产生了明显的变化,具体表现为TGF-β1和Smad3表达水平均显著上升(0.01),Smad7表达水平则显著下降(0.01);GPS各组TGF-β1和Smad3表达水平较model组显著下降(0.05),GPS 120组Smad7表达水平较model组显著上升(0.05),GPS 30和GPS 60组Smad7表达水平同model组比较无显著差异(0.05),见图5。
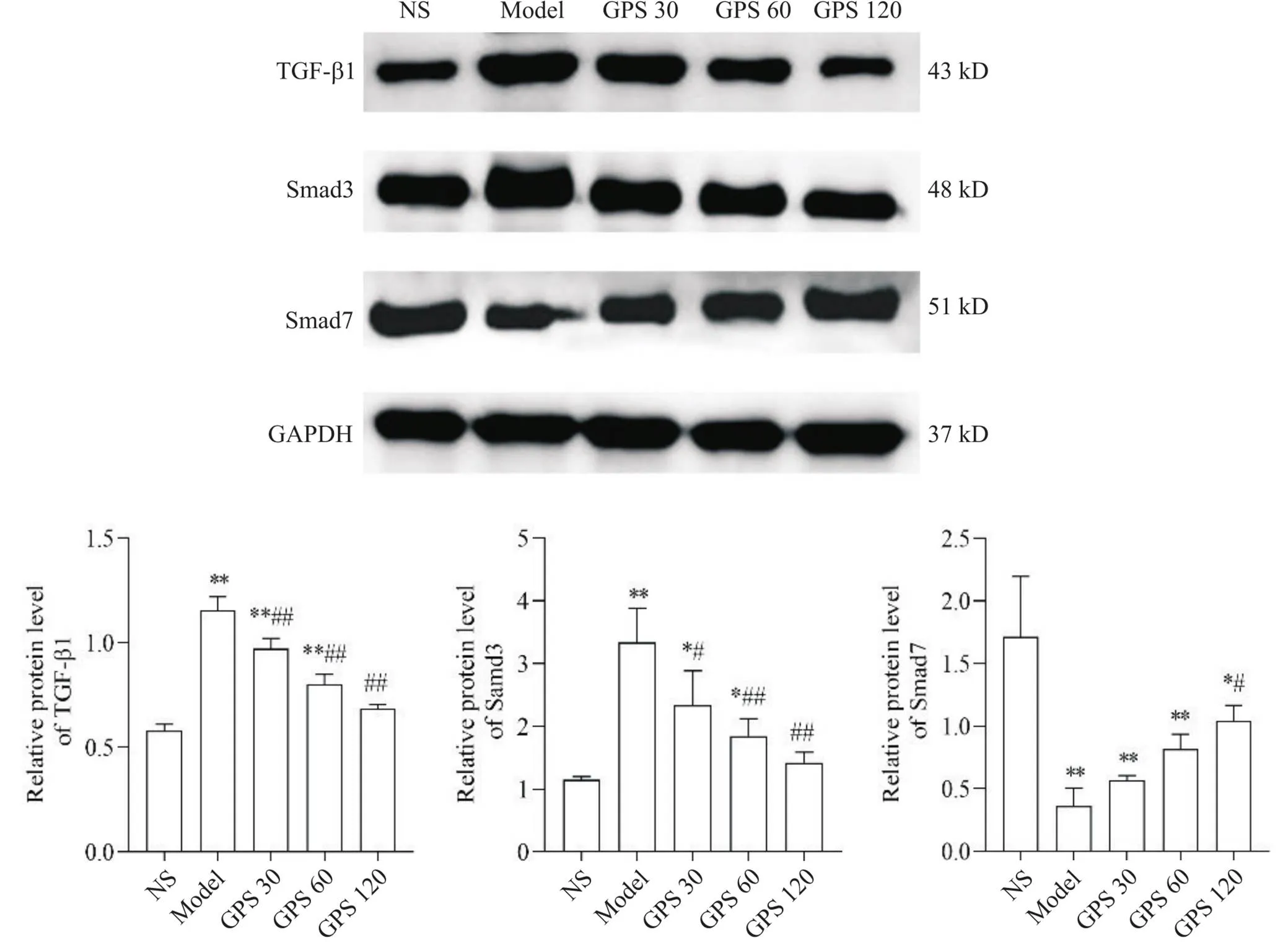
Figure 5. The protein levels of TGF-β1, Smad3 and Smad7 were determined by Western blot. Mean±SD. n=3. *P<0.05,**P<0.01 vs NS group;#P<0.05,##P<0.01 vs model group.
讨论
本实验使用4.25%腹膜透析液联合脂多糖腹腔注射成功建立PF大鼠模型,探究GPS对大鼠PF的作用。结果显示GPS可改善PF大鼠腹膜功能,减轻腹膜病理结构改变,增加抗氧化应激损伤能力。同时从分子生物学层面也表明GPS可减轻大鼠腹膜MMT程度。以上研究表明,GPS可抑制氧化应激反应及腹膜MMT进程,从而减轻高糖腹透液联合脂多糖诱导的大鼠PF损伤。
GPS是一种中药单体,属于裂环环烯醚萜苷类化合物,源自中药龙胆草;大量研究证实GPS在纤维化疾病中有较好的治疗效果[10-11]。有研究表明,GPS可通过调控TLR-4/NF-κB和AMPK/Nrf2信号通路,抑制氧化应激水平和炎症反应,进而改善大鼠肝纤维化损伤[12]。近期有研究显示GPS能够抑制TGF-β1诱导的肺成纤维细胞向肌成纤维细胞分化,进而抑制组织中的胶原生成和基质堆积,从而改善肺部组织维化病变程度[13],但目前尚未见其在PF中有相关研究。
PF以ECM过度沉积和组织结构重塑为主要特征,是导致脏器功能丧失的主要原因之一[14]。由于腹膜透析溶液的组成(高葡萄糖含量、低pH值、渗透压升高、乳酸浓度升高和葡萄糖降解产物)导致氧化应激反应贯穿了PF的全过程,机体内的氧化应激水平可通过MDA含量及GSH-Px和SOD活性来体现。本研究中,GPS各组MDA含量较模型组显著减少,GSH-Px和SOD活性显著上升,说明机体氧化应激反应减轻。MMT被认为发生于PF的早期阶段并在PF中起到了关键性的作用[15],α-SMA、COL I和E-cadherin都是MMT的标志物。TGF-β是MMT发生的关键性因子,TGF-β1通过Smad2和Smad3信号途径促进成纤维细胞转化为肌成纤维细胞以及ECM的沉积,最终形成纤维化病变;而Smads7作为内源性TGF-β拮抗剂,产生抑制TGF-β/Smad信号通路的作用,以延缓纤维化的发展[16-17]。本研究结果显示,GPS各组α-SMA和COL I表达量下降,而E-cadherin表达量上升,同时TGF-β1和Smad3表达水平下降,Smad7表达水平上升,表明TGF-β1通过Smads信号途径诱导成纤维细胞转化为肌成纤维细胞的作用减弱,ECM和胶原沉积减少,MMT进程受到抑制,腹膜的正常结构得以维持。但本研究所建立的PF大鼠模型的腹膜厚度显著高于其他研究中单纯用高糖腹透液所建立的PF大鼠模型的腹膜厚度,但与黄海燕等[18]建立的5/6肾切除尿毒症大鼠模型腹膜纤维化的腹膜厚度接近,其原因可能是脂多糖引起腹腔内明显的炎症,使腹膜组织受到高糖和炎症的双重刺激,以致厚度显著增加。然而,随着腹膜透析插管技术的进步,腹膜透析相关的细菌性腹膜炎的发生率逐年下降,非细菌因素所致的无菌性腹膜透析PF在腹膜透析患者中的发生率正呈上升趋势,因此下一步我们可以尝试构建无菌性腹膜透析PF大鼠模型进一步了解无菌性PF的特征及GPS在这类PF中的治疗效果。
本研究通过4.25%高糖腹膜透析液联合脂多糖建立PF大鼠模型,并从腹膜功能、结构及分子生物学水平系统研究GPS对PF大鼠的保护作用,证明GPS可有效减轻大鼠腹膜纤维化的病变程度,并通过检测机体氧化应激水平及MMT核心分子TGF-β通路相关信号蛋白的表达证实GPS减轻大鼠PF病变程度可能是通过缓解氧化应激反应及MMT而发挥作用。但是本实验对于GPS具体是通过哪些途径调控TGF-β1信号分子及氧化应激水平来治疗腹膜组织的纤维化病变尚不清楚,后续可根据现有实验结果,进一步研究,同时还可探索TGF-β和氧化应激反应介导的纤维化的其他途径,例如磷脂酰肌醇3-激酶、细胞外信号调节激酶和Akt信号转导途径等[16],并可结合细胞学层面的研究以相互佐证。
综上所述,本研究证实GPS可通过抑制慢性氧化应激反应及腹膜MMT进程,从而对高糖腹透液联合脂多糖诱导的腹膜透析大鼠PF具有潜在的治疗作用。
[1] Yang CY, Chau YP, Chen A, et al. Targeting cannabinoid signaling for peritoneal dialysis-induced oxidative stress and fibrosis[J]. World J Nephrol, 2017, 6:111-118.
[2] Liakopoulos V, Roumeliotis S, Gorny X, et al. Oxidative stress in patients undergoing peritoneal dialysis: a current review of the literature[J]. Oxid Med Cell Longev, 2017, 2017:3494867.
[3] Roumeliotis S, Dounousi E, Salmas M, et al. Unfavorable effects of peritoneal dialysis solutions on the peritoneal membrane: the role of oxidative stress[J]. Biomolecules, 2020, 10(5):76-87.
[4] Su WY, Wang HP, Feng ZY, et al. Nitro-oleic acid inhibits the high glucose-induced epithelial-mesenchymal transition in peritoneal mesothelial cells and attenuates peritoneal fibrosis[J]. Am J Physiol Renal Physiol, 2020, 318(2):F457-F467.
[5]武俊紫,杨斌,宋波,等. 龙胆苦苷对非酒精性脂肪肝病大鼠AMPK信号通路的调节作用[J]. 中草药, 2018, 49(21):5142-5148.
Wu JZ, Yang B, Song B, et al. Effect of gentiopicroside on AMPK signaling pathway of rats with non-alcoholic fatty liver disease[J]. Chin Tradit Herb Drugs, 2018, 49(21):5142-5148.
[6] Chen C, Wang Y, Wang Y, et al. Gentiopicroside ameliorates bleomycin-induced pulmonary fibrosis in mice via inhibiting inflammatory and fibrotic process[J]. Biochem Biophys Res Commun, 2018, 495(4):2396-2403.
[7] Yang HX, Shang Y, Jin Q, et al. Gentiopicroside ameliorates the progression from hepatic steatosis to fibrosis induced by chronic alcohol intake[J]. Biomol Ther (Seoul), 2020, 28(4):320-327.
[8] Xiao H, Sun X, Liu R, et al. Gentiopicroside activates the bile acid receptor Gpbar1 (TGR5) to repress NF-κB pathway and ameliorate diabetic nephropathy[J]. Pharmacol Res, 2020, 151:104559.
[9]项协隆,林沁. 腹膜纤维化大鼠模型研究进展[J]. 医学综述, 2010, 16(10):1445-1447.
Xiang XL, Lin Q. Research progress of rat model of peritoneal fibrosis[J]. Med Rev, 2010, 16(10):1445-1447.
[10] 王应霞. 苦胆草对博来霉素致大鼠肺纤维化的防治作用[J]. 昆明医科大学学报, 2016, 37(5):38-41.
Wang YX. Anti-fibrotic effect of Kudancao tablets on bleomycin-induced pulmonary fibrosis in rats[J]. J Kunming Med Univ, 2016, 37(5):38-41.
[11] Yang SQ. Geniposide and gentiopicroside suppress hepatic gluconeogenesis via regulation of AKT-FOXO1 pathway[J]. Arch Med Res, 2018, 49(5):314-322.
[12] 许琼梅,高雅,李梓萌,等. 龙胆苦苷对非酒精性脂肪肝TLR-4/NF-κB和AMPK/Nrf2通路的影响[J]. 天然产物研究与开发, 2020, 32(10):1652-1658.
Xu QM, Gao Y, Li ZM, et al. Effects of gentiopicroside on TLR-4/NF-κB and AMPK/Nrf2 pathways in nonalcoho-lic fatty liver disease[J]. Nat Prod Res Dev, 2020, 32(10):1652-1658.
[13] 王永艳. 龙胆苦苷抗肺纤维化作用研究[D]. 昆明:昆明医科大学, 2019.
Wang YY. Study on the anti-pulmonary fibrosis effect of gentiopicroside[D]. Kunming: Kunming Medical University, 2019.
[14] 任连升,郝建兵,张蕾,等. 醛固酮在腹膜透析大鼠腹膜纤维化中的作用[J]. 中国病理生理杂志, 2015, 31(2):325-330.
Ren LS, Hao JB, Zhang L, et al. The role of aldosterone in peritoneal fibrosis in peritoneal dialysis rats[J]. Chin J Pathophysiol, 2015, 31(2):325-330.
[15] Liu JY. Selenium suppresses lipopolysaccharide-induced fibrosis in peritoneal mesothelial cells through inhibition of epithelial-to-mesenchymal transition[J]. Biol Trace Elem Res, 2014, 161(2):202-209.
[16] Shentu Y. Empagliflozin, a sodium glucose cotransporter-2 inhibitor, ameliorates peritoneal fibrosis via suppressing TGF-β/Smad signaling[J]. Int Immunopharmacol, 2021, 93(10):73-74.
[17] 谭洁,田霞,韩峥,等. miR-29b介导的TGF-β/Smad信号通路对大鼠肝纤维化进程的影响[J]. 中国病理生理杂志, 2019, 35(1):168-173.
Tan J, Tian X, Han Z, et al. Effect of miR-29b-mediated TGF-β/Smad signaling pathway on progression of hepatic fibrosis in rats[J]. Chin J Pathophysiol, 2019, 35(1):168-173.
[18] 黄海燕. 苦参碱通过TGF-β1/Samd3对脂多糖诱导尿毒症大鼠腹膜纤维化的影响[D]. 南宁:广西医科大学, 2019.
Huang HY. Effect of matrine on peritoneal fibrosis induced by lipopolysaccharide in uremic rats through TGF-β1/Samd3[D]. Nanning: Guangxi Medical University, 2019.
Inhibitory effect of gentiopicroside on peritoneal fibrosis in rats and its mechanism
LI Yu-bo1,2, ZHANG Jian3, ZHANG Zai-yuan3, LI Cheng-ming4, LONG Pan5, XIAO Wen-jing6, HU Yong-he1,2△
(1,,646000,;2,,610083,;3,,610031,;4,610075,;5,,610083,;6,,610083,)
To observe the effect of gentiopicroside on oxidative stress and transforming growth factor-β (TGF-β)/Smads signaling pathway in peritoneal fibrosis tissue of rats undergoing peritoneal dialysis, and to explore the mechanism of gentiopicroside in preventing and treating peritoneal fibrosis.The rat model of peritoneal fibrosis was established by 4.25% high glucose peritoneal dialysate (100 mL/kg, once a day)combined with lipopolysaccharide (0.6 mg/kg) injection on the 1st, 3rd, 5th and 7th days. Male SD rats were randomly divided into 5 groups: saline group, model group, and low-, middle- and high-dose (30, 60 and 120 mg/kg) gentiopicroside groups, with 6 rats in each group. Peritoneal function test was performed after 28 d of dialysis, and ultrafiltration volume, initial dialysate/final dialysate glucose ratio, dialysate/plasma urea nitrogen ratio and glucose transport volume were measured. The parietal peritoneum was taken for peritoneal pathomorphological observation, and peritoneal thickness was calculated. The blood of abdominal aorta was taken for detecting serum levels of malondialdehyde (MDA), superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px). The expression of α-smooth muscle actin (α-SMA), E-cadherin and collagen type I (COL I) in peritoneal tissues was detected by immunohistochemistry. Western blot was used to detect the expression of TGF-β1, Smad3 and Smad7 in peritoneal tissues.After 28 d of dialysis, the peritoneal function of the rat model of peritoneal fibrosis was significantly decreased (0.05), while the peritoneal thickness, inflammatory cell infiltration, fibrous cells and vascular proliferation were significantly increased. The serum MDA increased significantly, while SOD and GSH-Px decreased significantly (0.01). Immunohistochemistry showed that the protein expression of α-SMA and COL I increased significantly, while the protein expression of E-cadherin decreased significantly (0.01). Western blot showed that the expression of TGF-β1 protein and Smad3 protein increased significantly, while the expression of Smad7 protein decreased significantly (0.01). Gentiopicroside reduced the level of oxidative stress and the protein expression of TGF-β1 and Smad3, but increased the protein expression of Smad7 in a dose-dependent manner.Gentiopicroside attenuates peritoneal fibrosis in rats, and its mechanism is involved in the inhibition of oxidative stress and the process of peritoneal mesothelial-mesenchymal transition.
Gentiopicroside; Peritoneal fibrosis; Oxidative stress; Mesothelial-mesenchymal transition
R285.5; R363.2
A
10.3969/j.issn.1000-4718.2022.06.015
1000-4718(2022)06-1075-08
2021-11-20
2022-01-14
四川省科技厅项目(No. 2019YFS0542)
Tel: 0028-86570206; E-mail: huyonghezyy@163.com
(责任编辑:余小慧,李淑媛)

