毓麟珠对卵巢早衰大鼠SIRT1-FoxO1-自噬通路的调控作用*
何啸兰, 王鹍鹏, 周月希, 吴尚蓉, 胡雅君△
毓麟珠对卵巢早衰大鼠SIRT1-FoxO1-自噬通路的调控作用*
何啸兰1, 王鹍鹏2, 周月希1, 吴尚蓉1, 胡雅君1△
(1武汉市中西医结合医院生殖医学科,湖北 武汉 430030;2武汉市中医医院,湖北 武汉 430030)
探讨毓麟珠对卵巢早衰(POF)大鼠自噬的影响,并分析其防治POF的作用机制。雌性SD大鼠采用随机数字表法选取16只为正常组,其余大鼠通过腹腔注射环磷酰胺建立POF模型。造模成功大鼠分为POF组、戊酸雌二醇(0.09 mg/kg)组(简称雌二醇组)、低剂量(7.56 g/kg)毓麟珠组、高剂量(15.12 g/kg)毓麟珠组和毓麟珠+沉默信息调节因子1(SIRT1)抑制剂EX527组(简称毓麟珠+EX527组),每组16只。低、高剂量毓麟珠组大鼠分别灌胃相应剂量的毓麟珠药液,雌二醇组大鼠给予戊酸雌二醇溶液灌胃,毓麟珠+EX527组大鼠在给予15.12 g/kg毓麟珠药液灌胃的同时腹腔注射10 mg/kg EX527,正常组和POF组大鼠给予等体积的生理盐水干预,每天1次,连续给药3周。给药结束后,记录各组大鼠的双侧卵巢重量和体重,计算卵巢指数;ELISA检测各组大鼠血清雌二醇(E2)、促卵泡激素(FSH)和抗缪勒管激素(AMH)水平;检测各组大鼠卵巢组织丙二醛(MDA)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)水平;苏木精-伊红(HE)染色和TUNEL染色观察各组大鼠卵巢组织病理变化,计数各级卵泡数,并分析窦卵泡中颗粒细胞凋亡水平;免疫组织化学法检测各组大鼠卵巢组织微管相关蛋白1轻链3B(LC3B)蛋白表达;RT-qPCR检测各组大鼠卵巢组织LC3B、p62、beclin-1、Atg5和Atg7的mRNA表达;Western blot检测各组大鼠卵巢组织LC3A/B、p62、beclin-1、Atg5、Atg7、SIRT1、叉头框蛋白O1(FoxO1)和乙酰化FoxO1(Ac-FoxO1)的蛋白水平;评估POF大鼠的生育能力。与正常组相比,POF组大鼠卵巢指数,血清E2和AMH水平,卵巢组织SOD和CAT活性,卵巢原始卵泡、初级卵泡、次级卵泡和窦卵泡数量,p62 mRNA和蛋白水平,SIRT1和FoxO1蛋白水平,以及受孕率和胚胎数均显著降低,而血清FSH水平,卵巢组织MDA水平,闭锁卵泡数量,颗粒细胞凋亡水平,卵巢LC3B蛋白阳性表达,LC3B、beclin-1、Atg5和Atg7 mRNA水平,beclin-1、Atg5、Atg7和Ac-FoxO1蛋白水平,以及LC3-II/LC3-I比值均显著升高(<0.05);与POF组相比,高剂量毓麟珠组和雌二醇组大鼠卵巢指数,血清E2和AMH水平,卵巢组织SOD和CAT活性,卵巢原始卵泡、初级卵泡、次级卵泡和窦卵泡数量,p62 mRNA和蛋白水平,SIRT1和FoxO1蛋白水平,以及受孕率和胚胎数均显著升高,而血清FSH水平,卵巢组织MDA水平,闭锁卵泡数量,颗粒细胞凋亡水平,卵巢LC3B蛋白阳性表达,LC3B、beclin-1、Atg5和Atg7 mRNA水平,beclin-1、Atg5、Atg7和Ac-FoxO1蛋白水平,以及LC3-II/LC3-I比值均显著降低(<0.05);EX527可显著减弱毓麟珠对POF大鼠卵巢功能的保护作用。毓麟珠可能通过激活SIRT1-FoxO1通路抑制氧化应激及细胞自噬,从而改善POF大鼠卵巢功能。
毓麟珠;卵巢早衰;氧化应激;自噬;SIRT1-FoxO1信号通路
卵巢早衰(premature ovarian failure, POF)是一种由多种因素共同引起的内分泌改变疾病,通常用于描述40岁以下的女性,其基本表现是闭经、促性腺激素高、雌激素低和不孕;发病率逐渐上升,对女性的身心健康有严重影响[1-2]。目前POF的治疗方法有激素替代疗法、促排卵疗法、卵巢移植、免疫疗法、促排卵疗法等。其中,治疗效果好的雌激素类药物作为常用药物,副作用大,停药后复发率高,易致癌,不适合作为长期治疗方法[3]。大量研究表明,中药治疗POF,疗效确切,安全性高,且费用低[4],近年来逐渐成为研究热点。毓麟珠见于《景岳全书·妇人规》,为应用较多的调经方之一。已有研究显示毓麟珠联合激素治疗可以改善脾肾阳虚型POF患者症状,改善卵巢功能[5];并可以通过调节哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路,促进卵泡发育,改善早发性卵巢功能不全小鼠卵巢功能[6]。但毓麟珠防治POF的作用机制尚不明确,需要进一步探索。
作为细胞降解过程,自噬吞噬受损的细胞器和功能失调的细胞质以维持细胞功能,在卵巢功能中发挥关键作用[7-8]。自噬受多种信号通路调控,其中沉默信息调节因子1(silence information regulator 1, SIRT1)/叉头框蛋白O1(forkhead box protein O1, FoxO1)通路是调节细胞自噬的主要通路之一。FoxO1调节许多自噬相关蛋白的表达,如微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3, LC3)、自噬相关蛋白5(autophagy-related protein 5, Atg5)和beclin-1,与自噬密切相关[9]。SIRT1是一类NAD+依赖型脱乙酰酶,通过使FoxO1去乙酰化在细胞自噬中具有重要作用[10]。据报道,激活SIRT1/FoxO1通路可抑制自噬[11],且SIRT1/FoxO1通路的激活可抑制氧化应激,改善自然衰老过程中的卵巢功能[12]。此外,多项研究证实SIRT1-FoxO-自噬通路通过调节氧化应激,参与对衰老的调节[13-14]。而毓麟珠对POF的保护机制是否与SIRT1/FoxO1通路介导的自噬有关,还未见相关报道。因此,本研究通过观察毓麟珠对POF模型大鼠自噬的影响,探讨其防治POF的相关机制。
材料和方法
1 动物
160只SPF级雌性SD大鼠,9~10周龄,体重(220±20) g,购自湖北省实验动物研究中心,动物证号为SCXK(鄂)2015-0018。所有动物均可自由获得充足的食物和水,在实验前对其进行1周的适应性喂养。饲养条件:温度20~24 ℃,湿度40%~60%。本研究经医院动物伦理委员会批准。
2 主要药物、试剂及仪器
毓麟珠的成分为:当归12 g,熟地黄12 g,菟丝子12 g,人参6 g,麸炒白术6 g,茯苓6 g,白芍6 g,杜仲6 g,鹿角霜6 g,花椒6 g,川芎3 g,炙甘草3 g。上述中药饮片均从北京同仁堂科技股份有限公司购入,按常规方法煎煮,浓缩至每mL含原药材2 g,4 ℃冰箱保存备用。
戊酸雌二醇片(Delpharm Lille SAS);环磷酰胺(Sigma-Aldrich);EX527(SIRT1抑制剂)和TUNEL细胞凋亡检测试剂盒(绿色荧光)购自碧云天生物科技公司;大鼠抗缪勒管激素(anti-Müllerian hormone, AMH)、雌二醇(estradiol, E2)和促卵泡激素(follicle-stimulating hormone, FSH)ELISA试剂盒(上海酶联生物科技有限公司);丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)检测试剂盒(南京建成生物工程研究所);苏木素-伊红(HE)染色试剂盒(Solarbio,G1120);兔源SIRT1、FoxO1和β-actin抗体(Cell Signaling Technology);乙酰化FoxO1(acetylated FoxO1, Ac-FoxO1)抗体(ABclonal);LC3B抗体(Abcam)。iMark680多功能酶标仪(Bio-Rad);ABI Prism®7500型荧光定量PCR仪(ABI);BX61电动显微镜(Olympus)。
3 主要方法
3.1建模和分组在适应性喂养1周后,每只大鼠的发情周期通过阴道涂片观察7 d。筛选具有正常发情周期的大鼠进行实验。根据随机数字表法随机抽取26只大鼠作为正常(normal)组,其余134只大鼠用于造模,第1天腹腔注射环磷酰胺50 mg/kg,然后以8 mg/kg的剂量连续注射14 d以建立POF模型[15]。造模过程中,每天固定时间对大鼠进行阴道涂片,在显微镜下观察其异位周期变化。阴道上皮无动情周期变化或动情周期明显延长,表明POF大鼠建模成功。15 d后,将130只造模成功的雌性大鼠随机分为POF组、戊酸雌二醇组(简称雌二醇组)、低剂量毓麟珠(low-dose Yulinzhu)组、高剂量毓麟珠(high-dose Yulinzhu)组和毓麟珠+SIRT1抑制剂EX527组(简称毓麟珠+EX527组),每组26只。
3.2给药分组完成后开始给药,低、高剂量毓麟珠组大鼠分别灌胃7.56和15.12 g/kg的毓麟珠药液,雌二醇组大鼠给予0.09 mg/kg的戊酸雌二醇溶液灌胃,毓麟珠+EX527组大鼠在给予15.12 g/kg毓麟珠药液灌胃的同时,腹腔注射10 mg/kg EX527[16],正常组和POF组大鼠给予等体积的生理盐水灌胃和腹腔注射。灌胃体积为10 mL/kg,每天1次,连续给药3周。剂量换算:药物的等效剂量根据人和动物的体表面积计算,其中大鼠的日剂量相当于成人的6.3倍。成人平均体质量按70 kg换算,毓麟珠成人每日给药剂量相当于生药84 g,则大鼠每日给药剂量为84 g/70 kg×6.3=7.56 g/kg,因此设置低、高剂量药物剂量为7.56和15.12 g/kg。戊酸雌二醇片,按每人每天1 mg,根据大鼠与人的体表面积进行换算,所以大鼠灌胃剂量为1 mg/70 kg×6.3=0.09 mg/kg。
3.3样本收集给药结束后,每组随机选取10只大鼠进行生育能力评估;从每组剩余大鼠身上进行取材。首先,大鼠称重,通过腹腔注射2%戊巴比妥钠(1.5 mL/kg)麻醉,切开腹部皮肤,充分暴露腹腔,钝性解剖后从腹主动脉采血。其次,取出卵巢并称重,然后每组随机选取6只大鼠的卵巢组织,研磨匀浆,制备10%组织匀浆液;每组剩余10只大鼠,将左侧卵巢组织液氮速冻并储存在-80 ℃以备进一步分析,右侧卵巢组织固定在4%多聚甲醛中,制备石蜡切片。
3.4卵巢指数记录大鼠的双侧卵巢重量和体重,卵巢指数计算为卵巢重量/体重。
3.5血清E2、FSH和AMH水平测定通过腹主动脉采血从大鼠模型中获取血液样本,静置后在4 ℃下,以3 000×离心10 min,取上清保存于-20 ℃冰箱。按照ELISA试剂盒说明书操作检测血清E2、FSH和AMH的水平。
3.6卵巢组织MDA、SOD和CAT水平测定将称重的卵巢组织,按照1∶9的比例加入预冷的生理盐水,匀浆,匀浆后取上清液,按照试剂盒的说明检测卵巢组织MDA含量及SOD和CAT活性。
3.7HE染色和卵泡计数卵巢组织用4%多聚甲醛固定24 h,脱水。随后,将组织包埋在石蜡中并切成5 µm厚的切片,放置在载玻片上。用苏木精和伊红染色,拍照,在光学显微镜下分析卵巢组织形态学变化并分类测定各级卵泡数[17]。原始卵泡:卵母细胞周围仅含有单层纺锤形颗粒细胞,体积小;初级卵泡:体积变大,卵母细胞周围出现5~6层柱状颗粒细胞;次级卵泡:卵泡体积更大,颗粒细胞增至6~12层;窦卵泡:至少有两层带卵泡腔的颗粒细胞,闭锁卵泡:发育不成熟的卵泡出现退化,卵母细胞形态异常,甚至卵泡中没有卵母细胞。
3.8TUNEL染色取卵巢组织石蜡切片,经脱蜡、水化后与蛋白酶K在37 ℃下孵育25 min。然后,用3% H2O2溶液灭活内源性过氧化物酶10 min;加入TdT和dUTP酶反应混合物覆盖样品,在37 ℃下避光孵育2 h。随后,将细胞核用DAPI避光染色10 min。抗荧光淬灭剂封片,用荧光显微镜观察切片,卵巢中的凋亡细胞被染成绿色,细胞核呈蓝色。每张切片检测了5个随机视野(每只大鼠3个切片,每组10只大鼠),总共检查了每组150个随机视野(5×3×10=150)。在每个随机视野,计数窦卵泡中TUNEL阳性颗粒细胞和总颗粒细胞。通过Image-Pro Plus 6.0软件分析窦卵泡中TUNEL阳性颗粒细胞的百分比(%),以此表示颗粒细胞凋亡水平。
3.9免疫组织化学法检测卵巢组织LC3B蛋白表达组织切片后经脱蜡、水化、微波修复抗原后,用3%过氧化氢孵育10 min以灭活内源性过氧化物酶,5%牛血清白蛋白封闭后,滴加兔源Ⅰ抗LC3B(1∶200),4 ℃过夜,加Ⅱ抗(1∶100)室温孵育20 min,DAB显色,苏木素复染,透明、封片。光学显微镜下观察LC3B阳性表达并拍照,采用Image-Pro Plus 6.0软件分析LC3B阳性区域的平均积分吸光度()。
3.10RT-qPCR检测卵巢组织LC3B、p62、beclin-1、Atg5和Atg7的mRNA表达使用Trizol试剂从卵巢组织中提取总RNA。然后从分离的RNA样品中合成互补DNA(cDNA)。使用荧光定量PCR试剂盒和ABI 7500荧光定量PCR系统进行RT-qPCR,评估目的基因的相对mRNA表达水平。所有程序均按照制造商的说明进行。反应条件为:95℃ 10 min; 95 ℃ 15 s,60 ℃ 1 min,75 ℃ 20 s,40个循环。以β-actin为内参照,使用2-ΔΔCt法分析mRNA表达的相对倍数变化。每个样品的分析重复3次。

表1 RT-qPCR引物序列
3.11Western blot检测卵巢组织LC3A/B、p62、beclin-1、Atg5、Atg7、SIRT1、FoxO1和Ac-FoxO1蛋白表达卵巢组织样品中的蛋白质通过RIPA裂解液提取。使用分光光度计测定蛋白浓度。通过10% SDS-PAGE分离每个样品的等量总蛋白(30 μg),电泳后,将蛋白质转移到聚偏二氟乙烯(PVDF)膜上。随后将膜在室温下用5%脱脂牛奶封闭1 h,然后与Ⅰ抗LC3A/B、p62、beclin-1、Atg5、Atg7、FoxO1(1∶1000)、SIRT1(1∶1 000)、Ac-FoxO1(1∶500)和GAPDH(1∶2 000)在4℃下孵育过夜。然后与辣根过氧化物酶(HRP)偶联的山羊抗兔Ⅱ抗(1∶3 000)在室温下孵育1 h。使用增强型化学发光试剂(ECL)显影。以GAPDH为内参照,通过与内参的灰度比,得出目的条带的相对表达水平。LC3A/B抗体用于检测LC3-II/LC3-I比值。
3.12评估POF大鼠的生育能力进行生育力评估以确认毓麟珠对POF大鼠生育力的潜在影响。在毓麟珠给药3周后,每组10只大鼠分别与具有生育能力的正常雄性大鼠(12周龄)以1∶1的比例配对,动物在下午5点同笼,并在第2天上午9点左右进行阴道涂片检查,以确保1周内交配成功。成功交配的动物不再同居。两周后,用戊巴比妥(50 mg/kg,腹腔注射)麻醉大鼠,颈椎脱臼处死。取出子宫,计数每窝幼仔数(胚胎数)。
4 统计学处理
数据采用GraphPad Prism 8.0软件进行统计分析,以平均值±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间有差异进一步采用SNK-检验进行两两比较。以<0.05为差异有统计学意义。
结果
1 毓麟珠对POF大鼠卵巢指数的影响
与正常组相比,POF组大鼠卵巢指数显著降低(<0.05);与POF组相比,高剂量毓麟珠组和雌二醇组大鼠卵巢指数显著升高(<0.05);与高剂量毓麟珠组相比,雌二醇组大鼠卵巢指数差异无统计学意义(>0.05),毓麟珠+EX527组大鼠卵巢指数显著降低(<0.05),见图1A。
2 毓麟珠对POF大鼠血清E2、FSH和AMH水平的影响
与正常组相比,POF组大鼠血清E2和AMH水平显著降低(<0.05),FSH水平显著升高(<0.05);与POF组相比,高剂量毓麟珠组和雌二醇组大鼠血清E2和AMH水平显著升高(<0.05),FSH水平显著降低(<0.05);与高剂量毓麟珠组相比,雌二醇组上述指标差异无统计学意义(>0.05),毓麟珠+EX527组大鼠血清E2和AMH水平显著降低(<0.05),FSH水平显著升高(<0.05),见图1B~D。

Figure 1. Comparison of ovarian index (A) and serum E2(B), FSH (C) and AMH (D) levels of rats in each group. Mean±SD. n=16. *P<0.05 vs normal group;#P<0.05 vs POF group;&P<0.05 vs estradiol group;△P<0.05 vs high-dose Yulinzhu group.
3 毓麟珠对POF大鼠卵巢组织MDA含量及SOD和CAT活性的影响
与正常组相比,POF组大鼠卵巢组织MDA含量显著升高(<0.05),SOD和CAT活性显著降低(<0.05);与POF组相比,高剂量毓麟珠组和雌二醇组大鼠卵巢组织MDA含量显著降低(<0.05),SOD和CAT活性显著升高(<0.05);与高剂量毓麟珠组相比,雌二醇组上述指标差异无统计学意义(>0.05),毓麟珠+EX527组大鼠卵巢组织MDA含量显著升高(<0.05),SOD和CAT活性显著降低(<0.05),见图2。

Figure 2. Comparison of MDA level (A), and SOD (B) and CAT activity (C) in ovarian tissue of rats in each group. Mean±SD.n=6. *P<0.05 vs normal group;#P<0.05 vs POF group;&P<0.05 vs estradiol group;△P<0.05 vs high-dose Yulinzhu group.
4 毓麟珠对POF大鼠卵巢形态及组织病理的影响
肉眼观察可见,正常组卵巢外观正常,呈红色,表面有数个白色凸起点;与正常组相比,POF组大鼠的卵巢形态出现一定程度的萎缩,卵巢呈淡白色,表面凸起的斑点较少;与POF组相比,低、高剂量毓麟珠组和雌二醇组卵巢形态明显恢复,接近正常,表面凸起点较多,且高剂量毓麟珠组与雌二醇组改善相似;与高剂量毓麟珠组相比,毓麟珠+EX527组大鼠卵巢体积缩小,呈淡白色,表面凸起的斑点减少。
HE染色结果显示,正常组有不同发育阶段的卵泡和黄体,与正常组相比,POF组各期卵泡空泡样变化明显,排列松散,卵泡闭锁增多(<0.05),间质纤维化,血管充血,卵巢原始卵泡、初级卵泡、次级卵泡和窦卵泡显著减少(<0.05);与POF组相比,低、高剂量毓麟珠组和雌二醇组卵母细胞形态明显改善,卵巢原始卵泡、初级卵泡、次级卵泡和窦卵泡显著增多(<0.05),闭锁卵泡数量显著下降(<0.05),高剂量毓麟珠组闭锁卵泡数量减少幅度低于雌二醇组,但差异无统计学意义(>0.05);与高剂量毓麟珠组相比,毓麟珠+EX527组原始卵泡、初级卵泡、次级卵泡和窦卵泡数量显著降低(<0.05),闭锁卵泡数量显著升高(<0.05),见图3、4。

Figure 3. HE staining of rat ovarian tissues in each group. A: normal group, follicles and corpus luteum with different developmental stages; B: POF group, the follicles showed obvious vacuolar-like changes, loose arrangement, and increased follicular atresia; C: estradiol group, the morphological changes of oocytes were significantly improved, and the numbers of primordial follicles, primary follicles, secondary follicles and antral follicles increased significantly; D: low-dose Yulinzhu group, the morphological changes of oocytes were significantly improved, and the numbers of primordial follicles, primary follicles, secondary follicles and antral follicles increased significantly; E: high-dose Yulinzhu group, the morphological changes of oocytes were significantly improved, and the numbers of primordial follicles, primary follicles, secondary follicles and antral follicles increased significantly; F: Yulinzhu+EX527 group, the numbers of primordial follicles, primary follicles, secondary follicles and antral follicles decreased, and the number of atretic follicles increased. The scale bar=80 μm (upper) or 10 μm (lower).
4 毓麟珠对POF大鼠卵巢颗粒细胞凋亡的影响
与正常组相比,POF组大鼠窦卵泡中颗粒细胞凋亡水平显著升高(<0.05);与POF组相比,低、高剂量毓麟珠组和雌二醇组颗粒细胞凋亡水平显著降低(<0.05);与高剂量毓麟珠组相比,雌二醇组颗粒细胞凋亡水平差异无统计学意义(>0.05),毓麟珠+EX527组颗粒细胞凋亡水平显著升高(<0.05),见图5、6A。
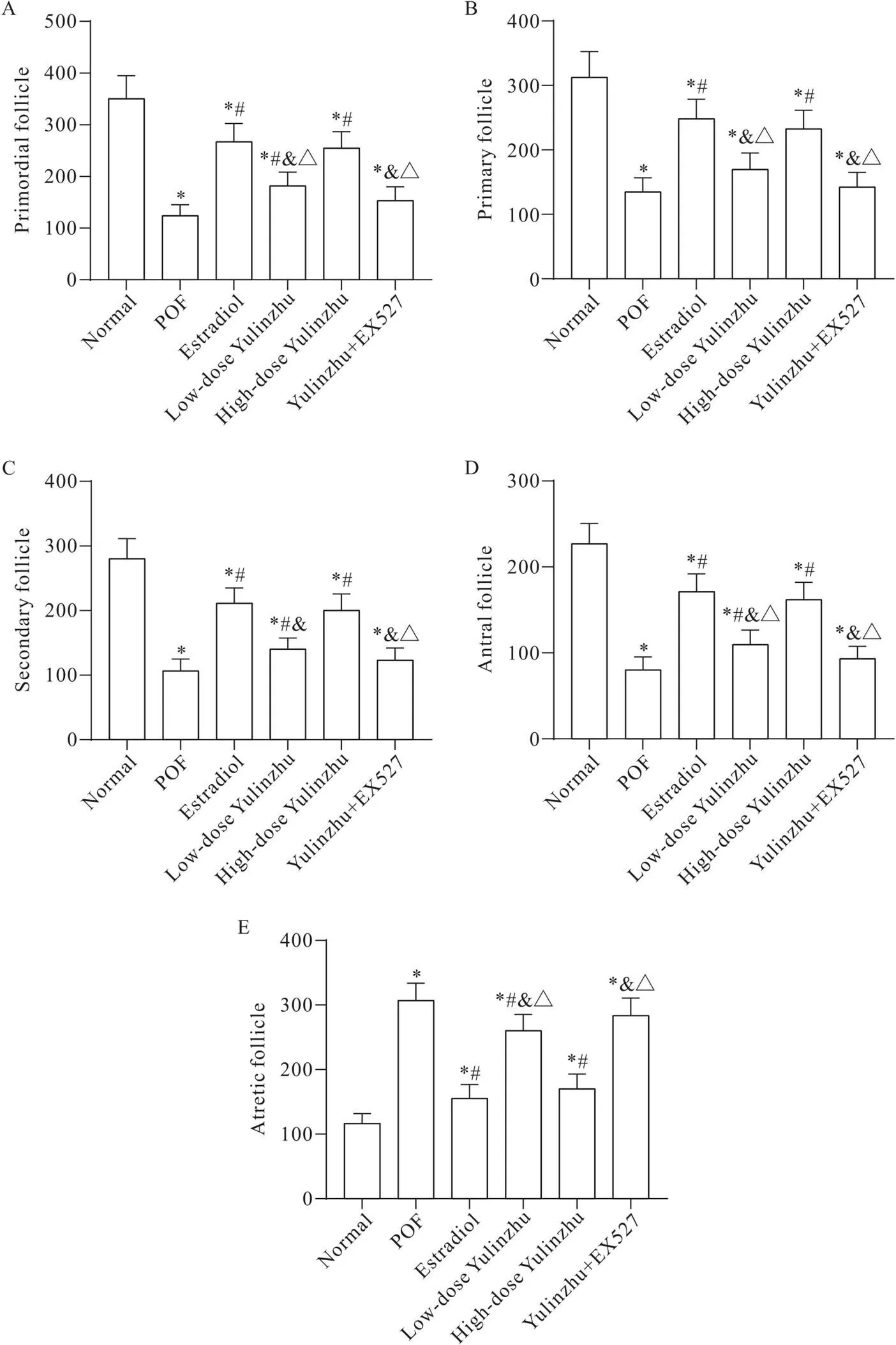
Figure 4. Changes in the numbers of follicles at all levels in the ovary of rats in each group. Mean±SD. n=10. *P<0.05 vs normal group;#P<0.05 vs POF group;&P<0.05 vs estradiol group;△P<0.05 vs high-dose Yulinzhu group.

Figure 5. TUNEL staining of rat ovarian tissues in each group. A: normal group; B: POF group; C: estradiol group; D: low-dose Yulinzhu group; E: high-dose Yulinzhu group; F: Yulinzhu+EX527 group. The scale bar=40 μm.

Figure 6. Comparison of the level of apoptosis (A) and the positive expression of LC3B protein (B) in ovarian tissues of rats in each group. Mean±SD. n=10. *P<0.05 vs normal group;#P<0.05 vs POF group;&P<0.05 vs estradiol group;△P<0.05 vs high-dose Yulinzhu group.
5 毓麟珠对POF大鼠卵巢LC3B蛋白表达的影响
与正常组相比,POF组大鼠卵巢LC3B蛋白阳性表达显著升高(<0.05);与POF组相比,低、高剂量毓麟珠组和雌二醇组大鼠卵巢LC3B蛋白阳性表达显著降低(<0.05);与高剂量毓麟珠组相比,雌二醇组卵巢LC3B蛋白阳性表达差异无统计学意义(>0.05),毓麟珠+EX527组大鼠卵巢LC3B蛋白阳性表达显著升高(<0.05),见图6B、7。

Figure 7. Immunohistochemical staining of LC3B in rat ovarian tissues in each group. A: normal group; B:POF group; C: estradiol group; D: low-dose Yulinzhu group; E: high-dose Yulinzhu group; F: Yulinzhu+EX527 group. The scale bar=20 μm.
6 毓麟珠对POF大鼠卵巢组织LC3B、p62、beclin-1、Atg5和Atg7 mRNA水平的影响
与正常组相比,POF组大鼠卵巢组织LC3B、beclin-1、Atg5和Atg7 mRNA水平均显著升高(<0.05),p62 mRNA水平显著降低(<0.05);与POF组相比,低、高剂量毓麟珠组和雌二醇组大鼠卵巢组织LC3B、beclin-1、Atg5和Atg7 mRNA水平均显著降低(<0.05),p62 mRNA水平显著升高(<0.05);与高剂量毓麟珠组相比,雌二醇组大鼠卵巢组织上述mRNA水平差异无统计学意义(>0.05),毓麟珠+EX527组大鼠卵巢组织LC3B、beclin-1、Atg5和Atg7 mRNA水平均显著升高(<0.05),p62 mRNA水平显著降低(<0.05),见图8。

Figure 8. The mRNA levels of LC3B (A), p62 (B), beclin-1 (C), Atg5 (D) and Atg7 (E) in ovarian tissues of rats in each group. Mean±SD. n=6. *P<0.05 vs normal group;#P<0.05 vs POF group;&P<0.05 vs estradiol group;△P<0.05 vs high-dose Yulinzhu group.
7 毓麟珠对POF大鼠卵巢组织LC3、p62、beclin-1、Atg5和Atg7蛋白水平的影响
与正常组相比,POF组大鼠卵巢组织LC3-II/LC3-I比值及beclin-1、Atg5和Atg7蛋白水平均显著升高(<0.05),p62蛋白水平显著降低(<0.05);与POF组相比,低、高剂量毓麟珠组和雌二醇组大鼠卵巢组织LC3-II/LC3-I比值及beclin-1、Atg5和Atg7蛋白水平均显著降低(<0.05),p62蛋白水平显著升高(<0.05);与高剂量毓麟珠组相比,雌二醇组大鼠卵巢组织上述蛋白水平差异无统计学意义(>0.05),毓麟珠+EX527组大鼠卵巢组织LC3II/LC3I比值及beclin-1、Atg5和Atg7蛋白水平均显著升高(<0.05),p62蛋白水平显著降低(<0.05),见图9。

Figure 9. Protein levels of LC3-I, LC3-II, p62, beclin-1, Atg5 and Atg7 in ovarian tissues of rats in each group. Mean±SD. n=10. *P<0.05 vs normal group;#P<0.05 vs POF group;&P<0.05 vs estradiol group;△P<0.05 vs high-dose Yulinzhu group.
8 毓麟珠对POF大鼠卵巢组织SIRT1、FoxO1和Ac-FoxO1蛋白水平的影响
与正常组相比,POF组大鼠卵巢组织SIRT1和FoxO1蛋白水平均显著降低(<0.05),Ac-FoxO1蛋白水平显著升高(<0.05);与POF组相比,低、高剂量毓麟珠组和雌二醇组大鼠卵巢组织SIRT1和FoxO1蛋白水平均显著升高(<0.05),Ac-FoxO1蛋白水平显著降低(<0.05);与高剂量毓麟珠组相比,雌二醇组大鼠卵巢组织上述蛋白水平差异无统计学意义(>0.05),毓麟珠+EX527组大鼠卵巢组织SIRT1和FoxO1蛋白水平均显著降低(<0.05),Ac-FoxO1蛋白水平显著升高(<0.05),见图10。

Figure 10. Protein levels of SIRT1, FoxO1 and Ac-FoxO1 in ovarian tissues of rats in each group. Mean±SD. n=10. *P<0.05 vs normal group;#P<0.05 vs POF group;&P<0.05 vs estradiol group;△P<0.05 vs high-dose Yulinzhu group.
9 毓麟珠对POF大鼠生育能力的影响
正常组大鼠均妊娠,受孕率为100%;与正常组相比,POF组大鼠的受孕率(40%)和胚胎数均显著降低(<0.05);与POF组相比,低、高剂量毓麟珠组和雌二醇组大鼠的受孕率(60%和80%)和胚胎数均显著升高(<0.05);与高剂量毓麟珠组相比,雌二醇组大鼠的受孕率(80%)和胚胎数差异均无统计学意义(>0.05),毓麟珠+EX527组大鼠的受孕率(50%)和胚胎数均显著降低(<0.05),见图11。

Figure 11. The number of embryos of rats in each group. Mean±SD. n=10. *P<0.05 vs normal group;#P<0.05 vs POF group;&P<0.05 vs estradiol group;△P<0.05 vs high-dose Yulinzhu group.
讨论
氧化应激是诱发卵巢衰老的重要影响因素之一。研究表明,氧化应激可以激活自噬,在生理状态下,自噬通过负反馈作用保护细胞。但是,在某些情况下,氧化应激引起的过度自噬也会导致自噬性细胞死亡[18]。因此,通过调节氧化还原水平以达到自噬的稳态对POF的治疗意义重大。
首先,本实验采用化疗药物环磷酰胺建立POF模型。环磷酰胺是常用的抗肿瘤药物,具有显著的免疫抑制作用和细胞毒作用;该药物可抑制卵巢功能并破坏卵巢中的卵泡,进而影响生育能力[19-20],通常用于制作POF大鼠模型。在本研究中,腹腔注射环磷酰胺后,大鼠卵巢出现损伤,表现为卵巢指数下降,氧化应激增加,各发育阶段的卵泡数量明显减少,闭锁卵泡增多,发育期卵泡的颗粒细胞大量死亡,并且血清E2、AMH分泌水平下降,FSH水平升高。血清FSH水平升高表明环磷酰胺诱导的卵巢毒性程度,与E2和AMH水平结合将更好地作为卵巢储备功能的早期预测指标[14]。这些数据与POF紊乱一致,证明卵巢功能明显受损,通过这种方法成功建立了POF模型。
毓麟珠方中以熟地、当归、菟丝子和人参为主要药物。熟地补益精血,可抵抗血清雌激素水平下降,减缓卵巢衰老;当归养血活血,能改善卵巢血流动力,在一定程度上抑制免疫性POF,并具有促进卵泡发育、成熟的作用[21];菟丝子补益肝肾,可提高雌激素水平,对POF有明显疗效[22];人参大补元气,补脾益肺,在抵抗衰老方面有独特的应用价值,其主要活性成分人参皂苷Rg1已被报道可减少卵泡退化,抵抗卵巢衰老[17]。此外,当归、熟地和菟丝子也是现代中医治疗POF的核心药物。鹿角霜、杜仲、花椒和川芎有温养之势,与补肾养血药相配,既可宣滋阴药物之滞,又能领补肾药直入其地,促使卵泡成熟及排出。因此,毓麟珠现代常将其作为补肾、育卵、助孕之方,可减缓卵巢衰老[5-6],并具有抗氧化应激作用[23]。本研究结果显示,高剂量毓麟珠可显著改善环磷酰胺诱导的POF模型大鼠的卵巢功能,上调POF模型大鼠血清雌激素水平,抑制氧化应激,改善卵巢组织的形态异常,增加成熟卵泡数量,减少卵泡闭锁,并有效抑制颗粒细胞凋亡,与既往的研究结果一致。此外,本研究分析了毓麟珠给药后POF大鼠的生育能力,结果表明毓麟珠显著上调了POF大鼠的窝产仔数,再次证实毓麟珠的抗氧化应激和抗卵巢衰老功能。在此基础上,我们对其作用机制进行了探索。
已知生物老化过程由一系列相互关联的机制驱动,包括氧化应激、炎症状态和自噬功能,并通过不同的信号通路发挥作用[24]。SIRT1的NAD+依赖性去乙酰酶活性在调节细胞凋亡和自噬方面发挥了关键作用。SIRT1基因刺激抗氧化因子的表达,可修复因氧化应激受损的细胞,并防止细胞功能障碍;在女性生殖系统中,SIRT1调节颗粒细胞的增殖和凋亡,其下调与卵巢储备减少有关,还通过靶向对卵巢功能维持至关重要的转录因子来调节颗粒细胞对氧化应激的应激反应[25]。作为SIRT1的下游靶标,FoxO1已被证实可被SIRT1去乙酰化,而Ac-FoxO1可促进自噬,导致细胞死亡。增强SIRT1表达可有效地减弱氧化刺激后的FoxO1乙酰化[26]。据报道,激活SIRT1/FoxO1通路可抑制氧化应激,改善自然衰老过程中的卵巢功能[12]。也有报道称,通过抑制FoxO1介导的自噬可保护小鼠颗粒细胞免受氧化损伤[27]。在本研究中,我们观察到,POF大鼠卵巢组织LC3B、beclin-1、Atg5和Atg7 mRNA,beclin-1、Atg5和Atg7蛋白水平,以及LC3-II/LC3-I比值高于正常大鼠,而p62 mRNA和蛋白水平降低,说明POF大鼠卵巢组织自噬被激活;Western blot结果显示POF大鼠卵巢组织SIRT1和FoxO1蛋白水平显著低于正常大鼠,而Ac-FoxO1蛋白水平显著高于正常大鼠。这提示POF大鼠自噬的激活可能与SIRT1表达降低介导的FoxO1乙酰化水平升高有关。给予毓麟珠干预后,SIRT1和FoxO1表达升高,Ac-FoxO1蛋白水平降低,同时卵巢组织自噬相关因子LC3B、beclin-1、Atg5和Atg7水平及LC3-II/LC3-I比值降低,p62水平升高,说明POF大鼠自噬被抑制,提示毓麟珠可能通过调控SIRT1/FoxO1通路,抑制POF大鼠自噬。为了验证这一假设,我们接下来研究了毓麟珠介导的自噬抑制是否需要SIRT1/FoxO1通路。在毓麟珠处理的基础上,使用SIRT1抑制剂EX527对POF大鼠进行干预,结果显示,抑制SIRT1后毓麟珠对POF大鼠卵巢的保护作用被明显减弱,同时其抑制氧化应激和自噬的作用也被减弱,提示SIRT1/FoxO1通路参与了毓麟珠对POF大鼠卵巢的保护作用。
综上所述,毓麟珠可能是通过激活SIRT1/FoxO1通路,抑制氧化应激及细胞自噬,从而改善POF大鼠的卵巢功能。这可能是毓麟珠治疗POF的机制之一。
[1] Chen H, Liu C, Zhu S, et al. The therapeutic effect of stem cells on chemotherapy-induced premature ovarian failure[J]. Curr Mol Med, 2021, 21(5):376-384.
[2]阿孜古丽·要力瓦斯,毛吾兰·买买提依明,迪丽娜孜·艾尔肯,等. 中药木尼孜其对慢性应激型卵巢早衰大鼠性腺轴的影响[J]. 中国病理生理杂志, 2019, 35(9):1700-1705.
Aziguli·Yolivasi, Maowulan·Maimaitiyim,Dilinaz·Elken, et al. The effect of the traditional Chinese medicine Munizqi on the gonadal axis of chronic stress-induced premature ovarian failure in rats[J]. Chin J Pathophysiol, 2019, 35(9):1700-1705.
[3] Lin J, Wu D, Jia L, et al. The treatment of complementary and alternative medicine on premature ovarian failure[J]. Evid Based Complement Alternat Med, 2021, 2021(1):6677767-6677780.
[4] Cai L, Zong DK, Tong GQ, et al. Apoptotic mechanism of premature ovarian failure and rescue effect of traditional chinese medicine: a review[J]. J Tradit Chin Med, 2021, 41(3):492-498.
[5]董晓英,柳顺玉. 毓麟珠治疗脾肾阳虚型卵巢早衰的临床观察[J]. 中华中医药学刊, 2016, 34(10):2364-2366.
Dong XY, Liu SY. Clinical observation of Yulinzhu in the treatment of premature ovarian failure with spleen and kidney yang deficiency[J]. Chin Journal Tradit Chin Med, 2016, 34(10):2364-2366.
[6]董晓英,冯逊逊,郑秀蕊,等. 毓麟珠对早发性卵巢功能不全模型小鼠卵巢形态、卵泡发育及mTOR信号通路的影响[J]. 中国中医药信息杂志, 2018, 25(10):49-53.
Dong XY, Feng XX, Zheng XR, et al. Effects of Yulinzhu on ovarian morphology, follicular development and mTOR signaling pathway in mice with premature ovarian insufficiency[J]. Chin J Inf Tradit Chin Med, 2018, 25(10):49-53.
[7] Lin M, Hua R, Ma J, et al. Bisphenol a promotes autophagy in ovarian granulosa cells by inducing AMPK/mTOR/ULK1 signalling pathway[J]. Environ Int, 2021, 147(1):106298-106310.
[8] Lu X, Bao H, Cui L, et al. hUMSC transplantation restores ovarian function in POI rats by inhibiting autophagy of theca-interstitial cells via the AMPK/mTOR signaling pathway[J]. Stem Cell Res Ther, 2020, 11(1):268-280.
[9] Wu Q, Hu Y, Jiang M, et al. Effect of autophagy regulated by Sirt1/FoxO1 pathway on the release of factors promoting thrombosis from vascular endothelial cells[J]. Int J Mol Sc, 2019, 20(17):4132-4145.
[10] 钟桂兰,周知,王茹,等. 紫檀芪对宫颈癌细胞自噬及SIRT1-FoxO信号通路的影响[J]. 中国病理生理杂志, 2020, 36(8):1439-1443.
Zhong GL, Zhou Z, Wang R, et al. Effects of Pterostilbene on autophagy and SIRT1-FoxO signaling pathway in cervical cancer cells[J]. Chin J Pathophysiol, 2020, 36(8):1439-1443.
[11] Mei ZG, Huang YG, Feng ZT, et al. Electroacupuncture ameliorates cerebral ischemia/reperfusion injury by suppressing autophagy via the SIRT1-FOXO1 signaling pathway[J]. Aging (Albany NY), 2020, 12(13):13187-13205.
[12] Ding C, Zou Q, Wang F, et al. HGF and BFGF secretion by human adipose-derived stem cells improves ovarian function during natural aging via activation of the SIRT1/FOXO1 signaling pathway[J]. Cell Physiol Biochem, 2018, 45(4):1316-1332.
[13] Lapierre LR, Kumsta C, Sandri M, et al. Transcriptional and epigenetic regulation of autophagy in aging[J]. Autophagy, 2015, 11(6):867-880.
[14] Lim CJ, Lee YM, Kang SG, et al. Aquatide activation of SIRT1 reduces cellular senescence through a SIRT1-FOXO1-autophagy axis[J]. Biomol Ther (Seoul), 2017, 25(5):511-518.
[15] Wang S, Lin S, Zhu M, et al. Acupuncture reduces apoptosis of granulosa cells in rats with premature ovarian failure via restoring the PI3K/Akt signaling pathway[J]. Int J Mol Sci, 2019, 20(24):6311-6323.
[16] 王国涛,马国华,李家英,等. 松果菊苷调控Sirt1-FOXO1通路减轻大鼠心肌缺血再灌注损伤[J]. 中国药师, 2019, 22(11):1976-1979.
Wang GT, Ma GH, Li JY, et al. Echinacoside regulates Sirt1-FOXO1 pathway to reduce myocardial ischemia-reperfusion injury in rats[J]. Chin Pharm, 2019, 22(11):1976-1979.
[17] 刘小虎,赵志慧,周玥,等. PI3K/Akt/mTOR自噬通路在人参皂苷Rg_1延缓D-gal诱导的卵巢早衰小鼠模型卵巢早衰中的作用[J]. 中国中药杂志, 2020, 45(24):6036-6042.
Liu XH, Zhao ZH, Zhou Y, et al. The role of PI3K/Akt/mTOR autophagy pathway in ginsenoside Rg_1 delaying D-gal-induced premature ovarian failure in a mouse model of premature ovarian failure[J]. Chin J Chin Mater Med, 2020, 45(24):6036-6042.
[18] 杨开锋,李兰,周虹,等. 氧化应激与细胞自噬凋亡对卵巢早衰调控的研究进展[J]. 湖南中医药大学学报, 2021, 41(5):809-814.
Yang KF, Li L, Zhou H, et al. Research progress in the regulation of oxidative stress and autophagy and apoptosis on premature ovarian failure[J]. J Hunan Univ Tradit Chin Med, 2021, 41(5):809-814.
[19] Pérez-Andújar A, Newhauser WD, Taddei PJ, et al. The predicted relative risk of premature ovarian failure for three radiotherapy modalities in a girl receiving craniospinal irradiation[J]. Phys Med Biol, 2013, 58(10):3107-3123.
[20] Tsaliki M, Koelsch KA, Chambers A, et al. Ovarian antibodies among SLE women with premature menopause after cyclophosphamide[J]. Int J Rheum Dis, 2021, 24(1):120-124.
[21]李莉,卢鹏,高霞. 当归多糖通过AKT/FOXO3通路调节免疫性卵巢早衰小鼠内分泌功能[J]. 基因组学与应用生物学,2019,38(7):3268-3272.
Li L, Lu P, Gao X. Angelica polysaccharide regulates endocrine function in mice with immune premature ovarian failure through AKT/FOXO3 pathway[J]. Genomics and Applied Biol, 2019, 38(7):3268-3272.
[22] 王永霞,马娜,钟兴明,等. 菟丝子总黄酮对卵巢早衰大鼠卵巢功能的作用研究[J]. 医学综述,2019,25(13):2695-2699.
Wang YX, Ma N, Zhong XM, et al. Effects of total flavonoids from Cuscuta radix on ovarian function in rats with premature ovarian failure[J]. Med Recapit, 2019, 25(13):2695-2699.
[23] 杨珍,魏茂林,董晓英. 毓麟珠通过影响免疫性POI小鼠卵母细胞线粒体改善卵巢功能的研究[J]. 环球中医药, 2020, 13(11):1846-1852.
Yang Z, Wei ML, Dong XY. Yu Linzhu improves ovarian function by affecting the mitochondria of immune POI mouse oocytes[J]. Global Chin Med, 2020, 13(11):1846-1852.
[24] Wu M, Luo Q, Nie R, et al. Potential implications of polyphenols on aging considering oxidative stress, inflammation, autophagy, and gut microbiota[J]. Crit Rev Food Sci Nutr, 2021, 61(13):2175-2193.
[25] Alam F, Syed H, Amjad S, et al. Interplay between oxidative stress, SIRT1, reproductive and metabolic functions[J]. Curr Res Physiol, 2021, 4(1):119-124.
[26] Salminen A, Kaarniranta K, Kauppinen A. Crosstalk between oxidative stress and SIRT1: impact on the aging process[J]. Int J Mol Sci, 2013, 14(2):3834-3859.
[27] Shen M, Cao Y, Jiang Y, et al. Melatonin protects mouse granulosa cells against oxidative damage by inhibiting FOXO1-mediated autophagy: Implication of an antioxidation-independent mechanism[J]. Redox Biol, 2018, 18(1):138-157.
Regulatory effect of Yulinzhu on SIRT1-FoxO1-autophagy pathway in rats with premature ovarian failure
HE Xiao-lan1, WANG Kun-peng2, ZHOU Yue-xi1, WU Shang-rong1, HU Ya-jun1△
(1,,430030,;2,430030,)
To investigate the effect of Yulinzhu on autophagy of premature ovarian failure (POF) rats and analyze its mechanism of preventing and treating POF.Female SD rats were randomly divided into normal group, POF group, estradiol valerate group (estradiol group), low-dose Yulinzhu group, high-dose Yulinzhu group, and Yulinzhu+silent information regulator 1 (SIRT1) inhibitor EX527 group (Yulinzhu+EX527 group), with 16 rats in each group. The rats in low- and high-dose Yulinzhu groups were given Yulinzhu liquid by gavage at 7.56 and 15.12 g/kg, respectively. The rats in estradiol group were given estradiol valerate solution by gavage, and the rats in Yulinzhu+EX527 group were given 15.12 g/kg of Yulinzhu liquid by gavage and 10 mg/kg EX527 by intraperitoneal injection. The rats in normal group and POF group were given an equal volume of normal saline. These treatments were conducted once per day for 3 weeks. After the administration, the weight of both ovaries and body weight were recorded, and the ovarian index was calculated. ELISA was used to detect the serum levels of estradiol (E2), follicle-stimulating hormone (FSH) and anti-Müllerian hormone (AMH) of the rats in each group. The levels of malondialdehyde (MDA), superoxide dismutase (SOD) and catalase (CAT) in the ovarian tissue of rats in each group were detected. Hematoxylin-eosin (HE) staining and TUNEL staining were used to observe the pathological changes of the ovarian tissue of rats in each group. The numbers of follicles at various levels were counted, and the level of granulosa cell apoptosis in antral follicles was analyzed. Immunohistochemical method was used to detect the expression of microtubule-associated protein 1 light chain 3B (LC3B) protein in ovarian tissues of rats in each group. RT-qPCR was used to detect the mRNA expression of LC3B, p62, beclin-1, Atg5 and Atg7 in ovarian tissues of rats in each group. Western blot was used to detect the protein levels of LC3A/B, p62, beclin-1, Atg5, Atg7, SIRT1, forkhead box protein O1 (FoxO1) and acetylated FoxO1 (Ac-FoxO1) in ovarian tissues of rats in each group. Fertility in POF rats was assessed.Compared with normal group, the ovarian index, serum E2and AMH levels, ovarian tissue SOD and CAT activity, numbers of ovarian primordial follicles, primary follicles, secondary follicles and antral follicles, p62 mRNA and protein levels, SIRT1 and FoxO1 protein levels, pregnancy rate and embryo number of the rats in POF group were significantly reduced, while the serum FSH level, ovarian tissue MDA level, atretic follicle number, granulosa cell apoptosis level, ovarian LC3B protein positive expression, LC3B, beclin-1, Atg5 and Atg7 mRNA levels, beclin-1, Atg5, Atg7 and Ac-FoxO1 protein levels, and LC3-II/LC3-I ratio were significantly increased (<0.05). Compared with POF group, the ovarian index, serum E2and AMH levels, ovarian tissue SOD and CAT activity, numbers of ovarian primordial follicles, primary follicles, secondary follicles and antral follicles, p62 mRNA and protein levels, SIRT1 and FoxO1 protein levels, pregnancy rate and embryo number of the rats in high-dose Yulinzhu group and estradiol group were significantly increased, while the serum FSH level, ovarian tissue MDA level, atretic follicle number, granulosa cell apoptosis level, ovarian LC3B protein positive expression, LC3B, beclin-1, Atg5 and Atg7 mRNA levels, beclin-1, Atg5, Atg7 and Ac-FoxO1 protein levels, and LC3-II/LC3-I ratio were significantly reduced (<0.05). EX527 was able to significantly weaken the protective effect of Yulinzhu on ovarian function in POF rats.Yulinzhu may activate the SIRT1/FoxO1 signaling pathway to inhibit oxidative stress and autophagy, and improve the ovarian function of POF rats.
Yulinzhu; Premature ovarian failure; Oxidative stress; Autophagy; SIRT1-FoxO1 signaling pathway
R711.75; R363.2
A
10.3969/j.issn.1000-4718.2022.06.017
1000-4718(2022)06-1091-14
2021-12-20
2022-04-29
湖北省卫健委中医药科研项目(No. ZY2019M005)
Tel: 18062033176; E-mail: 2862948345@qq.com
(责任编辑:宋延君,罗森)

