下调miR-217抑制类风湿性关节炎患者外周血单个核细胞炎症反应的实验研究
郭淑芳 姜婷婷 (延安大学医学院,延安 716000)
类风湿性关节炎(rheumatoid arthritis,RA) 是一种临床常见的自身免疫性疾病,主要特征为关节慢性滑膜炎症[1]。RA患者在发病后两年内即可出现不可逆的关节损害,严重影响患者的生活质量[2]。单核/巨噬细胞是RA滑膜组织以及关节液中数量最多的免疫细胞,通过分泌活性因子、抗原提呈等调节免疫功能[3]。单核/巨噬细胞过度活化导致滑膜慢性炎症,其还能分泌TNF-α、IL-1β、IL-6等炎症因子,加剧炎症反应,促进RA患者病情的恶化[4]。微小RNA(microRNA,miRNA)是一类内源性的非编码小分子单链RNA,长度为18~25个核苷酸,在炎症反应、固有免疫以及肿瘤发生和发展等生物学过程中起重要的调节作用[5-7]。研究显示,miR-217在乙醇诱导的肝细胞中表达上调,下调miR-217表达可抑制乙醇诱导的肝脏炎症[8]。miR-217在高糖诱导的大鼠肾小球系膜细胞(RMC)中表达上调,miR-217基因沉默可抑制高糖培养的大鼠RMC细胞炎症反应和纤维化[9]。目前,miR-217对RA患者PBMC细胞炎症反应的影响还未见报道。本研究分离培养RA患者外周血单个核细胞(peripheral blood mononuclear cells,PBMC),采用脂多糖(lipopolysaccharide,LPS)诱导PBMC细胞产生炎症反应,探讨miR-217对RA患者PBMC细胞炎症反应影响及其作用机制,为RA的临床治疗提供一定的理论依据。
1 材料与方法
1.1材料 人AB血清购自上海素尔生物科技有限公司;DMEM培养基购自美国Gibco公司;TNF-α、IL-1β、IL-6和IL-10试剂盒购自南京建成生物工程研究所;Trizol试剂和反转录试剂盒购自美国Invitrogen公司;PCR试剂盒购自TaKaRa公司;引物序列由上海生物工程公司设计提供;RIPA蛋白裂解液和BCA蛋白测定试剂盒购自碧云天公司;转染相关miR-217阴性对照、miR-217 mimics等均购自Ambion公司;沉默信息调节因子2相关酶1(sirutuin1,Sirt1)抗体购自美国Santa Cruz公司;HRP标记的二抗购自武汉艾美捷科技有限公司。LipofectamineTM2000试剂盒购自上海阳光生物科技有限公司;荧光素酶检测试剂盒购自汉恒生物工程(上海)有限公司。
1.2方法
1.2.1RA患者PBMC细胞的分离培养 RA患者诊断标准根据2010年美国风湿病学会(ACR)和欧洲抗风湿病联盟(EULAR)的RA分类标准[10]。参照文献[11]方法分离培养RA患者PBMC细胞。采集RA患者外周静脉血,应用淋巴细胞分离液采用Ficoll密度梯度离心法分离PBMC,使用AB血清和DMEM培养基培养。
1.2.2细胞转染 PBMC细胞接种于24孔板中,LPS预刺激24 h后PBS清洗2次。采用Lipofecta-mineTM2000转染试剂说明书进行转染。分别将anti-NC(阴性对照)、anti-miR-217转染至PBMC细胞,分别anti-NC组和anti-miR-217组;pcDNA3.1(阴性对照)、pcDNA3.1-Sirt1转染至PBMC细胞,分为pcDNA3.1组和pcDNA3.1-Sirt1组。转染后培养6 h,更换含10%AB血清的DMEM培养基继续培养24 h,收集各组细胞用于后续实验。
1.2.3ELISA法检测炎症因子表达 PBMC细胞接种于24孔板中,培养24 h后,收集细胞培养上清液。参照TNF-α、IL-1β、IL-6和IL-10试剂盒操作说明,采用酶联免疫吸附法(ELISA)测定细胞培养上清液中其表达水平。
1.2.4qRT-PCR检测miR-217和Sirt1 mRNA表达 取各组细胞,加入Trizol试剂,提取总RNA。微量核酸仪检测RNA纯度的浓度。A260/A280的比值在1.8~2.0用于反转录。使用反转录试剂盒进行反转录,PCR试剂盒进行扩增。扩增条件,95℃预变性5 min,95℃变性5 s,60℃退火30 s,72℃延伸30 s,共进行45个循环。miR-217以U6为内参,Sirt1以GAPDH为内参,采用 2-ΔΔCt法计算miR-217和Sirt1 mRNA的相对表达水平。
1.2.5Western blot检测Sirt1蛋白表达 取各组细胞,加入RIPA蛋白裂解液提取总蛋白,BCA法测定蛋白浓度。取适量蛋白质,加入上样缓冲液,煮沸5 min,进行SDS-PAGE电泳。分离后的蛋白质电转移至PVDF膜,5%脱脂牛奶室温封闭1 h。加入Sirt1抗体,4℃摇床孵育过夜。TBST洗膜后,加入HPR标记的二抗,室温孵育1 h。TBST洗膜后,滴加ECL显影液,避光显影。Bio-Rad Chemi DOC MP全能型成像分析系统拍照,以GAPDH为内参,分析蛋白条带灰度值。
1.2.6双荧光素酶报告基因实验 PBMC细胞接种于24孔板中,细胞融合至50%时,更换无血清DMEM培养基。采用LipofectamineTM2000分别共转染WT-Sirt1、MUT-Sirt1与miR-NC或miR-217 mimics。每组设置3个复孔。转染培养6 h,更换含10%AB血清的DMEM培养基继续培养至48 h,按照双荧光素酶报告基因实验试剂盒操作说明书,检测荧光素酶活性。
2 结果
2.1LPS诱导的PBMC细胞炎症因子表达 以未受LPS诱导的PBMC作为对照,ELISA法检测PBMC炎症因子TNF-α、IL-1β、IL-6和IL-10 蛋白分泌水平。结果显示,与对照组比,LPS刺激组PBMC细胞炎症因子TNF-α、IL-1β、IL-6蛋白水平均显著升高(P<0.05),IL-10蛋白水平均显著降低(P<0.05),说明LPS诱导加剧了PBMC的炎症反应。见表1。
2.2LPS诱导的PBMC细胞中miR-217和Sirt1表达 以未受LPS诱导的PBMC细胞作为对照,qRT-PCR检测PBMC细胞中miR-217和Sirt1 mRNA表达,Western blot检测Sirt1 蛋白表达,结果显示,与对照组比,LPS诱导组PBMC细胞中miR-217表达水平显著升高(P<0.05),Sirt1 mRNA和蛋白表达水平显著降低,说明LPS刺激后,PBMC中miR-217呈高表达,Sirt1呈低表达(P<0.05)。见图1。
2.3下调miR-217表达对LPS诱导的PBMC细胞炎症因子表达的影响 转染anti-NC、anti-miR-217至PBMC细胞,qRT-PCR检测miR-217表达,结果显示,anti-miR-217组PBMC细胞中miR-217表达水平显著低于anti-NC组(P<0.05),说明miR-217低表达的PBMC细胞构建成功,见图2。ELISA法检测炎症因子TNF-α、IL-1β、IL-6和IL-10蛋白表达。结果显示,与anti-NC组比,anti-miR-217组PBMC细胞中TNF-α、IL-1β、IL-6蛋白表达水平显著降低(P<0.05),IL-10蛋白表达水平显著升高(P<0.05),说明下调miR-217表达可抑制LPS诱导的PBMC细胞炎症反应,见表2。

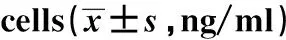
GroupsTNF-αIL-1βIL-6IL-10Control1.21±0.570.43±0.120.53±0.145.13±0.92LPS6.59±1.112.17±0.851.39±0.622.16±0.45t12.9356.0814.0598.700P<0.001<0.0010.001<0.001

图1 LPS对PBMC细胞中miR-217和Sirt1表达的影响Fig.1 Effect of LPS on expression of miR-217 and Sirt1 in PBMC cellsNote: Compared with control group, *.P<0.05.
2.4Sirt1过表达对LPS诱导的PBMC细胞炎症因子表达的影响 转染pcDNA3.1、pcDNA3.1-Sirt1至PBMC细胞,Western blot检测Sirt1蛋白表达,结果显示,pcDNA3.1-Sirt1组PBMC细胞中Sirt1蛋白水平显著低于si-NC组(P<0.05),说明Sirt1过表达的PBMC细胞构建成功,见图3。ELISA法检测炎症因子TNF-α、IL-1β、IL-6和IL-10蛋白表达,结果显示,与pcDNA3.1组比,pcDNA3.1-Sirt1组PBMC细胞中TNF-α、IL-1β、IL-6蛋白水平显著降低(P<0.05),IL-10表达显著升高(P<0.05),说明Sirt1过表达可抑制LPS诱导的PBMC细胞炎症反应,见表3。
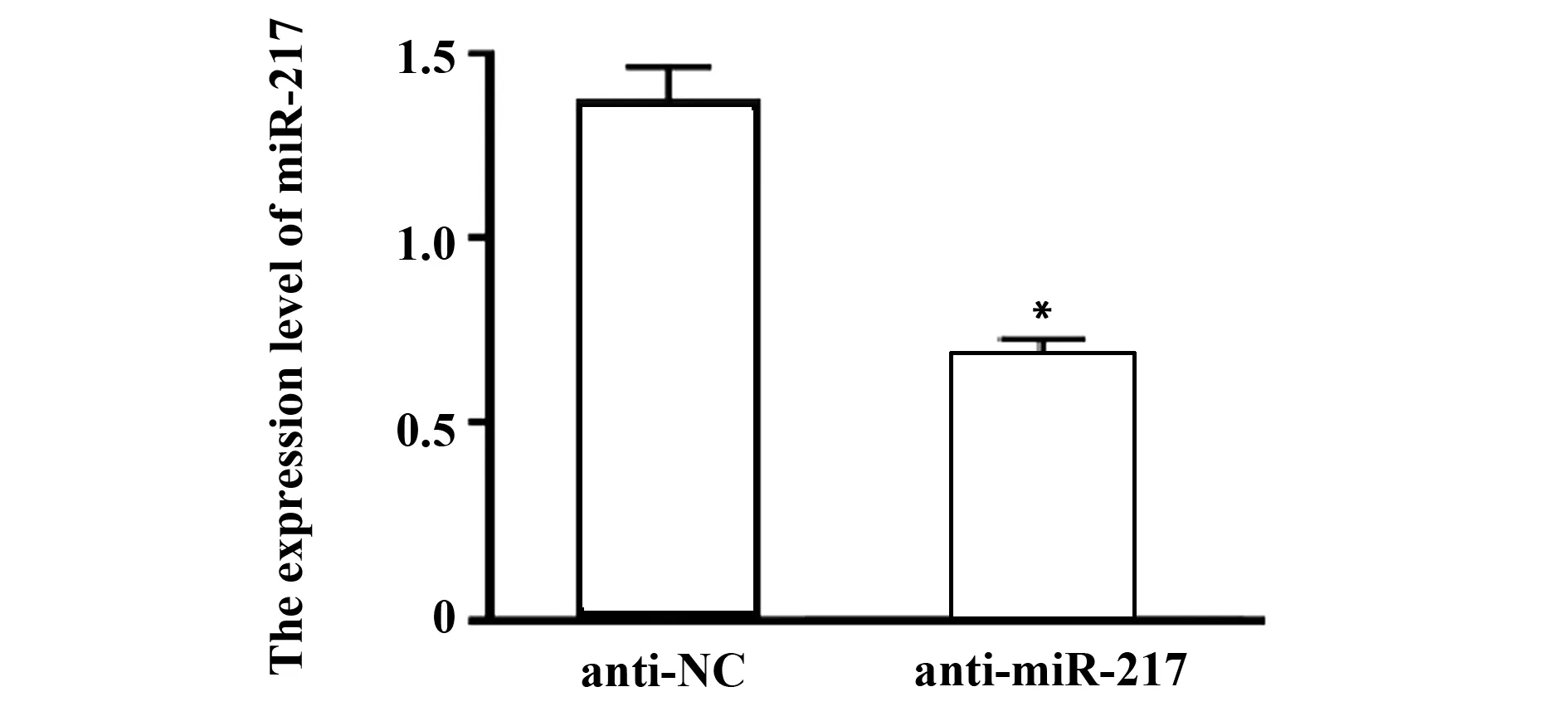
图2 miR-217抑制剂转染效果验证Fig.2 Verification of transfection effect of miR-217 inhibitorNote: Compared with anti-NC group, *.P<0.05.

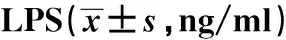
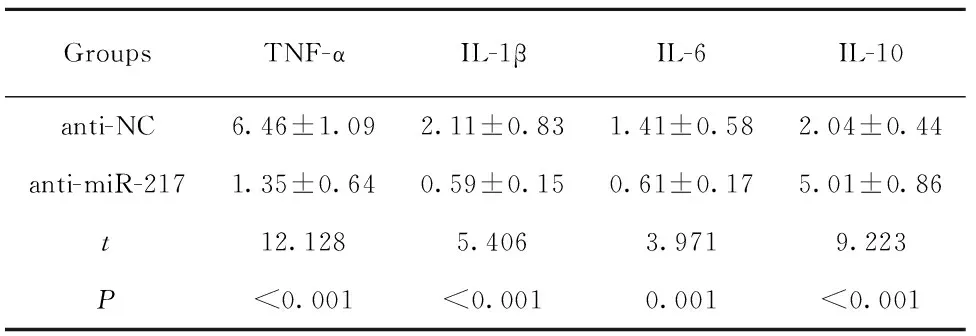
GroupsTNF-αIL-1βIL-6IL-10anti-NC6.46±1.092.11±0.831.41±0.582.04±0.44anti-miR-2171.35±0.640.59±0.150.61±0.175.01±0.86t12.1285.4063.9719.223P<0.001<0.0010.001<0.001

图3 Sirt1过表达载体的转染效果验证Fig.3 Verification of transfection effect of Sirt1 overex-prssion vectorNote: Compared with pcDNA3.1 group, *.P<0.05.

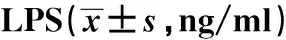
2.5miR-217靶向调控Sirt1表达 Target Scan靶基因预测工具显示,Sirt1基因的3′-UTR区域存在miR-217的结合位点。双荧光素酶报告基因结果显示,WT-Sirt1+miR-217组PBMC细胞荧光素酶活性显著低于WT-Sirt1+miR-NC组(P<0.05),而MUT-Sirt1+miR-217组与MUT-Sirt1+miR-NC组荧光素酶活性无显著差异(P>0.05),说明miR-217靶向调控Sirt1表达。分别将miR-217 mimics、anti-miR-217转染至PBMC细胞,Western blot检测Sirt1蛋白表达。结果显示,miR-217组PBMC细胞中Sirt1蛋白表达显著低于miR-NC组(P<0.05),anti-miR-217组PBMC细胞中Sirt1蛋白表达显著高于anti-NC组(P<0.05),说明miR-217在PBMC细胞中负向调控Sirt1表达。见图4。
表4 下调Sirt1表达降低了下调miR-217对LPS诱导的PBMC中炎症因子表达的影响
Tab.4 Down-regulating Sirt1 reduces effect of down-regulating miR-217 on expression of inflamma-tory factors in LPS-induced PBMC
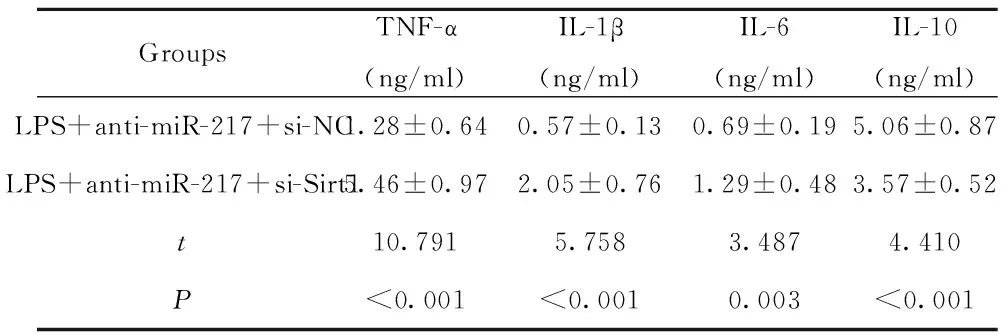
GroupsTNF-α(ng/ml)IL-1β(ng/ml)IL-6(ng/ml)IL-10(ng/ml)LPS+anti-miR-217+si-NC1.28±0.640.57±0.130.69±0.195.06±0.87LPS+anti-miR-217+si-Sirt15.46±0.972.05±0.761.29±0.483.57±0.52t10.7915.7583.4874.410P<0.001<0.0010.003<0.001
2.6上调miR-217表达抑制了Sirt1过表达对LPS诱导的PBMC中炎症因子表达的影响 分别将miR-NC、miR-217 mimics与pcDNA3.1-Sirt1共转染至PBMC细胞,qRT-PCR检测miR-217表达,结果显示,miR-217+pcDNA3.1-Sirt1组PBMC细胞中miR-217表达显著高于miR-NC+pcDNA3.1-Sirt1组(P<0.05),见图5。ELISA法进一步检测两组PBMC细胞炎症因子TNF-α、IL-1β、IL-6和IL-10蛋白表达,结果显示,与miR-NC+pcDNA3.1-Sirt1组相比,miR-217+pcDNA3.1-Sirt1组PBMC细胞中TNF-α、IL-1β、IL-6蛋白表达显著升高(P<0.05),IL-10表达显著降低(P<0.05),说明上调miR-217表达可降低Sirt1过表达对LPS诱导的PBMC细胞中炎症因子表达的影响,见表4。
3 讨论
RA是一种自身免疫性疾病,目前,其发病原因尚不十分清楚,普遍认为其发生与机体炎症反应、免疫功能紊乱等因素关系密切[12]。miRNA可通过与靶mRNA结合,降解或抑制靶mRNA翻译,在细胞发育、增殖、凋亡等生物学过程中发挥关键调控作用。研究显示,大量miRNA在RA患者机体内异常表达,参与RA疾病的发生、发展[13-15]。通过调控miRNA干预网络,可影响RA炎症、免疫、疼痛等多种病理过程,是治疗RA的新思路[16]。彭桉平等[17]发现雷公藤内酯醇可通过抑制miR-155表达下调LPS诱导的RA患者单核细胞炎症反应。朱亚梅等[18]研究发现清络通痹方可能通过影响胶原性关节炎(CIA)小鼠miR-143等miRNA的表达,参与CIA炎症、免疫等过程,是治疗RA的潜在方法。探讨RA患者机体内异常表达的miRNA及其作用机制,有助于深入了解RA的发病机制,为其治疗提供新的策略。
miR-217定位于人2号染色体,参与多种疾病的发生和发展。徐建等[19]研究发现miR-217在食管鳞癌组织和细胞中表达上调,下调其表达可抑制食管癌细胞的增殖、迁移和侵袭。刘宇等[20]研究发现,高糖诱导的内皮细胞中miR-217表达紊乱,miR-217参与内皮细胞的凋亡。目前,miR-217在RA中的研究尚未有报道。细胞发生炎症反应时,促炎症因子TNF-α、IL-1β和IL-6分泌增加,抗炎因子IL-10分泌减少[21]。本研究分离了RA患者PBMC细胞,采用LPS诱导PBMC细胞产生炎症反应,以未受LPS诱导的PBMC细胞作为对照,ELISA法检测结果显示,LPS诱导后,PBMC细胞炎症因子TNF-α、IL-1β和IL-6分泌水平升高,IL-10分泌水平降低,说明LPS诱导PBMC细胞产生了炎症反应。qRT-PCR检测结果显示,LPS诱导后,PBMC细胞中miR-217呈高表达,提示miR-217参与PBMC细胞的炎症反应。通过转染anti-miR-217至PBMC细胞,下调miR-217表达后,LPS诱导的PBMC细胞炎症因子TNF-α、IL-1β和IL-6分泌水平降低,IL-10分泌水平升高,说明下调miR-217表达可抑制RA患者PBMC细胞炎症反应,miR-217是RA治疗的潜在靶点。
通过miRNA靶标预测软件显示,Sirt1基因的3′-UTR区域存在miR-217的结合位点,miR-217可能调控Sirt1表达。Sirt1是一种蛋白去乙酰化酶,定位于细胞核,可通过抑制核因子κB(NF-κB)的转录活性,进而抑制TNF-α、IL-1β、IL-6等炎症细胞因子的产生[22]。本研究结果显示,LPS诱导的PBMC细胞中Sirt1 mRNA和蛋白均表达下调,与蔡国伟等[23]报道的RA患者膝关节滑膜组织Sirt1蛋白表达减少的结果一致,提示Sirt1在RA疾病的发生和发展过程发挥重要作用。本研究双荧光素酶报告基因实验结果显示,共转染WT-Sirt1与miR-217的PBMC细胞荧光素酶活性显著共转染WT-Sirt1与miR-NC的PBMC细胞,而共转染MUT-Sirt1与miR-217的PBMC细胞荧光素酶活性与共转染MUT-Sirt1与miR-NC的PBMC细胞无明显差异,证实miR-217在PBMC细胞中可靶向调控Sirt1表达。这与俞峰等[24]报道的高糖诱导的内皮细胞中miR-217靶向调控Sirt1表达结果一致。进一步将miR-NC、miR-217 mimics转染至PBMC细胞,Western blot检测结果显示,miR-217组PBMC细胞中Sirt1蛋白表达显著低于miR-NC组,说明miR-217在PBMC细胞中负向调控Sirt1表达。ELISA法检测结果显示,LPS诱导后,Sirt1过表达的PBMC细胞中TNF-α、IL-1β和IL-6蛋白水平显著降低,IL-10蛋白水平显著升高,说明Sirt1过表达可抑制LPS诱导的PBMC细胞炎症反应。而与共转染miR-NC与pcDNA3.1-Sirt1的PBMC细胞相比,共转染miR-217与pcDNA3.1-Sirt1的PBMC细胞TNF-α、IL-1β和IL-6蛋白水平显著升高,IL-10蛋白水平显著降低,说明上调miR-217表达可降低Sirt1过表达对LPS诱导的PBMC细胞中炎症因子表达的影响,提示下调miR-217可能通过调控Sirt1表达抑制RA患者PBMC细胞炎症反应。
综上所述,miR-217在LPS诱导的RA患者PBMC细胞中高表达,下调miR-217表达可能通过调控Sirt1表达抑制PBMC细胞的炎症反应,为RA的临床治疗提供了潜在靶点。

