中国多发性骨髓瘤创新药物可及性研究
第一部分:中国多发性骨髓瘤疾病负担、治疗方案与临床未满足需求
1 多发性骨髓瘤疾病概述
多发性骨髓瘤(Multiple Myeloma,MM)是一种克隆性浆细胞异常增殖的恶性疾病[1]。以骨髓中浆细胞恶性增生,分泌大量单克隆免疫球蛋白(M蛋白)并最终导致靶器官损害为特征[2]。临床上主要表现为血钙增高,肾功能损害,贫血和骨病(即“CRAB”症状)[3]。
MM是一种无法治愈的进行性疾病[4]。现有研究表明[5],大多数MM 患者由意义未明单克隆丙种球蛋白血症(monoclonal gammopathy of undetermined significance,MGUS)转化而来:MGUS以每年1%的速度进展为冒烟型骨髓瘤(smoldering multiple myeloma,SMM),SMM患者在确诊的前5年中每年有10%进展为活动性骨髓瘤(active multiple myeloma,AMM)[6]。SMM患者若发生以下3种骨髓瘤相关事件:①克隆性浆细胞≥60%[7,8];②游离轻链检测κ/λ≥100或≤0.01[9,10];③MRI检查发现多于1处局灶性病灶[11],则容易在2年内快速进展为AMM。MM患者在疾病进程中会多次复发直至进展成为难治性MM患者。
MM在生物学和临床预后上具有明显的异质性。不同阶段或疾病风险水平的患者在预后方面的表现差异极大[12]。影响预后的因素主要可以归为宿主因素、肿瘤特征和治疗反应3个大类,单一因素通常不足以决定预后。为保证患者接受有效治疗并获得预后改善,应结合多因素对MM患者进行分期和危险分层[3]。目前,MM的临床分期主要采用Durie-Salmon(DS)系统评估肿瘤负荷与临床进程,使用ISS或R-ISS系统判断预后;Mayo骨髓瘤分层及风险调整治疗(mSMART)系统也较为广泛的应用于临床。基于危险分层的治疗方案建议针对高危MM患者采用更积极的方案预防进一步的并发症,对低危患者则要防止过度治疗避免增加不良反应和浪费有限的卫生经费。
2 中国多发性骨髓瘤的疾病现状和患者特征
MM的发生率约占全部恶性肿瘤的1%,约占血液恶性肿瘤的10%,在多数国家是血液系统第二位常见恶性肿瘤[4]。
2.1 中国MM的发病人数不断上升根据最新发布的WHO
全球癌症统计报告[13],2018年中国新发MM患者20,066例,年龄标化发病率(age-standardized incidence rate,ASIR)约为10万分之1.4;同年死亡患者14,665例;5年累计发病人数44,643例。随着人口的不断增长,人口老龄化的加剧,2020年中国MM新发患者预计将达到21,286例。
2.2 中国MM患者发病呈年轻化趋势MM属于中老年疾病,西方国家的发病年龄高峰为65~75岁,中位发病年龄为68岁。根据中国医学科学院血液病医院的432例MM患者的统计数据[14],我国MM的发病年龄高峰为55~65岁,中位发病年龄为57岁,较西方国家早发病10年。发病年龄早不仅为患者带来疾病负担,也造成了社会经济和劳动力的损失。
2.3 中国MM患者中具有高风险细胞遗传学特征的患者比例更高根据美国梅奥医学中心年发表的一项纳入989例MM患者的病例研究[15],国外MM患者中具有高风险细胞遗传学的患者(即根据FISH检出的伴有t(4;14),t(14;16),del(17p)的MM患者)比例为15%。而上海长征医院血液科的412例MM患者的分析数据表明[16],我国MM患者中具有高风险细胞遗传学的比例达到27%。染色体高度不稳定及复杂的遗传学异常为影响MM预后的最主要的因素。具有高风险细胞遗传学的患者预后更差,五年生存比例仅为24%,显著低于不具备该特征的MM患者[17](五年生存比例:45%)。
2.4 中国MM患者在诊断时已达晚期的比例更高中国一项发表于2014年的多中心(北大人民医院、上海长征医院和北京朝阳医院)的针对新诊断MM患者的调查研究显示[18],MM患者中DSⅢ期和ISSⅢ期的患者比例分别为85.5%和48.3%,显著高于国外的相关病例研究所报道的结果:美国MM患者中,DSⅢ期的比例为40%~50%[19],ISSⅢ期的患者比例为24%[17]。多数MM患者首诊时已为晚期,既因为MM起病缓慢隐匿,早期临床表现不明显易被忽视或误诊[14],也表明MM在我国尚未被广泛认知,需要加强患者教育和MM跨学科培训及合作。
3 中国多发性骨髓瘤的治疗现状和临床未满足需求
3.1 MM现有治疗方案及预后情况近年来,随着对MM生物学和发病机制的深入研究,MM的临床治疗方式发展迅速。
对于年龄不超过65岁、适合造血干细胞移植的患者,干细胞移植是延长患者生存的有效手段。发表于2019年的一项Meta分析显示[20],自体造血干细胞移植在新药时代仍有其地位和作用,即应用新药后再采用自体造血干细胞移植能进一步提高疗效,延长生存期。然而,对于年龄较大以及不能耐受移植术的患者需要更有效的药物治疗。
目前在中国,蛋白酶体抑制剂(proteasome inhibitor,PI)与免疫调节剂(immunomodulatory drugs,IMiD)已成为MM治疗的关键药物,以其为基础的治疗方案已被广泛用于初治及复发/难治MM患者。相较于传统化疗方案,PI和IMiD的联合应用使得MM患者的缓解率及生存期得到了明显的提升。调查研究数据显示[18],我国新诊断的MM患者中,有14.4%的MM患者接受自体干细胞移植手术(autologous stem cell transplantation,ASCT),且全部为65岁以下患者;49.8%的新诊断MM患者接受以PI为主的治疗方案,其中使用比例最高的方案为硼替佐米联合阿霉素及地塞米松方案(VAD)和硼替佐米联合沙利度胺及地塞米松方案(VTD);28.9%的新诊断MM患者使用以IMiD为主的方案,其中使用比例最高的方案为沙利度胺联合地塞米松方案(TD)和沙利度胺联合阿霉素及地塞米松方案(TAD);仅有16.2%的新诊断MM患者使用传统化疗方案,例如,长春新碱联合阿霉素及地塞米松(VAD)和马法兰联合泼尼松方案(MP)。
3.2 中国MM患者临床未满足需求尽管MM的治疗方式发展迅速,有研究数据表明[21](见表1),MM的五年生存率在血液肿瘤中仍然处于较低水平,显著低于淋巴瘤和白血病。中国成年MM患者的五年生存率更是显著低于西方国家。

表1 血液肿瘤五年生存率比较(2000-2014)
几乎所有MM患者最终都会复发或产生耐药性,MM的药物治疗效果会随着疾病的多次复发而逐步削弱。在中国,对于使用过PI和IMiD治疗后疾病进展或耐药的患者尚无更好的可选择方案,此类MM患者因无法接受有效治疗而面临着巨大的生存风险。美国一项纳入了4,030例复发/难治MM患者的真实世界研究显示[22],对于使用过PI和IMiD治疗后疾病进展且耐药的患者,其中位总生存期仅为5~8个月。
对于新诊断MM患者,PI和IMiD能带来的一定生存获益却受到长期使用的安全性挑战。对于复发/难治患者,PI和IMiD只能带来有限的生存获益且一旦耐药便面临预后更差的困境。因此,综合考虑患者的发病特点、现有治疗和预后情况,中国MM患者有以下亟待解决的临床需求:
(1)中国MM患者发病呈年轻化趋势,但大部分患者就诊时已是晚期。MM患者早期无症状缺乏特异性,难诊断且易误诊。患者往往因骨痛、肾病、贫血、感染等症状而首诊于骨科、肾内科、呼吸科等相关科室,由于相关科室的医生对MM缺乏足够认识,患者往往无法得到准确的诊断而延误治疗。因此,迫切需要加强多发性骨髓瘤跨学科培训及合作,提高多发性骨髓瘤的诊断水平。
(2)中国MM患者中高危患者的比例高,预后差,缺乏安全有效的治疗方案。与国外相比,目前国内MM的治疗选择非常有限,仅有硼替佐米、来那度胺、伊沙佐米和达雷妥尤单抗等少数新药,因此,在治疗选择有限的情况下为患者制定合适的治疗方案是临床面临的重要挑战。
参考文献
[1]Kumar SK,Rajkumar V,Kyle RA,et al.Multiple myeloma[J].Nature Reviews.Disease Primers,2017,3:17046.
[2]李勇华,侯健.多发性骨髓瘤的发病机制[J].中国全科医学,2007,10(18):1492-1495.
[3]中国医师协会血液科医师分会,中华医学会血液学分会,中国医师协会多发性骨髓瘤专业委员会.中国多发性骨髓瘤诊治指南(2017年修订)[J].中华内科杂志,2017,11(56):866-870.
[4]陈世伦.重视多发性骨髓瘤的规范化治疗[J].中华内科杂志,2005,44(2):81-82.
[5]黄蓓晖,李娟.多发性骨髓瘤诊断及治疗进展[J].中华血液学杂志,2018,39(7):605-608.
[6]Kyle RA,Remstein ED,Therneau TM,et al.Clinical course and prognosis of smoldering (asymptomatic) multiple myeloma[J].The New England Journal of Medicine,2007,356(25):2582-2590.
[7]Rajkumar SV,Larson D,Kyle RA.Diagnosis of Smoldering Multiple Myeloma[J].The New England journal of medicine,2011,365(5):474-475.
[8]Kastritis E,Terpos E,Moulopoulos L,et al.Extensive bone marrow infiltration and abnormal free light chain ratio identifies patients with asymptomatic myeloma at high risk for progression to symptomatic disease[J].Leukemia,2013,27(4):947-953.
[9]Larsen J T,Kumar SK,Dispenzieri A,et al.Serum free light chain ratio as a biomarker for high-risk smoldering multiple myeloma[J].Leukemia,2013,27(4):941-946.
[10]Cherry B M,Korde N,Kwok M,et al.Modeling progression risk for smoldering multiple myeloma:results from a prospective clinical study[J].Leukemia &Lymphoma,2013,54(10):2215-2218.
[11]Hillengass J,Landgren O.Challenges and opportunities of novel imaging techniques in monoclonal plasma cell disorders:imaging 《early myeloma》[J].Leukemia &Lymphoma,2013,54(7):1355-1363.
[12]邱录贵.多发性骨髓瘤的预后与分层策略[J].国际输血及血液学杂志,2017,40(2):113-119.
[13]International Agency for ReaserchResearch on Cancer of World Health Organization.The Global Cancer Observatory.Multiple Myeloma China Fact Sheet [EB/OL].2019,https://gco.iarc.fr/today/fact-sheets-cancers.
[14]邱录贵.多发性骨髓瘤的发病与国人特点[J].中国实用内科杂志,2006,26(12):886-888.
[15]Binder M,Rajkumar SV,Ketterling RP,et al.Occurrence and prognostic significance of cytogenetic evolution in patients with multiple myeloma[J].Blood Cancer Journal,2016,6(3):e401-e401.
[16]Hai-Min C,Wei W,Rong P,et al.Clinical Application of R-ISS Staging System in 412 Newly Diagnosed Patients with Multiple Myeloma[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2019,27(1):110-114.
[17]Palumbo A,Avet-Loiseau H,Oliva S,et al.Revised International Staging System for Multiple Myeloma:A Report From International Myeloma Working Group[J].Journal of Clinical Oncology,2015,33(26):2863-2869.
[18]Lu J,Lu J,Chen W,et al.Clinical features and treatment outcome in newly diagnosed Chinese patients with multiple myeloma:results of a multicenter analysis[J].Blood Cancer Journal,2014,4(8):e239.
[19]麦玉洁,邱录贵,李睿,等.432例多发性骨髓瘤临床分析[J].白血病·淋巴瘤,2004,13(4):198-201.
[20]Su B,Zhu X,Jiang Y,et al.A meta-analysis of autologous transplantation for newly diagnosed multiple myeloma in the era of novel agents[J].Leukemia &Lymphoma,2019,60(6):1381-1388.
[21]Allemani C,Matsuda T,Di Carlo V,et al.Global surveillance of trends in cancer survival:analysis of individual records for 37,513,025 patients diagnosed with one of 18 cancers during 2000-2014 from 322 populationbased registries in 71 countries (CONCORD-3)[J].Lancet (London,England),2018,391(10125):1023-1075.
[22]Usmani S,Ahmadi T,Ng Y,et al.Analysis of Real-World Data on Overall Survival in Multiple Myeloma Patients With ≥3 Prior Lines of Therapy Including a Proteasome Inhibitor (PI) and an Immunomodulatory Drug(IMiD),or Double Refractory to a PI and an IMiD[J].The Oncologist,2016,21(11):1355-1361.
第二部分:多发性骨髓瘤创新药物的价值与可及性
1 已上市的多发性骨髓瘤治疗药物
1.1 全球已上市的MM治疗药物目前MM的治疗主要包括四类药物:蛋白酶体抑制剂、免疫调节剂、单抗类药物以及糖皮质激素;2000年以来,具有里程碑意义的新药的问世给多发性骨髓瘤的治疗带来了突破性的进展,也不断地给患者生存带来新的获益[1,2],如图1所示。
中国MM治疗药物上市相对较晚,第一代蛋白酶体抑制剂硼替佐米和第二代蛋白酶体抑制剂伊沙佐米分别于2005年和2018年在中国获批;2013年,免疫调节剂来那度胺在中国上市。沙利度胺虽有批文,但在国内获批适应证为控制流行麻风反应症,其治疗多发性骨髓瘤的补充申请在申报中。近两年来,中国新药审批改革加快了MM治疗药物的获批。2019年,全球首个CD38单克隆抗体靶向药物达雷妥尤单抗在中国获批上市,达雷妥尤单抗的获批标志着MM进入免疫治疗时代,为复发难治的多发性骨髓瘤患者带来了新的生存希望。
2 多发性骨髓瘤的初始治疗方案
对于多发性骨髓瘤的初始治疗,治疗目的在于能够有效控制疾病,缓解相关并发症,降低早期死亡风险,耐受性好,毒性最小或可控等。国内外指南推荐蛋白酶体抑制剂、免疫调节剂联合低剂量地塞米松作为标准治疗方案。
2.1 MM的初始治疗常用的药物方案[3]适于移植患者的诱导治疗可选下述方案:
-来那度胺/硼替佐米/地塞米松(RVd)
-硼替佐米/地塞米松(VD)
-来那度胺/地塞米松(Rd)
-硼替佐米/环磷酰胺/地塞米松(VCD),等;
不适合移植患者的初始诱导方案,除以上方案外尚可选用以下方案:
-马法兰/醋酸泼尼松/硼替佐米(VMP)
-马法兰/醋酸泼尼松/沙利度胺(MPT)
-马法兰/醋酸泼尼松/来那度胺(MPR)
-马法兰/醋酸泼尼松(MP)
2.2 国外已获批,中国尚未获批的治疗新诊断MM患者的方案目前,达雷妥尤单抗在中国获批用于单药治疗复发和难治性多发性骨髓瘤成年患者,包括既往接受过一种蛋白酶体抑制剂和一种免疫调节剂且最后一次治疗时出现疾病进展的患者。然而在欧美和日本等地区,其获批适应证逐渐扩展到MM的初始治疗。达雷妥尤单抗已有三个用药方案获得美国食品和药物管理局(U.S.Food and Drug Administration,FDA)批准用于新诊断的多发性骨髓瘤患者:
2018年5月,达雷妥尤单抗联合硼替佐米、马法兰及泼尼松用于不适合自体干细胞移植的新诊多发性骨髓瘤患者的治疗,获得FDA批准上市,成为首个一线治疗的适应证。此适应证获批基于ALCYONE研究的结果[4]。

表1 达雷妥尤单抗用于新诊断的多发性骨髓瘤患者的临床研究
2019年7月,达雷妥尤单抗与来那度胺和地塞米松联用获得FDA批准,治疗不适于使用自体干细胞移植疗法(autologous stem cell transplantation,ASCT)的初治多发性骨髓瘤患者。此次批准参考了MAIA研究的数据[5]。
2019年9月,美国FDA批准达雷妥尤单抗与硼替佐米、沙利度胺和地塞米松联合用于治疗新诊断的适合自体造血干细胞移植(autologous stem cell transplantation,ASCT)的多发性骨髓瘤成人患者。此次批准参考了CASSIOPEIA研究的数据[6]。
创新药物在MM初始治疗中可以有效的提高完全缓解率,而缓解与患者生存有直接的相关性。
3 复发难治的多发性骨髓瘤治疗方案及药物
3.1 复发难治MM的常用治疗药物方案根据《中国多发性骨髓瘤诊治指南(2017年修订)》[3],对于6个月以内复发的患者,可换用其他作用机制的药物联合方案;对6~12个月复发的患者,首选换用其他作用机制的药物联合方案,也可使用原药物再治疗;对于12个月以上复发的患者,可使用原方案再诱导治疗,也可换用其他作用机制的药物方案。具体治疗方案包括:
-首先推荐进入适合的临床试验。
-伊沙佐米/来那度胺/地塞米松(IRD)
-硼替佐米、来那度胺、沙利度胺是治疗复发MM的关键药物,常与在功能上具有相加或协同作用的药物(如蒽环类、烷化剂、糖皮质激素)联合使用,具体参见初治方案。
-对于对硼替佐米、来那度胺双耐药的患者,可以考虑DCEP±V、DT-PACE±V方案(其中沙利度胺可用来那度胺代替)。
除上述方案外,达雷妥尤单抗将为复发难治多发性骨髓瘤患者提供新的治疗选择。无论联用还是单用,达雷妥尤单抗的临床疗效已被多个临床研究证实:
-CASTOR研究[7]:在既往治疗线数至少达到一线的患者中,达雷妥尤单抗和标准治疗(硼替佐米-地塞米松)联用显著延长了无进展生存期,并诱导产生了更高的缓解率。基于达雷妥尤单抗的联合疗法将疾病进展或死亡风险降低了60%以上。
-GEN501&SIRIUS[8,9]合并研究结果:单药达雷妥尤单抗对于高度治疗后的复发难治MM患者有一定的血液学缓解率。在GEN501研究中,患者的中位既往治疗线数为4线,64%的患者对硼替佐米以及来那度胺耐药,总体血液学缓解率为36%。而在SIRIUS研究中,患者的中位既往治疗线数为5线,高达85%的患者对硼替佐米及来那度胺同时耐药,其ORR率为29.2%。两个研究的首次联合分析显示,中位随访时间为20.7个月时,达雷妥尤单抗单药可使近1/3的复发难治MM患者达到血液学缓解,中位缓解持续时间为7.6个月,中位OS时间长达20.1个月。最新的联合分析显示,中位随访时间为36.6个月时,接受达雷妥尤单抗单药治疗的患者,中位OS达到20.5个月。
Luo(2018)[10]通过网状Meta分析对复发难治多发性骨髓瘤的治疗药物的临床疗效进行了比较总结,由研究结果可见,不管是缓解率还是无疾病进展时间,达雷妥尤单抗的疗效都排在前列。
3.2 国外已上市、中国未上市的复发难治MM的治疗药物及方案对于复发难治MM患者,国际上还有诸如卡非佐米,伊沙妥昔单抗等药物可以用于治疗。而这些药物目前尚未在中国上市。
参考文献
[1]Kumar SK,Rajkumar SV,Dispenzieri A,et al.Improved survival in multiple myeloma and the impact of novel therapies[J].Blood,2008,111(5):2516-2520.
[2]Kumar SK,Dispenzieri A,Lacy MQ,et al.Continued improvement in survival in multiple myeloma:changes in early mortality and outcomes in older patients[J].Leukemia,2014,28(5):1122-1128.
[3]中国医师协会血液科医师分会,中华医学会血液学分会,中国医师协会多发性骨髓瘤专业委员会.中国多发性骨髓瘤诊治指南(2017年修订)[J].中华内科杂志,2017,56(11):866-870.
[4]Mateos M-V,Dimopoulos MA,Cavo M,et al.Daratumumab plus bortezomib,melphalan,and prednisone for untreated myeloma[J]. N Engl J Med,2018,378(6):518-528.
[5]Facon T,Kumar S,Plesner T,et al.Daratumumab plus Lenalidomide and Dexamethasone for Untreated Myeloma[J].New England Journal of Medicine,2019,380(22):2104-2115.
[6]Avet-Loiseau H,Moreau P,Attal M,et al.Efficacy of daratumumab (DARA)+bortezomib/thalidomide/dexamethasone (D-VTd) in transplant-eligible newly diagnosed multiple myeloma (TE NDMM) based on minimal residual disease (MRD) status:Analysis of the CASSIOPEIA trial[J].Journal of Clinical Oncology,2019,37(15_suppl):8017-8017.
[7]Mateos M-V,Estell J,Barreto W,et al.Efficacy and Safety of Daratumumab,Bortezomib,and Dexamethasone (D-Vd) Versus Bortezomib and Dexamethasone (Vd) in First Relapse Patients:Two-Year Update of Castor[J].Blood,2018,132 (Supplement 1):3270.
[8]Usmani SZ,Weiss BM,Plesner T,et al.Clinical efficacy of daratumumab monotherapy in patients with heavily pretreated relapsed or refractory multiple myeloma[J].Blood,2016,128(1):37-44.
[9]Usmani SZ,Weiss BM,Plesner T,et al.Safety and Efficacy of Daratumumab Monotherapy in Patients with Heavily Pretreated Relapsed and Refractory Multiple Myeloma:Final Results from GEN501 and Sirius[J].Blood,2017,130 (Supplement 1):3107.
[10]Luo XW,Du XQ,Li JL,et al.Treatment options for refractory relapsed multiple myeloma an updated evidence synthesis by network metaanalysis[J].Cancer management and research,2018,10:2817-2823.
第三部分:多学科合作在多发性骨髓瘤诊治中的价值
1 MDT的作用与意义
多发性骨髓瘤(multipie myeloma,MM)是一个可累积全身多个系统的疾病,大多数患者的治疗,是以延长寿命、缓解骨痛、提高生活质量为目的[1,2]。MM发病年龄较晚,老龄患者常合并各种慢性病[3],需要不同的药物治疗。因此对于老年患者用药、抗肿瘤治疗的毒性管理、药物相互作用筛查、以及依从性等各方面的治疗管理显得尤为重要。此外,MM的并发症包括高钙血症、骨病、肾功能不全、感染、贫血、血栓、高黏滞综合征及淀粉样变性等[1,2],涉及不同系统,需要一个综合的团队进行诊疗。因此,早在2003年,英国国家优化卫生与保健研究所(National Institute for Clinical Excellence)即提出,在MM诊疗过程中,应该引入多学科合作(multidisciplinary team,MDT)以加强对患者的治疗管理,在后续的指南中又反复强调[4,5]。
2 MDT的工作模式
2.1 MDT在MM诊疗中的作用MDT在MM诊疗中起到两方面的作用:其一是在疾病诊断时,需要MDT对于患者的诊断进行讨论并确定。在英国NICE 2003年发布的文件中,明确写出:“所有的诊断必须由适当的MDT给出或复核”。其二,MDT在疾病的治疗管理,所有的治疗方案都应该根据患者的个人情况与个体因素进行[4]。
2.2 MDT成员组成MDT诊疗模式需要各个学科在所构建的平台内相互沟通、共同协作,最终使患者临床获益。多发性骨髓瘤的治疗也需要在MDT诊疗模式中开展:
(1)血液/肿瘤科 MM患者的主要治疗科室。
(2)外科/骨科 骨骼是MM主要侵袭和破坏的部位,外科手术可用于长骨病理性骨折、脊柱骨折压迫脊髓和脊柱不稳定等。注射骨水泥的脊柱成形术可恢复部分患者的身高,缓解临床症状。
(3)临床药师 临床药师作为MDT中的一员,具有自身药学专业优势,通过药学干预、个体化用药等方式参与住院患者的药物治疗,通过药物重整、用药教育、协助开展肿瘤姑息治疗门诊、口服化疗药物管理等方式参与院外患者的药物治疗,以提高患者的用药依从性;同时,肿瘤专科临床药师还通过参与建立计算机医嘱录入系统、参与制订和推广院内相关指南、参与细胞免疫治疗临床试验、进行不良反应监测等方式来提高处方审核的效率以及用药的合理性。治疗过程中及时评估和监测患者的不良反应,并及时提供新药临床试验信息等。
(4)抗感染 感染是导致MM患者死亡的主要因素,未控制的MM与MM的治疗均可能会引起粒细胞缺乏与免疫球蛋白低下[6]。此外,MM的主要治疗药物硼替佐米在治疗中容易出现带状疱疹再激活的情况,在治疗过程应考虑给予抗病毒药进行预防。
(5)疼痛管理 骨痛是MM最常见的临床表现,缓解骨痛也是MM治疗最主要的目标之一,应尽量使患者能够起床活动。此外还有治疗相关的神经痛,因此疼痛管理医师/药师是MM支持治疗中非常重要的一个分支。
(6)老年科 由于MM患者发病年龄较高,因此在治疗和用药过程中,需要关注老年患者特殊的病理生理特征、合并症、用药特点等情况,进行用药管理。
(7)放射科 进行诊断与治疗评估等工作,局部放疗与姑息放疗可以缓解骨痛。
(8)营养科 针对肿瘤、感染、肾功能不全、贫血等各种临床情况制定适宜的营养支持方案。
(9)心内科 MM的化疗方案中涉及蒽环类药物,需关注治疗相关的急性和慢性心脏毒性。硼替佐米在临床应用中也会出现急性充血性心力衰竭或心功能恶化等心脏不良反应,因此应当由心内科医师在治疗前后及时评估与监测患者的心功能,关注抗肿瘤治疗的心脏安全性问题。
(10)中医 中华医学杂志于2019年7月发布了《多发性骨髓瘤中西医结合诊疗专家共识》,从中医角度探讨了在MM支持治疗中的作用及常用药,其中对于MM治疗相关的周围神经病变还可考虑中医外治法,如艾炙、穴位注射、中药熏洗等。中医中药作为我国的传统医学,结合我国的国情,中医在MDT中也可发挥积极的作用[7]。
(11)心理 MM可能会从心理和社会等方面影响患者及其照护者,因此可以由专业的精神科医师或心理咨询师对其心理状态进行评估,并适当提供相应的社会经济问题咨询服务,提供社会支持团体与福利信息等。
(12)姑息治疗 姑息治疗可帮助患者及其家属选择最适宜的治疗/支持方案,姑息放疗多用于不能控制的疼痛、即将发生的病理性骨折或脊髓压迫等。
2.3 临床药师在MDT诊疗模式中的重要性药师通过参与MDT加入MM治疗管理团队,对患者的药物治疗提供专业的药学服务。工作模式可包括定期开展MDT,以及对患者药物治疗的全程化管理,如药品供应、使用、处方审核、合理性点评、疗效评价、不良反应监测与上报、门诊随访、患者教育以及依从性管理等。
(1)共同制定治疗方案 寻找最适宜的治疗方案。尽管大剂量化疗方案是首选的方案,但许多MM患者因发病年龄高、合并症多、基础状态较差而无法耐受。此外,随着新治疗手段的不断涌现、以及新临床试验层出不穷,如何选择治疗方案、决定治疗顺序、确定移植的指征与时机等也是重要的问题。因此,每个MM患者的治疗方案都应当由MDT制定或评价,由肿瘤专科药师进行医嘱审核[8],如遴选药品、用法用量、溶媒选择、给药途径、给药疗程等是否适宜。
(2)协助管理并发症 MM治疗常见并发症包括高钙血症、肾功能不全、感染、骨骼病变、高黏滞血症、血栓与淀粉样变等。
(3)不良反应的预测、预防和处理 计划使用大剂量化疗方案的患者,其进行诱导化疗的目标是快速获得最大缓解率、尽量避免毒性反应、以及保护造血干细胞功能。关注常见的不良反应,及时处理不良反应,并在下一周期进行适宜的剂量调整。
常见的化疗不良反应包括:粒细胞减少、贫血、肝肾功能损伤、感染、血栓等[8,9]。
(4)开展药物重整,避免有害的药物相互作用 对于MM患者,由于中位发病时间较晚,因此经常合并各种慢性病用药,对于入院患者可由药师对患者进行药物重整,并对老年患者用药进行评价,筛选高风险药物与相互作用。
(5)参与新药临床研究 随着新药不断问世,多骨瘤的治疗也在不断进展。最新版美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中,对于无症状MM、复发MM、以及原发耐药MM的治疗,均推荐参加临床试验。因此,及时了解新进展与新疗法,告知患者最新的临床研究机会,也是MDT可以开展的工作。
(6)进行患者教育,提高药物治疗依从性 对患者及其照护者提供信息支持与患者教育,对于患者进行治疗方案的选择并提高依从性非常必要。MM对患者及其照护者的影响可能是多方面的,包括躯体、心理、社会等,因此应当根据患者不同情况提供相应的信息与支持。
患者教育的内容包括[8]:①让患者及其家庭了解MM,并清楚治疗的目标与风险,尤其是MM尚无法被治愈;②该患者的治疗方案由MDT进行探讨并同意;③告知可选择的临床试验;④可提供支持的社会团体;⑤疾病的症状及治疗副反应;⑥误工或致残风险;⑦社会经济问题咨询,提供医保与福利信息等。
2.4 MDT组织管理与质量控制成立MM治疗的MDT诊疗模式,制定MDT工作制度、操作流程、诊疗规范与质控指标,对MDT活动内容与质量进行记录与评价。保证MDT效率和质量,提高MDT诊疗水平。
参考文献
[1]中国医师协会血液科医师分会,中华医学会血液学分会,中国医师协会多发性骨髓专业委员会.中国多发性骨髓瘤诊治指南(2017年修订)[J].中华内科杂志,2017,56(11):866-870.
[2]万德森主编.临床肿瘤学(第四版)[M].北京:科学出版社,2015.
[3]NCCN.Multiple Myeloma:2020 update on Diagnosis,Risk-stratification and Management [EB/OL].2020 V2.https://doi.org/10.1002/ajh.25791.
[4]NICE guideline.Myeloma:diagnosis and management [EB/OL].2016.https://www.nice.org.uk/guidance/ng35/resources/myeloma-diagnosisand-management-pdf-1837394042821.
[5]NICE guideline.Haematological cancers:improving outcomes [EB/OL].2016.https://www.nice.org.uk/guidance/ng47/resources/haematologicalcancers-improving-outcomes-1837457868229.
[6]Bertolotti P,Pierre A,Rome S,et al.Evidence-based guidelines for preventing and managing side effects of multiple myeloma[J].Seminars in Oncology Nursing,2017,33(3):332-347.
[7]中国医药教育协会血液学专业委员会,中国中西医结合学会血液学专业委员会骨髓瘤专家委员会.多发性骨髓瘤中西医结合诊疗专家共识(2019)[J].中华医学杂志,2019,99 (28):2169-2175.
[8]Bird JM,Owen RG,D'Sa S,et al.Guidelines for the diagnosis and management of multiple myeloma 2011[J].British Journal of Haematology,2011,154(1):32-75.
[9]Ludwig H,Delforge M,Facon T,et al.Prevention and management of adverse events of novel agents in multiple myeloma:a consensus of the European Myeloma Network[J].Leukemia,2018,32(7):1542-1560.
第四部分:提高多发性骨髓瘤药物治疗可及性的政策举措和建议
1 对药物可及性的定义
药物可及性是指患者能够以适当的方式、可承担的价格,及时地获得合理的药物治疗来改善病情和健康状况[1]。
有药可治是药物可及性的第一步。对于特定的治疗领域,尤其是癌症等难治疾病,目前仍在不断探索创新疗法、开发创新药物的阶段。药物从研发到获批上市通常经历数十年的时间,而在获得监管部门的上市批准后,药物仍然面临患者是否“用得起”的问题。对于创新药物的可及性,有效的药品价格形成机制和报销政策框架将会是解决药品可及性的关键步骤。
2 审批制度的改革
2.1 中国近年来审批制度的改革大大促进了新药的研发和上市2015年国务院发布《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),提及在药品医疗器械注册方面,需要改善审评审批流程效率低下、临床急需新药的上市审批时间过长等问题,提出了提高审评质量、效率与透明度,鼓励药品创新等一系列目标[2]。此后,多项改善临床试验管理,加快上市审评审批的政策不断出台(见图1)。随着医疗体制和药品监管制度的改革,我国药品的审评审批过程正逐步改善,与国际接轨。
2.2 政策改变为创新药品提供了诸多加快上市的渠道药品评审中心根据药品临床急需程度和临床证据强弱进行优先审批(见图2)。据统计,2018年CDE共纳入313件注册申请进入优先审批程序,其中28%为国际同步申报,23%具有明显临床价值,11%和9%分别为儿童用药和罕见病用药[3]。2018年以通用名计共有106个品种通过上市批准,其中83个为优先审批[3]。受政策鼓励,新药审评审批速度还在不断加快。2019年12月1日起新修定的《药品管理法》实施,其中明确规定,国家鼓励研究和创制新药,鼓励境内外新药同步上市。2019年,193件药品获得注册审批优先审评资格[4]。截至目前,共有51种新药正式获批包括39个进口新药和12个国产新药,其中14个药品为第一批临床急需境外药品目录中的品种,适应证涵盖肿瘤、罕见病等多领域。
2.3 药品评审中心审核效率大幅提升根据CDE公开文件显示,肿瘤药物的审评时间从2016年的21.6个月大幅缩短到8个月,且获批品种逐年增多,其中73%为优先审批(见图3)。药物进口批准不断加快,新药上市时间相较美国和欧盟的滞后期显著缩短,以多发性骨髓瘤为例,来那度胺在FDA批准后8年才通过国内审评,而创新药品伊沙佐米和达雷妥尤单抗分别缩短到了3~4年(见表1)。
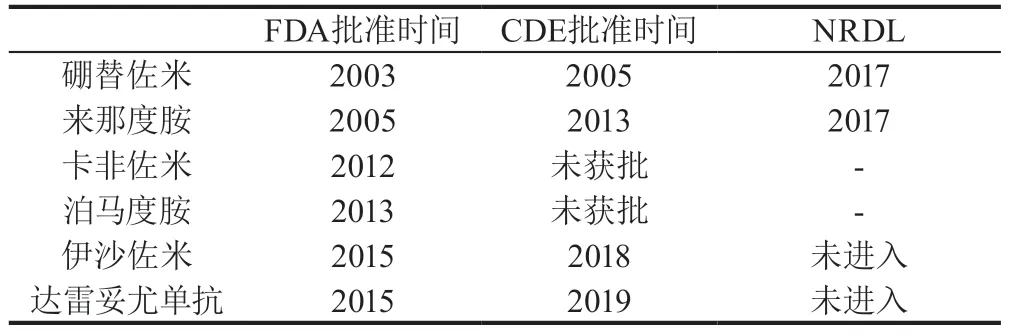
表1 多发性骨髓瘤药物国内外获批时间
2.4 特殊审批达雷妥尤单抗一次性进口2018年12月,国家药监总局批复上海市药监局申请,同意为一骨髓瘤晚期患者进口境外上市药品达雷妥尤单抗。此次批准的是上海仁济医院为晚期肿瘤患者一次性进口未上市的达雷妥尤单抗的申请,在上海属首次。在新药上市前通过特殊通道为无药可治的患者带来治疗希望,展示了我国药监局对患者临床需求的高度重视和创新药品的肯定。
3 医保政策动态
随着监管机制不断改革,在推动药品创新的系统性工作中,完善的医疗保障体制将是提高药物可及性的关键步骤。我国基本医保覆盖率逐年提升,接近实现全民覆盖。基本医疗保险基金的压力也在不断增加,然而许多创新药物仍未被纳入医保,因此医保基金的合理使用以及覆盖更多创新药是未来主要挑战。
3.1 医保目录结构调整,创新药品谈判降价,切实减轻了患者的经济负担目前医保目录范围仍在逐步扩大,基本药物、癌症及罕见病等重大疾病治疗用药、慢性病、儿童用药及急救抢救用药是重点领域。自2017以来医保目录开始动态调整,17年谈判及18年谈判分别纳入了36个和17个品种,平均价格降幅分别为36%和63%,对于提高参保人员用药保障水平、保证基金平稳运行发挥了重要作用。
在进入医保目录后,药品的可及性将大大提高。以多发性骨髓瘤治疗药物为例,根据艾昆纬《中国医院药品统计报告》:万珂®(硼替佐米)、瑞复美®(来那度胺)、恩莱瑞®(伊沙佐米)三种创新药物在进入医保后,患者自付药品治疗月费用下降约90%,患者负担的减少使得更多多发性骨髓瘤患者使用了这些谈判药品。
3.2 建议进一步加强医疗机构的配备使用,使得更多患者真正获益随着公立医院综合改革的稳步推进,医院逐渐加强了对医疗费用的控制,不管是2017—2018年对药占比的考核,还是2019年1月推出的三级公立医院绩效考核指标都对创新药物在临床的使用产生了负面影响。一方面由于创新药物价格普遍较高,药品入院存在阻力,另一方面在临床上需要使用时,医师往往考虑控制费用而让患者通过社会渠道购药,但外购药可能不在医保报销范围,需要完全自费承担。这样的窘境,在用药费用本就相对较高的肿瘤领域尤为突出。
2018年10月国家医疗保障局发布《关于将17种抗癌药纳入国家基本医疗保险、工伤保险和生育保险药品目录乙类范围的通知》,同年11月,国家医疗保障局办公室、人力资源社会保障部办公厅、国家卫生健康委办公厅联合发布了《关于做好17种国家医保谈判抗癌药执行落实工作的通知》,其中要求各地医保、人力资源社会保障和卫生健康部门要采取措施,做好谈判药品的供应保障工作。明确医保部门开展2018年医疗机构年底费用清算时,谈判药品费用不纳入总额控制范围,对合理使用谈判药品的费用要按规定单独核算保障;在制定2019年总额控制指标时,统筹考虑谈判药品合理使用等因素,及时调整基金支付额度,保障医疗机构药品供应和患者用药需求;并要求不得以费用总控、“药占比”和医疗机构基本用药目录等为由影响谈判药品的供应与合理用药需求。虽然通知精神体现了党中央、国务院对减轻患者用药负担的决心,但由于各种复杂原因,各地的执行落实程度不一,特别是2019年三级公立医院绩效考核指标出台后,并未针对其中部分指标的计算做出详细解释,使得三级公立医疗机构在执行过程中存在诸多疑惑,如在计算门诊次均药品费用增幅、住院次均药品费用增幅时是否剔除国家医保谈判抗癌药的部分。
2019年国家医保药品目录准入谈判,共97个药品谈判成功并确定了支付标准,纳入医保乙类范围,国家医疗保障局和卫健委联合发文,文件要求各定点医疗机构根据功能定位、临床需求和诊疗能力等及时配备、合理使用,不得以医保总额控制、医疗机构用药目录数量限制、药占比等为由影响谈判药品配备、使用。各定点医疗机构要根据目录调入、调出药品情况,及时召开专门的药事管理会议,对本医疗机构用药目录进行调整和优化。
医院考核的很多指标依然影响谈判药品的落地,如医疗费用增长率、DGRs付费、次均费用、基本药物使用率等。
4 特药专业药房(DTP)在创新药物可及性中的作用
特药专业药房在我国处于起步阶段,近年来由于政策鼓励支持,许多省市已开展通过定点特药药房进行医保统筹报销,以缓解由于药占比等指标原因药品无法在医院可及的情况。
4.1 特药专业药房快速发展,为患者提供便捷购药渠道目前我国1280余家特药药房,主要分布在东部沿海地区,销售量过百亿,由华润、上海医药、国大药房等几家全国医疗零售龙头企业占据主要市场。虽然特药药房不断涌现,但目前中国特药药房的发展尚不规范,缺乏准入标准。
目前很多省市、统筹区采用的医院单通道报销,没有特药药房这个通道。
4.2 特药专业药房仍存在诸多挑战与障碍患者对于院外购药无法报销和院外药房专业服务的不信任可能是院外渠道购药的阻力之一。目前,专业药房与报销之间的联动尚未完善,大部分省市尚未开通特药统筹报销的“双渠道”。即使商业保险投保率不断上升,商保用户如何高效快速通过特药专业药房购药,需要药企、商保以及药房各方共同协商。另外,高速扩张的特药药房需要大量执业药师,缺乏高资质人才将导致专业化服务不足等问题。在医疗数据逐步电子化的趋势下,特药药房的数据如何与院内EMR和医保数据库有效打通也是一个不小的挑战。
参考文献
[1]WHO.Access to medicines [EB/OL].(2009).https://www.who.int/mediacentre/news/statements/2009/access-medicines-20090313/en/.
[2]国务院关于改革药品医疗器械审评审批制度的意见 [EB/OL].(2015).http://www.gov.cn/zhengce/content/2015-08/18/content_10101.htm.
[3]国家药品监督管理局药品审评中心.2018年度药品审评报告 [EB/OL].(2019).http://www.nmpa.gov.cn/WS04/CL2196/338621.html.
[4]国家药监局负责人表示鼓励境内外新药同步上市 [EB/OL].(2020).http://www.gov.cn/xinwen/2020-01/11/content_5468231.htm.
第五部分:建议开展药物上市后再评价,研究结果支持政策决策,加快创新药可及
1 开展基于真实世界的创新药物的安全性、有效性研究和特殊人群研究
真实世界证据作为上市后药品监测、评价与决策引起了各领域的热烈讨论,也受到了医疗卫生和监管决策部门的重视。在全球范围内,真实世界数据正在越来越广泛地被应用于药物及医疗产品的研发、评价以及监管决策过程,也用于疾病管理和指南制定、医疗质量的监控、医保政策制定等领域[1,2]。中国真实世界研究也正在逐步开展,主要为国际多中心试验的中国研究点,此外数据库多用的是疾病登记注册和电子病历数据库,且主要集中在肿瘤和心血管疾病领域,具体数据见图1。
药物上市后的真实世界研究作为临床试验的补充,部分解决传统临床试验纳入、排除标准过于严格,或干预措施与实际医疗环境不相符合等局限性,尤其是罕见病药物。从监管来看,真实世界证据也正在逐渐被审批部门采纳。2019年5月国家药品审评中心公开征求关于《真实世界证据支持药物研发的基本考虑》意见,真实世界数据将作为创新药快速审批决策中的重要证据。2020年1月,《真实世界证据支持药物研发与审评指导原则(试行)文件正式出台》。
2 药物上市后真实世界研究探讨药物疗效与经济学效益
传统药物上市后的监测评价主要关注药物不良反应与安全性,如我国2015年建立的中国医院药物警戒系统(China Hospital Pharmacovigilance system,CHPS),基于部分医院的电子病历数据主动发现药物安全信号。此外,根据临床试验获批的药物在临床实践上疗效可能有差异,用药方案也可能有调整,需要利用真实世界数据对药物在自然人群中的有效性、安全性、用药方案科学性进行更全面的评估。
真实世界数据同样可以用于药物经济学效益的评估,尤其是从医保支付方合理使用基金的角度,可以借助真实世界证据来评估药物价值,精确定位目标人群,使医疗资源能够更加合理分配。
3 真实世界研究在中国的挑战
真实世界研究基于完整、高质量的真实世界数据,且依赖于复杂的流行病学设计和统计方法。数据质量问题是我国真实世界研究的一大挑战,目前较为广泛使用的医院电子病历数据库和医保数据库都存在数据来源不确定性、数据缺失等问题,同时缺乏对真实世界数据的规范[3]。另一挑战在于真实世界研究的设计方法,如何使用流行病学设计出可信且可行的真实世界研究方案,精确追踪患者临床结局,是应对挑战的关键问题[4]。
未来真实世界研究的发展亟需国家制定更为清晰的政策框架,明确真实世界研究以及真实世界证据评估技术,加强学术和业界的交流。
参考文献
[1]孙鑫.真实世界证据助推药械评价与监管决策[J].中国循证医学杂志,2019,19(05):23-28.
[2]孙鑫.基于真实世界证据的上市后药品评价技术框架体系:思考与建议[J].中国循证医学杂志,2018,18(4):277-283.
[3]Xin Sun.Production of trustworthy real-world data and evidence in China[EB/OL].2018.https://blogs.bmj.com/bmj/2018/11/06/production-oftrustworthy-real-world-data-and-evidence-in-china/.
[4]Xin Sun.Real world evidence:experience and lessons from China[J].BMJ,2018,360(4):1580-1580.
参与研究成员(按照姓氏拼音首字母排序)
岑溪南(北京大学第一医院血液科)、程彦文(哈尔滨医科大学附属二院药学部)、蔡本志(哈尔滨医科大学附属二院药学部)、戴媛媛(中国医学科学院肿瘤医院药剂科)、杜光(华中科技大学同济医学院附属同济医院咸宁分院)、董梅(黑龙江省肿瘤医院药学部)、封卫毅(西安交通大学第一附属医院药学部)、姜明燕(中国医科大学附属第一医院药学部)、陆瑶华(上海第六人民医院药剂科)、冷萍(青岛大学附属医院药学部)、刘向红(山东大学齐鲁医院药学部)、李桂茹(大连医科大学附属第二医院药学部)、孙明辉(华中科技大学同济医学院附属同济医院药学部)、文柳静(天津市肿瘤医院药学部)、王晓丹(中国医学科学院血液病医院药剂科)、武明芬(首都医科大学附属北京天坛医院药学部)、夏忠军(中山大学肿瘤防治中心血液科)、杨菁(福建医科大学附属协和医院药学部)、杨丽(北京大学第三医院药剂科)、张海英(北京大学人民医院药剂科)、赵志刚(首都医科大学附属北京天坛医院药学部)
致谢人员(按照姓氏拼音首字母排序)
高茗(中国人民解放军东部战区总医院)、郭丹(南方医科大学南方医院药剂科)、海鑫(哈尔滨医科大学附属第一医院药学部)、韩冰(复旦大学附属闵行医院药剂科)、黄平(湖南省肿瘤医院药学部)、阚连娣(浙江大学附属邵逸夫医院药学部)、李东锋(新疆医科大学附属第一医院药学部)、刘向荣(湖南省人民医院药学部)、刘晓琰(上海交通大学医学院附属仁济医院药剂科)、彭莉蓉(西安市中心医院药学部)、钱文璟(深圳市第二人民医院药学部)、沈爱宗(中国科技大学附属第一医院药剂科)、宋钟娟(复旦大学附属华东医院药剂科)、陶红慧(上海市第九人民医院黄浦分院药剂科)、吴东方(武汉大学中南医院药学部)、吴飞华(上海交通大学医学院第九人民医院药剂科)、吴寅(西安高新医院药剂科)、肖洪涛(四川省肿瘤医院药学部)、杨志福(空军军医大学西京医院药学部)、张军(复旦大学附属金山医院药剂科)、张抗怀(西安交通大学第二附属医院药学部)、张鹏(陕西省人民医院药学部)、周伯庭(中南大学湘雅医院药学部)

