单倍体造血干细胞移植对儿童重型再生障碍性贫血治疗的并发症分析
再生障碍性贫血(aplastic anemia,AA)是儿童期常见的,有潜在致死性的骨髓衰竭性疾病,其特征为外周血中全血细胞的减少以及骨髓中造血细胞的减少。其中重型再生障碍性贫血(severe aplastic anemia,SAA)病情重,进展快,死亡率高,对于儿童的健康危害极大。联合免疫抑制治疗与造血干细胞移植是治疗儿童SAA的有效手段,同胞全相合造血干细胞移植在指南中被推荐为儿童SAA的首选治疗方案[1],研究表明80﹪以上的SAA患儿接受同胞全相合移植后可长期存活[2-3]。然而由于可获得同胞全相合供体的患儿不足30﹪,故许多患儿无法得到同胞全相合移植的治疗。而联合免疫抑制剂治疗SAA 有效率达到75﹪以上,但其治愈率仅有30﹪,复发率高、无事件生存率低是阻碍联合免疫抑制剂治疗的重要缺陷[4]。近年来随着造血干细胞移植技术的发展,单倍体造血干细胞移植逐渐成为治疗SAA的选择[5]。随着单倍体造血干细胞治疗SAA患儿人数的增多其并发症的问题也逐渐凸显,本中心通过回顾性分析单倍体移植治疗SAA的并发症,以期进一步指导临床实践,从而提高单倍体移植治疗SAA的预后。
资料与方法
一、临床资料
1.患 者:2010年1月1日 至2018年12月31日于苏州大学附属儿童医院就诊的56例SAA患儿为研究对象,其中35例接受单倍体移植的为治疗组,21例同胞全相合移植的为对照组,观察两种移植方式对SAA患儿生存率、移植并发症的影响。AA的诊断按照国际粒细胞减少与AA 研究组1987年标准[6],严重程度分型参照 Camitta 等[7]1976年标准。所有的患儿家长均签署造血干细胞移植术前知情同意书。
2.移植指征:(1)SAA 有同胞全相合供体并且家属要求进行造血干细胞移植术的患儿;(2)SAA经过免疫抑制剂治疗后复发,无同胞全相合供者且病情危重无法等待同胞全相合供者的患儿;(3)因为严重感染无法接受免疫抑制剂治疗或家属拒绝进行免疫抑制剂治疗并且有造血干细胞移植意愿的初诊患儿;(4)长期反复感染并且伴有输血依赖的AA患儿。
二、治疗方法
1.预处理方案:所有患儿均使用非清髓性的预处理方案,其中治疗组预处理方案:氟达拉滨[30 mg/(m2·d)×4 d]+ 环磷酰胺[25 mg/(kg · d)×4 d]+ 白消安[3.2 mg/(kg·d)× 2 d]+ 抗胸腺细胞球蛋白[2.5 mg/(kg·d)×4 d];对照组预处理方案:氟达拉滨[40 mg/( m2·d)×4 d]+环磷酰胺[50 mg/(kg·d)×4 d]+抗胸腺球蛋白[2.5 mg/(kg·d)×4 d]。(表1)
2.干细胞的采集与动员:患者均接受了粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)动员后的骨髓干细胞联合外周血干细胞,其中治疗组于干细胞回输当天给予脐带血帮助其植入。治疗组回输的单个核细胞中位数为7.50(2.30~36.43)×108/kg,CD34+造血干细胞中位数为4.46(1.23~10.15)×106/kg。同胞全相合移植的患儿回输的单个核细胞的中位数为6.03(1.48~13.97)×108/kg,CD34+造血干细胞的中位数为2.86(1.00~10.42)×106/kg。(表1)
3.移植物抗宿主病(graft versus-host disease,GVHD)的预防与治疗:两组患儿均使用环孢素或他克莫司,吗替麦考酚酯,短程甲氨蝶呤预防急性GVHD(acute GVHD,aGVHD)。aGVHD的首选治疗为糖皮质激素(甲泼尼龙),必要时可加用小剂量甲氨蝶呤或环磷酰胺,若发生严重Ⅲ~Ⅳ度aGVHD,激素治疗效果不佳者,给予巴利昔单抗(舒莱)、间充质干细胞等治疗。广泛性慢性GVHD(chronic GVHD,cGVHD)加用芦可替尼治疗。
4.支持治疗:治疗组以及对照组均在层流病房中进行预处理,移植后第6天给予G-CSF,待粒细胞植入后停止。阿昔洛韦或者更昔洛韦,美罗培南,伏立康唑或者氟康唑或者卡泊芬净,复方磺胺甲恶唑预防感染。使用肝素与前列地尔预防肝静脉闭塞症(veno-occlusive disease of liver,VOD)。对症给予碱化,水化,保肝,保肾,保心,保护消化道黏膜。移植后定期给予丙种球蛋白支持治疗,按需给予红细胞,血小板等成分血。
5.诊断依据:(1)粒细胞植入:连续3 d 中性粒细胞绝对计数大于0.5×109/L;(2)血小板植入:在没有血小板支持治疗的前提下,连续7 d 血小板大于20×109/L;(3)ABO 血型:①相合:供受体血型完全相同;②血型小不合:供者为O 型,受者为A,B,AB 型或受者为AB 型,供者为A,B,O 型;③血型大不合:除上述两种情况以外的其他情况;(4)植入综合征:在中性粒细胞早期恢复过程中没有感染而出现的发热、皮疹、腹泻和毛细血管渗漏综合征等情况[8];(5)根据公认的标准进行急性和慢性GVHD的诊断和分级[9-11];(6)出血性膀胱炎的诊断与分级参照Droller 标准[12];(7)渗漏综合征按照2001年Cahiii和Spitzer 提出Es 诊断标准进行诊断与分级[13];(8)骨髓增殖不良是指造血干细胞移植后,无严重GVHD 以及复发,正常嵌合度的情况下,持续两周以上的两系或三系降低(中性粒细胞<1×109/L,血小板<20×109/L,血红蛋白<100 g/L)[14];(9)植入失败按照国际公认诊断标准进行诊断[15];(10)总体生存率(overall survival,OS)被定义为从造血干细胞移植起至因任何原因死亡或最后随访的时间;(11)无失败生存率(failure free survival,FFS)被定义为有治疗反应的生存时间。死亡、原发或继发植入失败和复发被认为是治疗失败。无GVHD 失败存活率(GVHD failure free survival,GFFS)被定义为无Ⅲ-Ⅳ级aGVHD,cGVHD,以及上述治疗失败。
三、统计学分析方法
采用SPSS 22.0 软件进行统计分析,其中连续变量以中位数(范围)表示,患儿年龄、诊断距离移植时间、总单个核细胞数、总CD34+细胞数、中位随访时间、粒细胞植入时间、血小板植入时间以及CD3+T、CD4+T、CD19+B、CD16+CD56+NK细胞在造血干细胞移植后1,2,3,6,12,24个月的细胞数比较,采用Mann-WhitneyU检验进行组间分析。分类变量以相对数(﹪)表示,性别、疾病种类、供体与受体性别、预处理方案、HLA 配型、供体来源、移植物来源、植入综合征、巨细胞病毒(cytomegalovirus,CMV)血症、Epstein-Barr病毒(epstein-barr virus,EBV)血症、死亡人数、植入失败人数和骨髓增殖不良人数采用卡方检验。等级资料(供受体血型相合程度、aGVHD分级、cGVHD 分级、出血性膀胱炎分级和渗漏综合征分级)采用Mann-WhitneyU检验。生存曲线(OS,FFS,GFFS)以及累积发生率(aGVHD、cGVHD、植入综合征和骨髓增殖不良)用Kaplan- Meier法绘制。并使用发生率±标准误表示,用Log-rank 检验分析组间差异。以P<0.05为差异有统计学意义。
结 果
一、不同移植方法AA患儿基本情况
两组患儿年龄、性别、诊断AA 离造血干细胞移植的时间、AA 严重程度、供体与受体的性别、血型相合程度差异均无统计学意义(表1)。治疗组采用骨髓+外周血+脐带血的形式为26例(74.29﹪),而对照组采用骨髓+外周血的形式为13例(63.90﹪),两组比较差异有统计学意义(P<0.001)。
二、不同移植方法AA患儿粒细胞植入情况
治疗组成功获得植入患儿35例(100﹪),对照组20例(95.24﹪,1例因预处理化疗药物毒性于造血干细胞回输当天死亡)。随访时,治疗组1例(2.86﹪)发生了继发性植入失败,给予同一供体造血干细胞2次移植治疗后获得长期植入,对照组2例(9.52﹪)发生了继发性植入失败,给予第1次移植供体的造血干细胞进行了2次移植治疗后获得成功。两组粒细胞植入时间,血小板植入时间,以及植入失败人数差异无统计学意义。(表2)
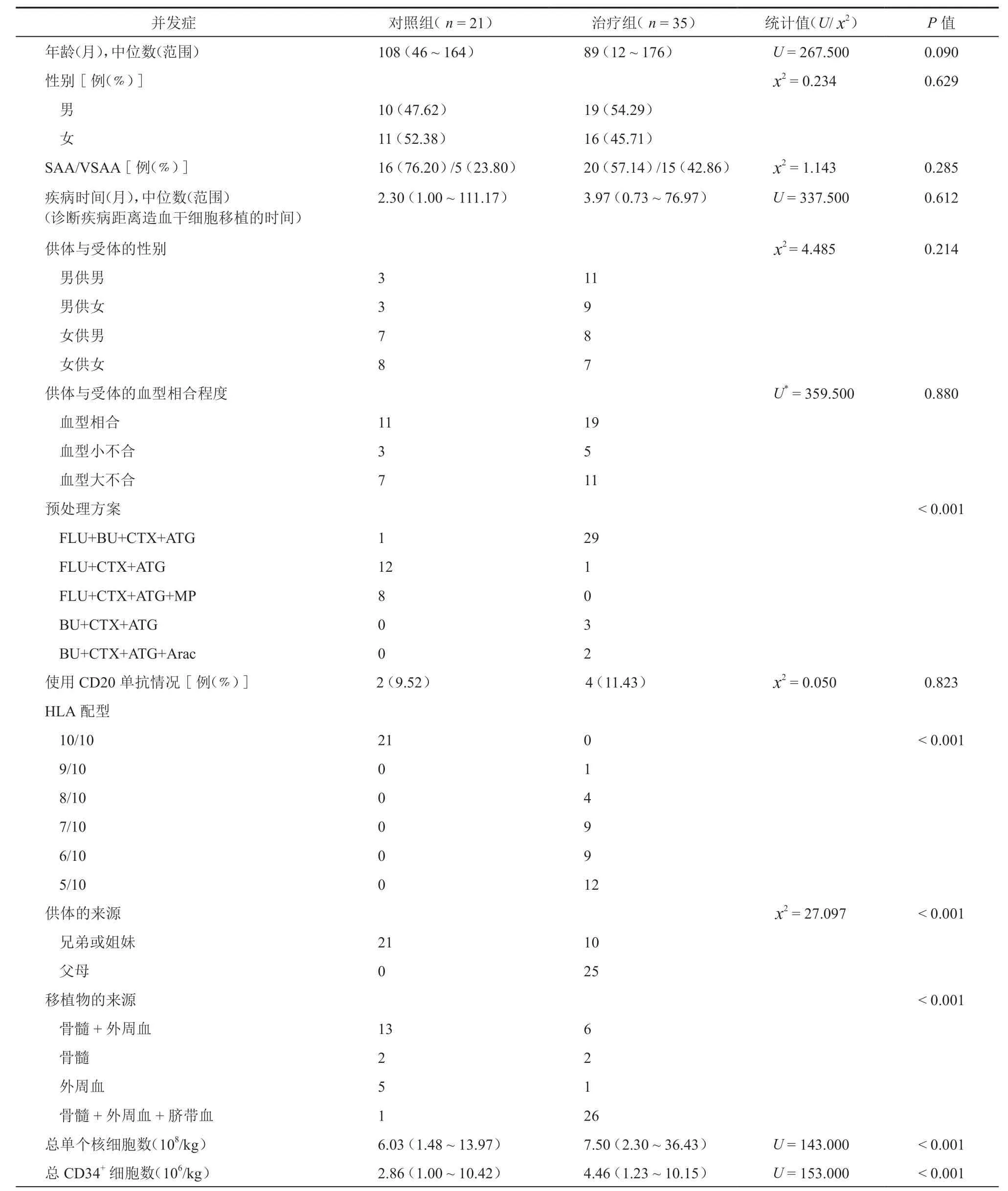
表1 接受造血干细胞移植患者基本信息
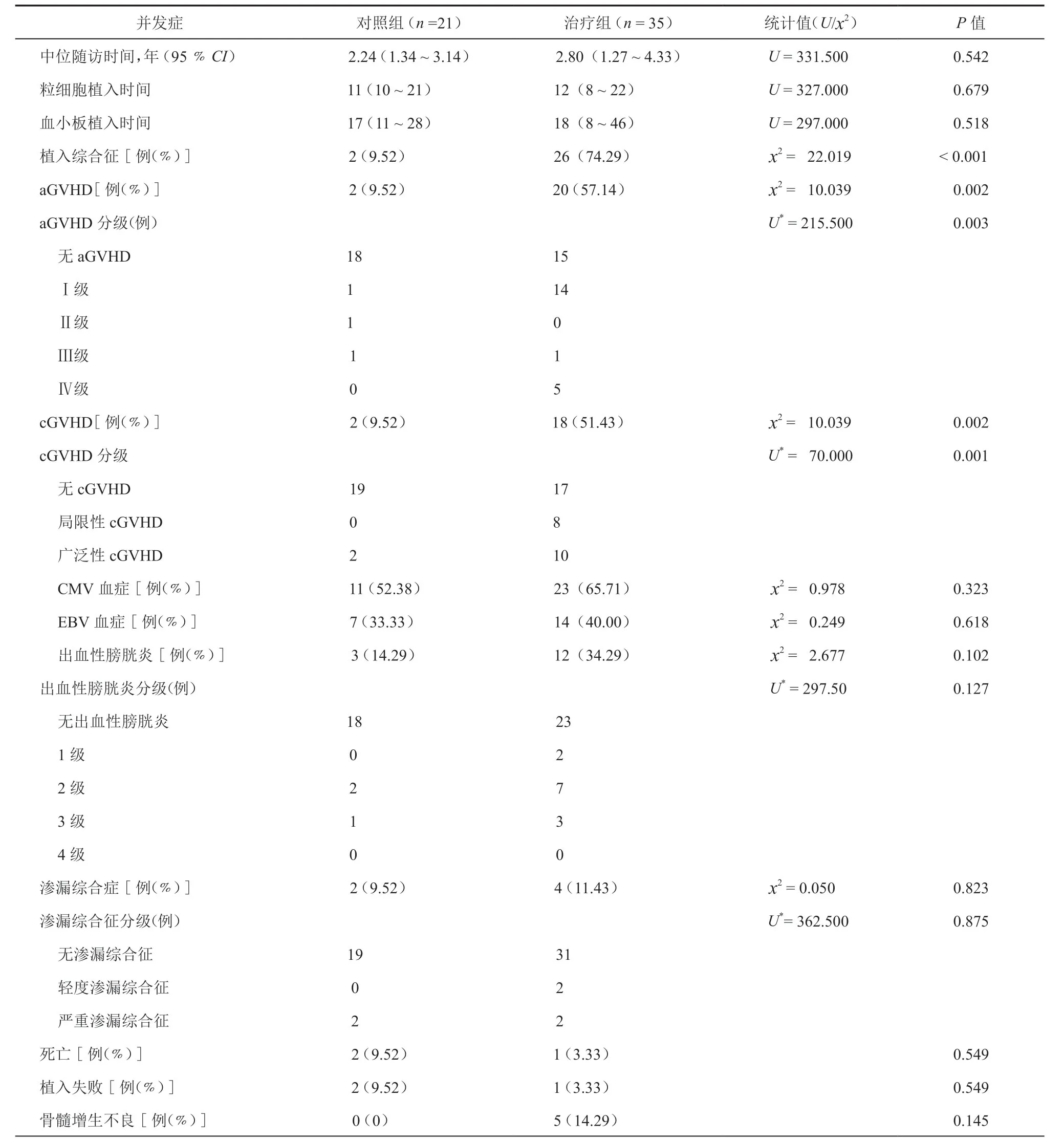
表2 单倍体与同胞全相合移植后并发症比较
三、不同移植方法AA患儿免疫重建结果比较
与对照组比较,治疗组CD19+B细胞的增殖速度在造血干细胞移植后2,3个月降低(P<0.001),两组CD3+T、CD4+T细胞、CD16+CD56+NK细胞增殖、IgG,IgM,IgA 表达水平在造血干细胞移植后1,2,3,6,12,24个月差异均无统计学意义(图1,2)。
四、不同移植方法AA患儿病毒感染情况
两组CMV、EBV感染人数及最高拷贝数比较,差异均无统计学意义(P>0.05)(表2,图3)。
五、不同移植方法AA患儿生存情况比较
治疗组中位随访时间为2.80(95﹪CI:1.27~4.33)年,死亡1例(严重的aGVHD 肠道出血);对照组中位随访时间为2.24(95﹪CI:1.34~3.14)年,死亡2例(化疗药物的毒性)。两组5年OS、FFS、GFFS 比较,差异无统计学意义(P均>0.05)(表3,图4)。

图1 两组患者造血干细胞移植后淋巴细胞亚群免疫重建比较
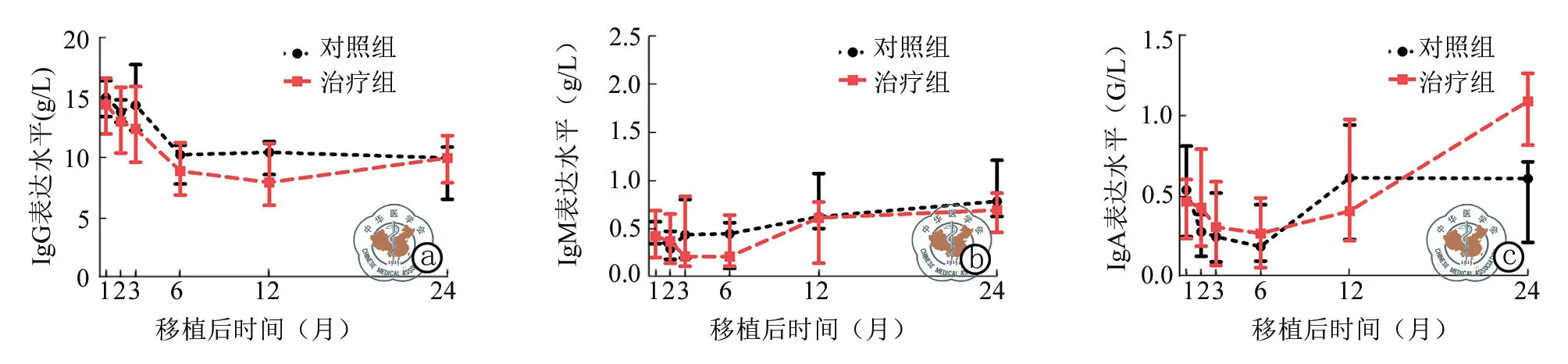
图2 两组患者造血干细胞移植后体液免疫重建比较
六、两组患儿移植后并发症发生率比较
治疗组发生aGVHD20例, cGVHD18例,植入综合征26例,骨髓增殖不良5例,出血性膀胱炎12例,渗漏综合征4例(轻微型2例,严重型2例);对照组发生aGVHD3例、cGVHD 2例,植入综合征2例,骨髓增殖不良0例,出血性膀胱炎3例,渗漏综合征2例(均为严重渗漏综合征)。与对照组比较,治疗组aGVHD、cGVHD和植入综合征累积发生率均升高,差异具有统计学意义(P<0.05),两组Ⅲ-Ⅳ度aGVHD,广泛性cGVHD,出血性膀胱炎、渗漏综合征和骨髓增殖不良累积发生率比较,差异均无统计学意义(P>0.05)。(表2、4,图5)
讨 论
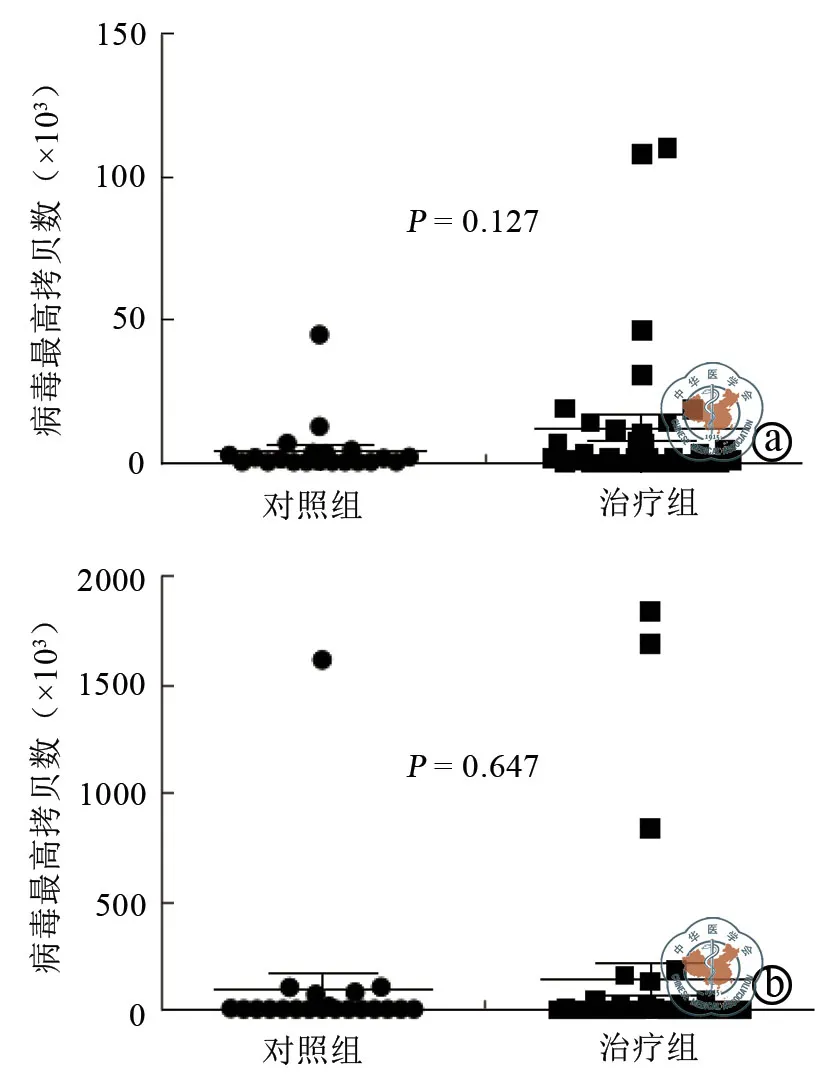
图3 两组患者造血干细胞移植后病毒感染情况比较
我国儿童SAA的一线治疗方案为联合免疫抑制剂治疗以及同胞全合造血干细胞移植。由于疗效低,复发率高,联合免疫抑制剂治疗存在明显的不足[4]。同胞全相合造血干细胞移植作为指南推荐的儿童期AA的首选治疗方案,长期治愈率达到80﹪以上,复发率低[1,16]。但仅有不到30﹪的患儿可得到同胞全合供体。单倍体造血干细胞移植由于其供体来源较为容易,成为患儿替代性选择治疗方案。唐湘凤等[17]一项单中心回顾性研究表明单倍体造血干细胞移植是治疗儿童SAA 较好的治疗方案,其5年OS 与FFS 均为96.4﹪±2﹪。北京大学人民医院统计了单倍体造血干细胞移植治疗SAA的3年OS、FFS,分别为84﹪±5﹪、83﹪±5﹪[18-19]。由此可见单倍体移植已成为治疗儿童SAA的一项选择。但上述研究均未足够关注aGVHD、cGVHD、围植入综合征、骨髓增殖不良以及病毒感染等并发症,本研究以同胞全合移植作为对照,分析两种治疗方法的并发症发生率。
植入失败一直以来都是造血干细胞治疗AA的关键问题,在早期使用造血干细胞移植治疗AA 时由于预处理方案的原因,其单倍体移植植入失败率高达70﹪,同胞全合植入失败率30﹪[20-21]。但随着预处理方案的优化,以及白消安的应用,AA的植入失败率明显降低。本研究表明治疗组的植入失败率为3.33﹪,对照组则为9.52﹪,与其他研究报道的植入失败率类似,表明了FLU+BU+CTX+ATG 方案用于单倍体移植以及FLU+CTX+ATG 方案用于同胞全合移植不易发生植入失败[22]。
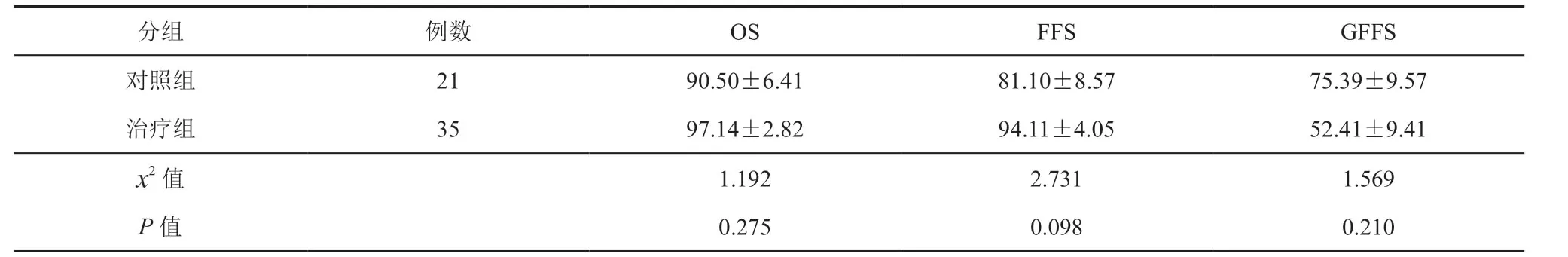
表3 两组5年生存情况比较(﹪,生存率±标准误)
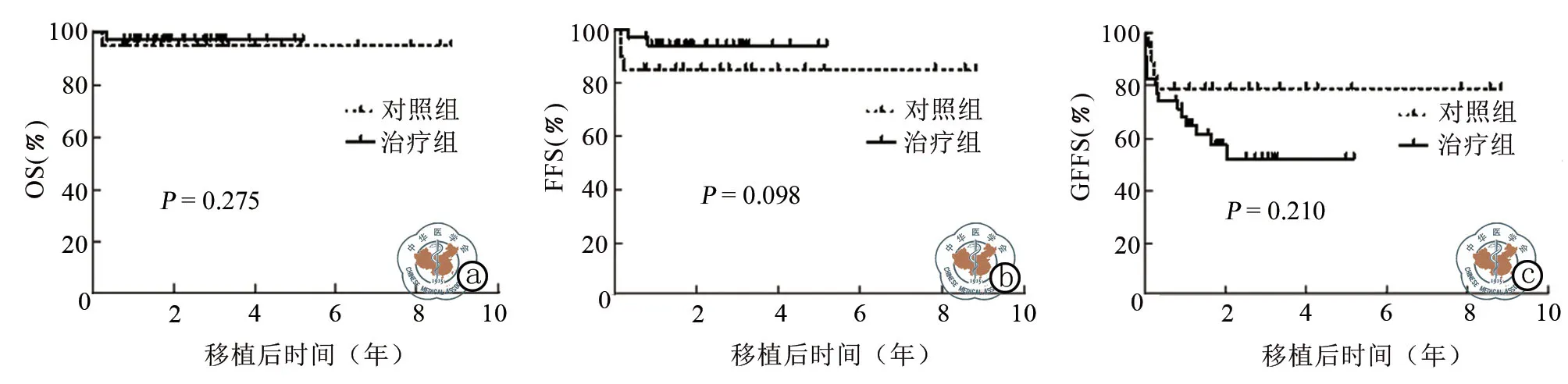
图4 两组患者造血干细胞移植后生存曲线比较
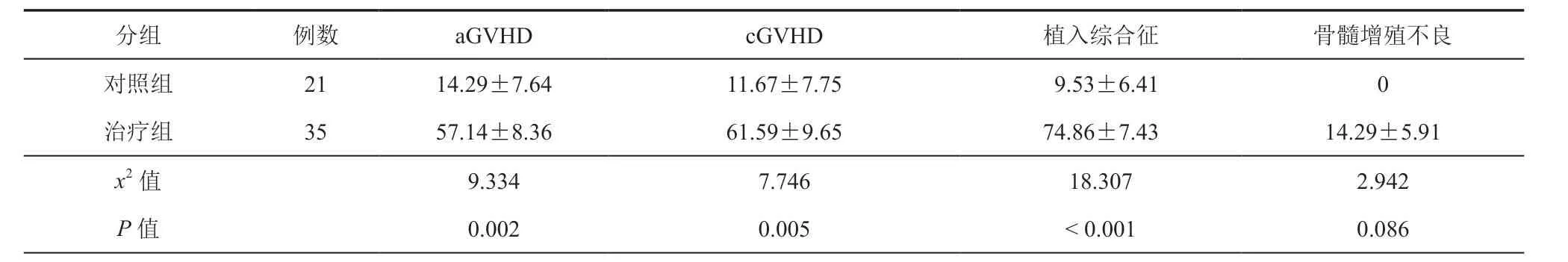
表4 两组患儿移植后并发症累积发生率比较(﹪,发生率±标准误)
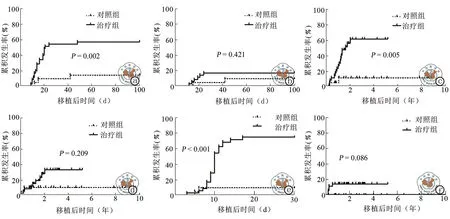
图5 两组患者造血细胞移植后GVHD 累积发生率、植入综合征与骨髓增殖不良累积发生率比较
本研究治疗组与对照组SAA的5年OS分别为97.14﹪和90.50﹪,FFS分别为94.11﹪和81.10﹪。两组移植成功率以及患者的生存率均表明单倍体移植能起到很好的治疗效果,其他研究也表明单倍体移植患儿的疗效优于免疫抑制剂的治疗[23-24]。但值得注意的是,本研究中对照组死亡2例均为化疗药物相关毒性死亡,提示同胞全合移植预处理方案仍有待优化。
儿童期SAA是一种非恶性的血液病,在取得良好生存率以及植入成功率的情况下,应追求更好的生存质量。本研究显示治疗组及对照组GFFS 分别为52.41﹪和75.39﹪。治疗组aGVHD 累积发生率高于对照组,但严重的Ⅲ-Ⅳ度aGVHD 两组差异无统计学意义(图5),治疗组高aGVHD的发生可能与植入综合征发生率较高有关,Im 等[25]报道的去除T细胞治疗AA的单倍体移植aGVHD 发生率相比,本研究的Ⅲ-Ⅳ度aGVHD 发生率更低。
广泛性cGVHD 以及长期骨髓增殖不良都是影响造血干细胞移植患者后期生活质量不佳的并发症[14,26]。本研究中治疗组的cGVHD的发生率高于对照组(图5),但广泛性cGVHD 发生率治疗组虽然高于对照组但差异无统计学意义(图5)。两组cGVHD的发生率不同可能与CD19+B细胞的长期免疫重建差异有关。治疗组发生骨髓增殖不良5例(图5),给予间充质干细胞以及丙种球蛋白等支持治疗后均获得好转。造血干细胞移植后的骨髓增殖不良的机制仍不清楚[27]。Yuan 等[28]研究发现改变T细胞免疫反应能够改善骨髓增殖不良的骨髓微环境,从而改善其造血能力。造血干细胞移植其他并发症,如出血性膀胱炎、渗漏综合征、病毒感染,两组间差异无统计学意义,说明单倍体移植对于儿童期SAA是一个可以推荐的选择性供体。
本研究表明单倍体移植与同胞全合移植在总体生存率,移植成功率以及长期预后差异无统计学意义,在没有同胞全合供体的情况下,单倍体移植是治疗儿童SAA的一种选择性供体。但是单倍体移植易发生植入综合征,且aGVHD和cGVHD 发生率较高,治疗方案需要进一步优化。

