长链非编码RNA在肝细胞肝癌发病中的作用及其机制研究进展
肝细胞肝癌(hepatocellular carcinoma,HCC)是肝癌中最常见的病理类型[1]。在所有癌症中,HCC的病死率排全球第2位[2]。导致HCC的危险因素很多,包括乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)、酒精中毒、肝硬化和代谢性疾病等[3]。因此,作为未来精准治疗的关键,HCC 相关调控因子成为目前研究的重点。随着人类基因组测序技术的发展,已鉴定出约2 万个蛋白质编码基因,占整个基因组的2﹪左右[4]。事实上,超过90﹪的人类DNA 会被转化为非编码RNA(non-coding RNA,ncRNA),尽管没有被转化为蛋白质,但它们参与了多种细胞功能[5]。长链非编码 RNA(long noncoding RNA,LncRNA)具有200多个核苷酸,在细胞生长、分化、染色质组织和基因表达调控等方面发挥着重要作用[6-7]。早期观点认为ncRNA是翻译的“噪声”,不行使功能。近年来,越来越多的研究表明,ncRNA在肝癌发展过程中起着重要作用[3]。
一、LncRNA的简介
(一)LncRNA的概念
LncRNA是长度≥200个核苷酸的非蛋白编码转录子[7]。结构与mRNA类似,但缺乏编码蛋白质的能力。在完成人类基因组计划(human genome project)之后,一些研究者表示,在人类的基因当中,仅不足3 万个可以编码蛋白质的基因,占据整个基因组的2﹪。其余的98﹪都是由非编码基因组序列所组成即ncRNA,数量非常庞大,细胞中复杂的RNA 调控网络就是由这些ncRNA组成的[3]。
(二)LncRNA的分类
细胞中的ncRNA 主要分为2种,分别是调节性ncRNA和管家ncRNA。以长度为依据,可以简单的将调节性ncRNA分为长链ncRNA(long noncoding RNA,LncRNA)和小分子ncRNA(small noncoding RNA,SncRNA)。根据其基因组位置可分为内含子、基因间、意义和反义类型,也可根据功能分为信号、诱导、引导和支架Lnc RNA。根据其与邻近蛋白编码基因的关系,可将其分为5种类型:(1)正义型LncRNA;(2)反义型LncRNA;(3)双向型LncRNA;(4)内含子型LncRNA;(5)基因间型LncRNA[8]。
二、LncRNA在肝癌发生中的作用
研究证实在肝癌患者中稳定存在许多特异性表达的LncRNA,这表明LncRNA 可能成为一种新的非侵入性的肝癌早期诊断、发病风险及预后评估的肿瘤标志物。本文将LncRNA在肝癌发生中的作用进行归纳(表1)。
三、LncRNA在肝癌发生、发展过程中的作用机制
LncRNA的种类多、功能广泛、分子调控机制复杂和绝大多数功能机制尚未知晓,现从表观遗传学调控、转录调控和转录后调控3个方面加以阐述,为今后基于LncRNA在HCC中的潜在作用提供理论依据。
(一)表观遗传学调控
1.DNA甲基化:LncRNA DLX6-AS1的上调能够通过增加细胞黏附分子1(cell adhesion molecule 1,CADM1)基因启动子甲基化导致CADM1 表达的降低,从而激活肝细胞肿瘤调节因子3(signal transduction and transcriptionan 3,STAT3)信号传导[22]。研究表明CADM1 对肝癌患者的STAT3 具有抑制作用[23]。抑制STAT3 信号通路能够抑制细胞增殖而诱导细胞凋亡来调节HCC患者的肿瘤生长。因此,LncRNA DLX6-AS1的下调抑制了CADM1启动子甲基化,增加了CADM1的表达,抑制了STAT3 信号通路的激活,最终降低了肝癌干细胞(liver cancer stem cells,LCSCs)中CD133和CD13的表达,抑制了LCSCs的进展[24]。研究结果表明LncRNA DLX6- AS1 可作为LCSCs的致癌基因,沉默的DLX6-AS1 有助于降低CADM1启动子的甲基化和STAT3 信号通路的失活,从而对肿瘤发生发展起抑制作用。因此,LncRNA DLX6-AS1 可以作为治疗HCC的新型生物标志物[24]。
缺氧反应长链非编码RNA(translation regulatory long non-coding RNA 1,TRERNA1)募集EHMT2 至CDH1启动子区域中的H3K9 二甲基化促进细胞转移和HCC的侵袭。EHMT2是一种负责组蛋白第三亚基四号赖氨酸的二甲基化(Di- methylation of lysine 9 of histone H3,H3K9me2)甲基化的主要常染色质甲基转移酶,可以募集转录细胞生物学过程中的因素[25]。因此,靶向LncRNA TRERNA1 可能是转移性HCC的新型治疗策略[26]。
miR-372 基因启动子可以通过 DNA甲基化诱导 HCC中 miR-372的表观遗传沉默来调节靶基因的甲基化状态,从而抑制癌细胞的增殖和侵袭[26]。例如,LncRNA PVT1 通过诱导miR-146a的甲基化来调节癌细胞的生长。LncRNA DBCCR1-003 通过诱导 miR- 372 甲基化使DBCCR1 基因的表达升高[28]。
有研究发现PCAT-14 可以上调DNA甲基转移酶 1、DNMT3a和DNMT3b的表达,甲基化特异性PCR(methylmion specific PCR,MSP)分析表明,PCAT- 14 过表达可以促进miR-372 CpG 岛的甲基化[29]。这些发现表明,在HCC 细胞中,PCAT- 14 通过诱导启动子中CpG 岛的甲基化,抑制miR-372的表达[31-32]。此外,miR-372的过表达或下调消除了PCAT-14 对SMMC7721和HepG2 细胞中细胞增殖,侵袭和细胞周期的影响。提示PCAT-14 通过 miR-372 调控肝癌细胞[30]。
此外,有证据表明 HBx 通过上调 DNA甲基转移酶1,DNMT3 A1和DNMT3 A211 选择性地促进特定肿瘤抑制基因(tumor suppressor genes, TSGs)的高甲基化,从而影响 DNA甲基化[31]。HBx还通过将DNAC1、DNMT3L和DNMT3a 募集到启动子来下调其表达从而下调CpG 岛的表达[32]。组蛋白修饰的状态与基因转录活性有关,例如组蛋白甲基化或乙酰化[33]。HBx 将CREB 结合蛋白(calcium binding protein,CBP)/p300和HDAC1 募集到启动子以诱导或抑制靶基因表达。HBx 能够上调甲基转移酶SMYD3 及其反式激活的致癌基因。
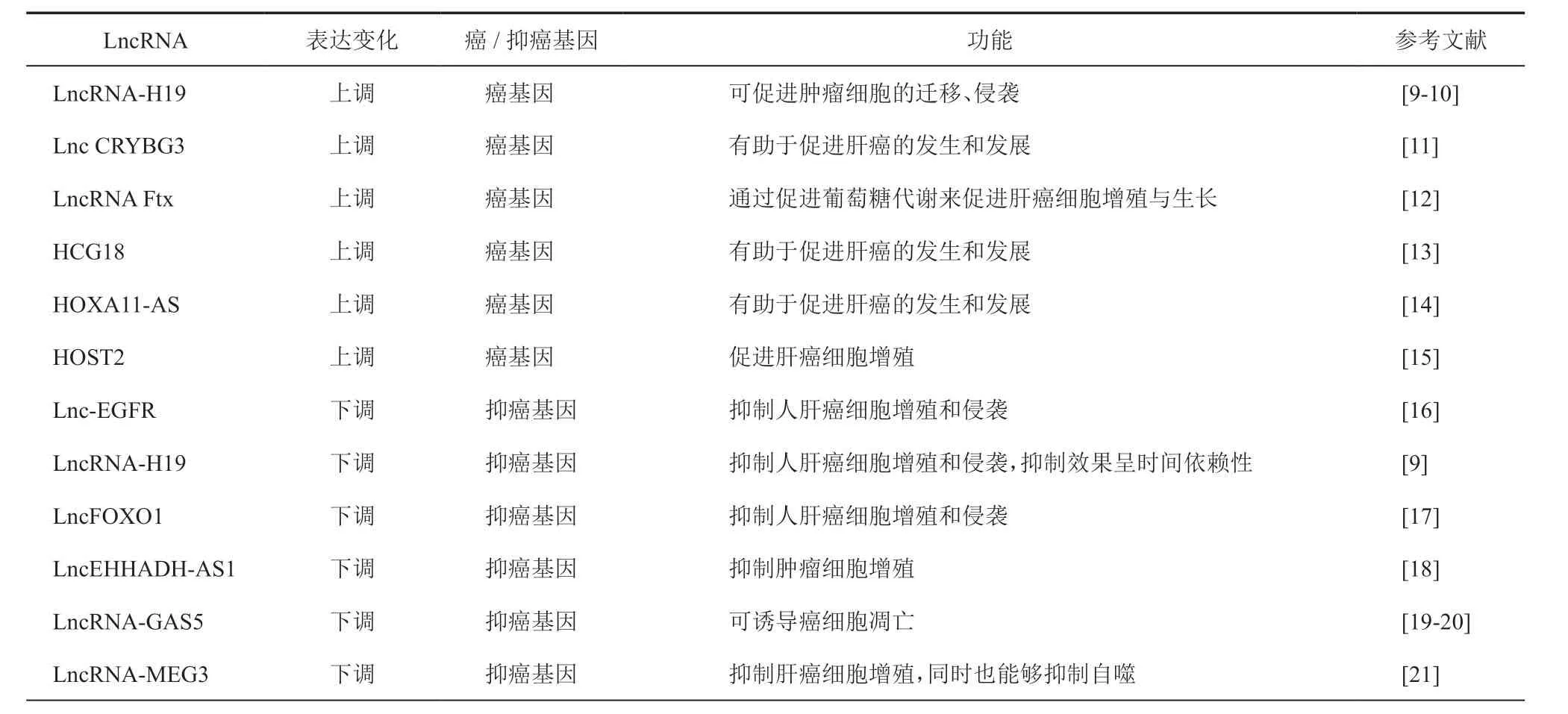
表1 LncRNA 对肝癌细胞的调节功能
2.组蛋白修饰:研究发现LncRNA NEAT1_2 与miR-101-3p 相互作用可以增加WEE1基因的表达。WEE1是一种酪氨酸激酶,被确认为miR-101-3p的直接靶标[35]。miR-101-3p的上调降低了WEE1的mRNA和蛋白水平,而antamiR-101-3p的转染则表现出相反的效果[36]。许多研究表明miR- 101- 3p 在人类癌症发展中成为必需的调节剂。例如,miR- 101-3p 可以作为HCC的诊断生物标志物。miR-101-3p在胶质瘤组织和细胞中下调,其表达与胶质瘤患者的肿瘤分级和预后不良呈负相关[37]。此外,miR-101-3p的异位表达通过靶向MALAT-1 抑制PI3K/AKT 信号通路,使癌细胞的增殖,迁移和侵袭得到抑制[38]。因此,靶向LncRNA NEAT1_2可能成为HCC 治疗的新靶点[39]。
另外,研究发现HOTAIR 可通过激活mTOR 诱导SNAP23的磷酸化。重组人突触相关蛋白23kDa(recombinant human synaptosomal-associated protein 23kDa,SNAP23)是一种突触前膜上的靶蛋白(t-SNARE)分子,具有重要的介导功能[40]。HOTAIR 通过诱导多泡体(multivesicular body,MVB)转运至质膜促进外泌体释放,调节RAB35 表达和定位,控制对接过程。RAB35是控制MVB 转运的重要调节因子[41]。研究结果表明,HOTAIR 通过调节RAB35 表达来调节MVB的转运。MVB 膜上的一个v-SNARE 与质膜上的t- SNARE 结合,形成SNARE 复合物,控制外泌体的释放,HOTAIR 诱导了SNAP23 在质膜上的扩散位置。此外,研究发现HOTAIR 过表达促使VAMP3 与SNAP23 共定位。这些结果表明HOTAIR 参与SNARE 复合物的形成以促进与质膜的MVB 融合[42]。SNAP23的磷酸化是胞吐作用所必需的,并促进其与其他SNARE 蛋白的结合。这些结果发现了HOTAIR 调节SNARE 复合物促进外泌体分泌的复杂机制[43]。
LncRNA TPTEP1 可以直接结合STAT3 并抑制IL-6 诱导的STAT3 磷酸化。IL-6/STAT3 信号传导在HCC 进展中起重要作用。肿瘤相关巨噬细胞通过激活IL-6/STAT3 信号传导促进人HCC 干细胞的扩增,并诱导OCT4/NANOG 表达导致HBV相关性HCC 预后不良[44]。
(二)转录调控
研究发现LncRNA MIR22HG 在肝细胞癌中起到肿瘤抑制剂的作用,并且通过竞争性内源RNA 来调节miRNA- 10a-5p水平。此外,NCOR2被证实充当MIR22HG/miR- 10a-5p的下游靶基因[45-46]。NCOR2的过表达降低了TOP/FOP 活性,表明在HCC 细胞中NCOR2 抑制了Wnt/β-连环蛋白途径。因此,研究证明MIR22HG 部分通过miR- 10a- 5p/NCOR2 信号轴抑制HCC 进展,并且可能作为HCC患者的预后新生物标志物[47-48]。
肝癌中有一种特殊的LncRNA,ZEB1- AS1 可以竞争性地与miR-365a-3p 结合,解除miR- 365a- 3p 对E2F 转录因子2(E2F2)的抑制作用,导致E2F2 表达增加,促进肝癌细胞增殖[49]。研究表明miR- 365 在不同类型的癌症中具有肿瘤抑制作用,miR-365的过表达通过直接靶向Bcl-2 抑制肝癌的生长和诱导凋亡[50]。ZEB1- AS1 作为miR- 365a-3p的ceRNA,可以正向调控miR- 365a- 3p的靶基因E2F2的表达,肝癌组织中ZEB1-AS1 水平与E2F2 表达呈正相关,说明ZEB1- AS1 与E2F2 转录本之间存在潜在的正调控关系[51]。此外,生物信息学分析ZEB1-AS1和E2F23'UTR 具有相同的miR-365a-3p 识别位点[52]。这些结果表明,ZEB1- AS1在物理上与miR-365a-3p 相关,而miR-365a- 3p 则以E2F23'UTR为靶点降解RNA 或抑制翻译。ZEB1- AS1 沉默可导致E2F2mRNA和蛋白水平下降,而抑制miR-365a- 3p可使E2F2mRNA和蛋白水平下降[50]。这可能是由于ZEB1- AS1 与miR-365a-3p 竞争性结合,导致miR-365a-3p在抑制E2F2 过程中功能丧失[50]。尽管耗尽ZEB1-AS1 对miR- 365a- 3p 总表达几乎没有影响,但ZEB1-AS1 过低可能导致miR- 365a- 3p 水平升高,从而降低E2F2 表达水平[53]。因此,LncRNA 可通过物理碱基配对结合影响microRNA(miRNA 或miR)活性,作为竞争性内源性RNA(ceRNAs)间接调控miRNA 靶点的表达。
FOXD2-AS1通过miR-150-5p调节TMEM9的表达,miR-150-5p 抑制miR-150-5p介导的TMEM9mRNA降解。此外,双荧光素酶测定证实FOXD2- AS1增加TMEM9 表达并抑制肝癌细胞中的Nrf2 信号传导途径,并且这些作用被miR- 150- 5p部分阻断。这些结果表明FOXD2-AS1 通过miR-150-5p/TMEM9 途径调节Nrf2 信号传导途径,从而抑制肝癌细胞的发生与发展[47]。
LncRNA FEZF1-AS1 可以促进肝癌细胞的增殖、迁移和侵袭。而miR-4443的过表达则抑制了HCC中FEZF1- AS1的表达。因此,FEZF1-AS1通过调节miR- 4443促进HCC细胞增殖,迁移和侵袭[54]。
(三)转录后调控
肝癌细胞中ASLNC02525 基因的下调抑制了癌细胞的增殖和侵袭[55]。在这一过程中,转录因子Twist1的表达水平降低,但转录水平没有变化。根据生物信息学分析,ASLNC02525可能在hsa-miRNA-489-3p失活Twist1 调控中发挥重要作用。研究表明,ASLNC02525 作为RNA海绵打破了hsa-miRNA-489-3p 对Twist1的负调控,一旦ASLNC02525 沉默,高表达的hsa-miRNA-489- 3p 恢复了对Twist1的调控,抑制了肝癌细胞的增殖和侵袭。ASLNC02525在肝癌细胞中的沉默表达与转录因子Twist1的表达及ASLNC02525的下调呈正相关。ASLNC02525的高表达破坏了hsa- miRNA-489- 3p 像RNA 分子海绵一样调控Twist1,导致细胞转化和耗损。ASLNC02525 影响Twist1 蛋白表达而不影响转录,提示ASLNC02525 沉默可能改变Twist1的转录后调控,由于miRNA是常见的转录后调控因子,因此ASLNC02525的异常表达可能会破坏miRNA 对Twist1的某些调控[56]。
四、总结和展望
HCC 发生的分子机制非常复杂,涉及细胞周期失调、凋亡、肿瘤细胞侵袭和转移之间的相互作用。HCC在全球的发病率逐年升高,而且发病逐渐年轻化,不断威胁着人类的健康与生命。因此,阐明肝癌的分子机制,对提高HCC的成活率具有重要意义。LncRNA的内在功能是通过作为引导、链、诱饵和支架与DNA、RNA和蛋白质相互作用,为调控基因表达提供了依据,包括表观遗传、转录调控和转录后调控等方式。以上研究表明LncRNA 通过调节细胞增殖、衰老、迁移和凋亡等关键细胞过程,对正常生理和基因表达调控具有重要意义。尽管LncRNA在肝癌的作用机制和临床应用尚待研究,但是现有的研究结果已经表明LncRNA在肝癌过程中的发挥重要调节作用,并有希望成为肝癌治疗新靶点。1 李海波,符洪源,陆桐宇等.肝移植领域2017年度重要进展盘点[J].器官移植,2018,9(1):41-50,82.2 Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.3 胡倩,姚和瑞.长链非编码RNA与肿瘤研究现状[J].中华肿瘤防治杂志,2014,21(21):1746-1750.4 王明娟,周晓慧,江小华.长链非编码RNA与肿瘤发生发展关系的研究进展[J].临床和实验医学杂志,2015,14(5):431-433.5 Washietl S,Kellis M,Garber M.Evolutionary dynamics and tissue specificity of human long noncoding RNAs in six mammals[J].Genome Res,2014,24(4):616-628.6 Tamura M,Hendrix D K,Klosterman P S,et al.SCOR:Structural Classification of RNA,version 2.0[J].Nucleic Acids Res,2004,32 (Database issue):D182-D184.7 Rinn JL,Chang HY.Genome regulation by long noncoding RNAs[J].Annu Rev Biochem,2012,81(1):145-166.8 黎梨,邓凤莲,黄赞松,等.长链非编码RNA-H19调控人肝癌HepG2细胞增殖与凋亡[J].右江民族医学院学报,2019,41(1):15-19.9 Li L,Han T,Liu K,et al.LncRNA H19 promotes the development of hepatitis B related hepatocellular carcinoma through regulating microRNA-22 via EMT pathway[J].Eur Rev Med Pharmacol Sci,2019,23(12):5392-5401.

