免疫细胞衰老表现及免疫功能变化的研究进展
黄丽映 刘韬
近年来,人口老龄化已逐渐成为社会关注的焦点,而衰老与感染性疾病、心血管疾病、神经退行性疾病、自身免疫失调性疾病、肿瘤等疾病的发生率升高直接相关。机体衰老伴随着免疫功能的紊乱是这些疾病发生的重要原因之一。因此,免疫与衰老之间的关系逐渐受到各领域学者的关注[1]。衰老是个复杂的过程,表现为生理结构完整性的逐渐丧失,导致机体功能损害和死亡易感性增加。近年来,学术界提出了衰老的共同特征,主要表现为慢性低度炎症即炎症性衰老、基因组不稳定性、端粒磨损、表观遗传改变、蛋白质平衡丧失、营养传感失调、线粒体功能障碍、细胞衰老、干细胞衰竭以及细胞间通讯的改变[2]。免疫衰老通常定义为机体的先天性和适应性免疫系统发生与年龄相关的结构和功能改变[3]。目前研究表明衰老对适应性免疫系统的影响大于对先天性免疫系统的影响,可通过免疫细胞衰老相关标志物表达的改变、细胞因子分泌量的变化、细胞亚群的变化和细胞功能缺陷来体现[4-5]。同时免疫监视功能受损会加速衰老细胞的积累,进一步加速衰老的进程[6]。基于现有的衰老理论仍存在一定不完整性,人体免疫系统平衡的调控具有复杂性,为了满足日益增长的老年人口健康相关需求,对年龄相关性免疫衰老的研究迅速发展。同时,对免疫衰老指标的量化有助于评估机体免疫功能状态,对健康管理、重大疾病的预防和指导临床治疗决策具有重要意义。
一、衰老相关的T细胞改变
1.衰老相关的T细胞亚群及其免疫功能的变化:衰老会影响免疫系统的所有细胞,尤其是T细胞更容易受到衰老过程的影响[7]。幼稚CD4+T和CD8+T淋巴细胞均起源于胸腺,通常表达CD45RA 分子、趋化因子受体(chemokine receptor 7,CCR7),同时分泌大量白细胞介素2(interleukin 2,IL-2)等细胞因子。这群细胞在抵御病原体和清除恶性细胞中起着主要作用。然而随着机体的衰老,胸腺开始逐渐退化,T细胞的发育、分化和成熟出现障碍,表现为胸腺向外周输出幼稚T淋巴细胞数目减少,同时CD8+T细胞数量比CD4+T细胞下降快[8]。大量研究表明由于体内外各种抗原的刺激增加,特别是巨细胞病毒(cytomegalovirus,CMV)感染与效应型记忆T细胞(effector memory T cell,TEM)增加有密切的联系,使外周血中幼稚淋巴细胞活化成记忆性淋巴细胞,并在体内长期存在[9-10]。这一过程导致随年龄增长,记忆性CD4+和CD8+T淋巴细胞数目增加,使其对新抗原的反应能力降低,同时表达CD45RO 分子增加,分泌肿瘤坏死因子α(tumor necrosis factor -α,TNF-α)、白细胞介素4(interleukin 4,IL-4)、白细胞介素5(interleukin 5,IL-5)、干扰素γ(interferon,IFN-γ)和细胞毒性分子如穿孔素和颗粒酶等[11](表1)。此外,调节性T细胞(regulatory T cell,Treg)和辅助性T细胞(helper T lymphocyte,Th)也发生了年龄相关性的变化,衰老过程中Treg和Th 细胞数量增加,其中,幼稚CD4+T细胞有分化为不同Th 细胞亚群的能力,衰老个体中幼稚CD4+T细胞分化为Th9 细胞增多,分泌标志性细胞因子白细胞介素9(interleukin 9,IL-9)增加。主要是由于机体内幼稚CD4+T细胞表面的转化生长因子-β 受体3(transforming growth factor β receptor 3,TGF-βR-3)上调,对转化生长因子-β(transforming growth factor β,TGF-β)的刺激应答反应增强;其次,核转录因子谱发生了变化,包括碱性亮氨酸拉链转录因子(basic leucinezippertranscription factor,BATF)和干扰素调节因子(interferon regulatory factor 4,IRF-4)表达增强,分化抑制因子3(inhibitor of differentiation 3,ID-3)和B细胞淋巴瘤基因6(B cell lymphoma 6,BCL-6)表达减少,也有利于Th9 细胞的分化[12-13]。IL-9是介导各种炎症反应的重要细胞因子,参与自身免疫性疾病、炎症性肠病和肿瘤等疾病的发生,可能加速机体衰老的进程[14]。同时Th1、Th2 细胞分泌的细胞因子减少,CD8+T细胞的增殖能力和细胞毒性均下降,使机体抵御外界病原体的能力下降[4]。
2.T细胞衰老相关标志物:根据T细胞表型和功能差异,不能将衰老的T细胞与长期抗原刺激诱导的功能衰竭T细胞混淆。T细胞衰老不等于T细胞功能耗竭[8]。衰老的T细胞具有有限的增殖能力,主要是由于端粒长度的缩短和端粒酶的丧失,从而产生更少的IL-2,进一步降低这些细胞的增殖[15]。T细胞衰老最有特征性的改变是CD28和CD27等共刺激分子的表达缺失,同时高表达如杀伤细胞凝集素样受体亚家族G1(killer cell lectin-like receptor subfamily G,member1,KLRG-1)和CD57 等标志物[16-17]。自然杀伤族2D 受体(naturekillergroup2D,NKG2D)在CD4+T淋巴细胞中的表达是免疫系统衰老重要标志之一[7]。而免疫细胞耗竭常见于慢性感染和癌症患者体内免疫细胞功能的丧失,主要是由于长期暴露于持续性抗原和炎症,精疲力竭的免疫细胞逐渐失去效应功能,记忆性免疫细胞特征也开始缺失。功能耗竭的T细胞高表达如程序性细胞死亡受体1(programmed cell death 1,PD-1)、淋巴细胞活化基因3(lymphocyte activation gene 3,LAG-3)、T细胞免疫球蛋白黏蛋白3(T cell immunoglobulin mucin 3,TIM-3)和细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocyte-associated protein 4,CTLA-4)等标志物(表1);其次,衰老的T细胞受到刺激能分泌高水平的炎性细胞因子,而功能耗竭的T细胞受到刺激后既不能增殖也不能分泌细胞因子;最后,衰老T细胞具有不可逆性,而功能耗竭T细胞具有一定可逆性[1,18]。这些均表明衰老T细胞与功能耗竭T细胞指的是两种不同的细胞状态,有助于进一步评估机体免疫功能状态。

表1 衰老过程中T细胞的变化
二、衰老相关的NK细胞改变
1.衰老相关的NK细胞亚群及其免疫功能的变化:NK细胞是由CD3-CD16+CD56+表面表型所定义的细胞毒性淋巴细胞群,约占循环淋巴细胞总数的7﹪~15﹪,参与肿瘤细胞和病毒感染细胞的识别和裂解[4]。NK细胞主要通过产生各种效应细胞因子和直接细胞毒性作用发挥功能。其中分泌的IFN-γ 可直接增强靶细胞免疫原性,促进适应性免疫应答,细胞毒性活动依赖于颗粒酶和穿孔素,从而在固有免疫应答中发挥重要作用[19]。NK细胞免疫衰老的特点是NK细胞亚群的重新分布,激活性受体的表达减少,细胞毒性降低。根据CD56 表面表达的相对密度,可以将NK细胞分为CD56dim和CD56bright2个表型和功能不同的亚群。随着年龄的增长,以分泌细胞因子为主的CD56bright不成熟NK细胞逐渐下降,从而影响其他免疫细胞的信号传导和募集;同时以杀伤功能为主的CD56dim成熟NK细胞不断增多并开始表达CD57,但对IL-2 等细胞因子的增殖反应性降低[20](表2)。这些研究表明NK细胞在衰老过程中发生表型和功能向成熟状态转移的现象,但CD56dimNK细胞数量的增加并不会增强NK 整体的细胞毒性作用[21]。有研究表明衰老对自然或CD16 依赖性NK细胞毒性所涉及的信号转导通路有不同程度的影响,老年人NK细胞裂解活性下降的原因可能与NK细胞与靶细胞相互作用后释放三磷酸肌醇的能力下降以及4,5 二磷酸脂酰醇的延迟水解有关[22-23]。
2.NK细胞衰老相关标志物:NK细胞毒性是激活性和抑制性受体之间保持良好平衡的结果[22]。随年龄增长,CD56dimNK细胞继续分化,在此过程中,NK细胞表面的激活性受体如NKG2D 表达增加,而NKG2C 表达减少,同时NK细胞表达抑制性受体NKG2A 减少,免疫球蛋白样杀伤受体(killer cell immunoglobulin-like receptor,KIR)、CD57和CD16的表达均增加[24-26]。有研究表明,在某些肿瘤和慢性感染患者中,NK细胞表达PD1和TIM3 增加,不仅对T细胞功能具有抑制作用,对NK细胞功能也有一定的抑制作用,同时Treg细胞数量增加会抑制NKG2D在NK细胞上的表达,从而抑制NK细胞的功能[19]。终末分化的CD56dimNK细胞表面的HLA-DR和CD95 表达水平增高,而CD69、CD94表达均下降。此外,衰老相关性NK细胞表面抑制性和激活性受体失调的同时天然细胞毒受体(natural cytotoxicity receptors,NCRs)比如NKp30、NKP44、NKp46 等表达减少,而NKp30 参与了树突状细胞(dendritic cell,DC)介导的先天性和适应性免疫反应,造成NK细胞功能紊乱[10,26](表2)。
3.NK细胞释放细胞因子的变化:IL-2 主要是T细胞分泌的细胞因子,促进T细胞和NK细胞的增殖,是适应性免疫反应和NK细胞之间的主要桥梁。细胞因子如IL-2、IL-12、IFN-γ、干扰素α(interferon,IFN-α)等可以增强NK细胞的杀伤能力,然而随年龄增长,NK细胞对IL-2的增殖反应性明显减低,老年人中NK细胞分泌的IFN-γ、IFN-α、IL-13 等细胞因子减少,而分泌的IL-1、IL-4、IL-6、IL- 10、TNF-α 增加[21,23]。
三、衰老相关的B细胞变化
B淋巴细胞产生于骨髓,成熟于脾脏,同时B细胞负责抗体的分泌,在体液免疫中发挥重要的作用。随着年龄的增长,骨髓产生B细胞数量及受体多样性降低,产生抗体数目减少,这降低机体对感染和疫苗接种的反应性,并增加自身反应性抗体的产生[4]。此外,B细胞亚群也发生年龄相关性变化,初始B细胞及记忆B细胞(CD3-CD19+LgD+CD27-)数量降低,同时伴衰老的B细胞(CD3-CD19+LgD-CD27-)数量增加[28](表3)。记忆B细胞产生高水平的炎症性细胞因子IL-1、IL-6和TNF-α 等,提示B细胞可能参与老年人炎症环境的生成和维持[29]。

表2 衰老过程中NK细胞的变化
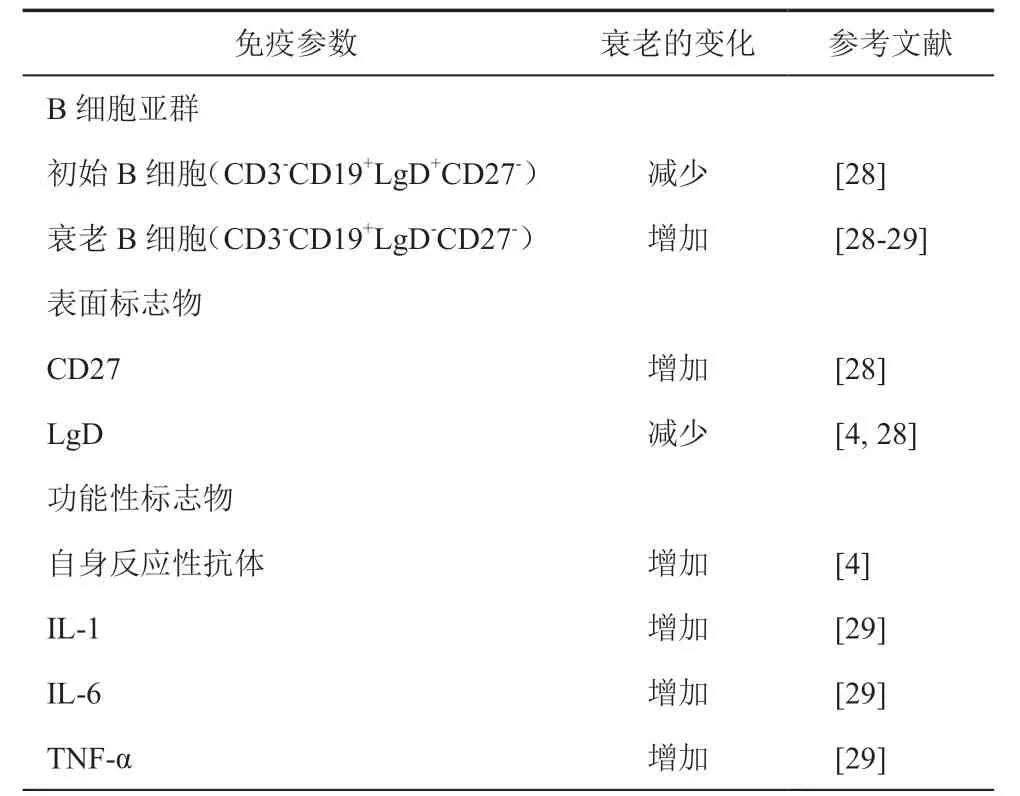
表3 衰老对B细胞的影响
四、衰老相关的DC、中性粒细胞和单核巨噬细胞变化
DC是体内功能最强的抗原提呈细胞(antigen presenting cell,APC),是沟通先天和适应性免疫反应的主要桥梁。老年人的髓样DC 表达PI3K的活性降低,吞噬活性和趋化性能力下降,同时浆细胞样DC 产生Ⅰ型和Ⅱ型的干扰素减少,抗原提呈能力下降。中性粒细胞、单核巨噬细胞功能的缺陷主要是随年龄变化的细胞信号失调介导的,细胞因子特别是IL-6和TNF-α 等炎性细胞因子的减少[20]。随着年龄增长,巨噬细胞趋化性、抗原提呈能力和吞噬作用减弱,出现M2 型巨噬细胞极化现象,Toll 样受体(toll-likereceptor,TLR)信号通路及其效应功能受损,从而增加了老年人对疾病的易感性。
五、衰老相关的骨髓源性抑制细胞(myeloid derived suppressor cells,MDSCs)变化
MDSCs是骨髓形成过程中由髓系祖细胞发育而来的一组免疫抑制性髓样细胞。随年龄增长,骨髓造血细胞分化为髓样细胞增多,在癌症、感染性疾病、创伤、骨髓移植和自身免疫性疾病等炎症条件下,MDSCs 向粒细胞、单核细胞、巨噬细胞和DC的骨髓成熟过程都会受到损伤,这可能有利于MDSCs的积累[15,30]。衰老过程与骨髓、血液、脾脏和周围淋巴结中MDSCs的增加有关。各种衰老的细胞可表达衰老相关分泌表型(senescence associated secreting phenotype,SASP),在许多病理状态下,分泌集落刺激因子(colony- stimulating factors,CSF)和各种趋化因子增多,激活宿主免疫反应同时刺激MDSCs的产生,使MDSCs 趋向炎症组织集中,发挥MDSCs 抑制急性炎症反应的作用,在许多慢性疾病中,MDSCs 呈现抑制宿主免疫防御从而减缓疾病进展[31]。研究表明,MDSCs是随着年龄增长而显著增加的特殊免疫抑制因子,是适应性免疫系统衰老的有效诱导因子,而T细胞是MDSCs 诱导免疫耐受的主要靶细胞[4],这些细胞可以分泌IL-10、TGF-β、活性氧(reactive oxygen species,ROS)等有效的抗炎和免疫抑制因素,抑制T细胞的增殖和功能,导致幼稚T细胞数量逐渐减少,允许肿瘤免疫逃逸[32]。同时MDSCs的扩增也会通过抑制IL-2 介导的NK细胞毒性作用,进一步降低NK细胞功能,加速机体免疫系统的衰老[19](图1)。
六、免疫细胞衰老与年龄相关性疾病的关系
许多研究表明衰老个体伴随着慢性非特异性炎症状态[33]。其表现为外周血中炎性标志物的升高,包括C 反应蛋白(C-reactive protein,CRP)、IL-18、TNF-α和IL-6 等[34]。同时,慢性炎症状态是许多慢性疾病如糖尿病、心血管疾病和神经退行性疾病发生的重要危险因素,影响疾病进展和导致并发症的发生[35]。
1.免疫细胞衰老与神经退行性疾病:阿尔茨海默症(alzheimer disease,AD)是一种进行性神经退行性疾病。最近研究表明淀粉样蛋白沉积和神经纤维缠结不能完全解释AD的发病机制,并提出持续性病毒感染及炎症性衰老可能在AD 中起着关键作用[36]。机体衰老过程中,持续性抗原刺激适应性免疫系统,使记忆性T细胞增加,CD28 共刺激受体表达缺失,CD4+CD28-T细胞分泌IFN-γ 增多,激活小胶质细胞过度分泌炎性细胞因子[36-37]。而小胶质细胞对β 淀粉样蛋白(amyloid beta peptide,Aβ)的吞噬能力严重下降,Aβ 具有抵抗微生物的防御因子作用,参与小胶质细胞的活化,协同刺激先天性免疫应答产生大量炎症性因子[5,36],导致神经元的破坏和动脉斑块的形成,进一步加重脑组织炎症状态,从而促进AD的发展。此外,记忆性B细胞和DC 细胞分泌IL-6、IFN-γ和TNF-α的基础水平在老年人中升高,形成的慢性低度炎症与动脉粥样硬化所致的帕金森病、AD 等神经退行性疾病有密切联系[38]。因此,随着年龄的增长,免疫系统的改变会导致低度炎症,这可能有助于AD的发展。
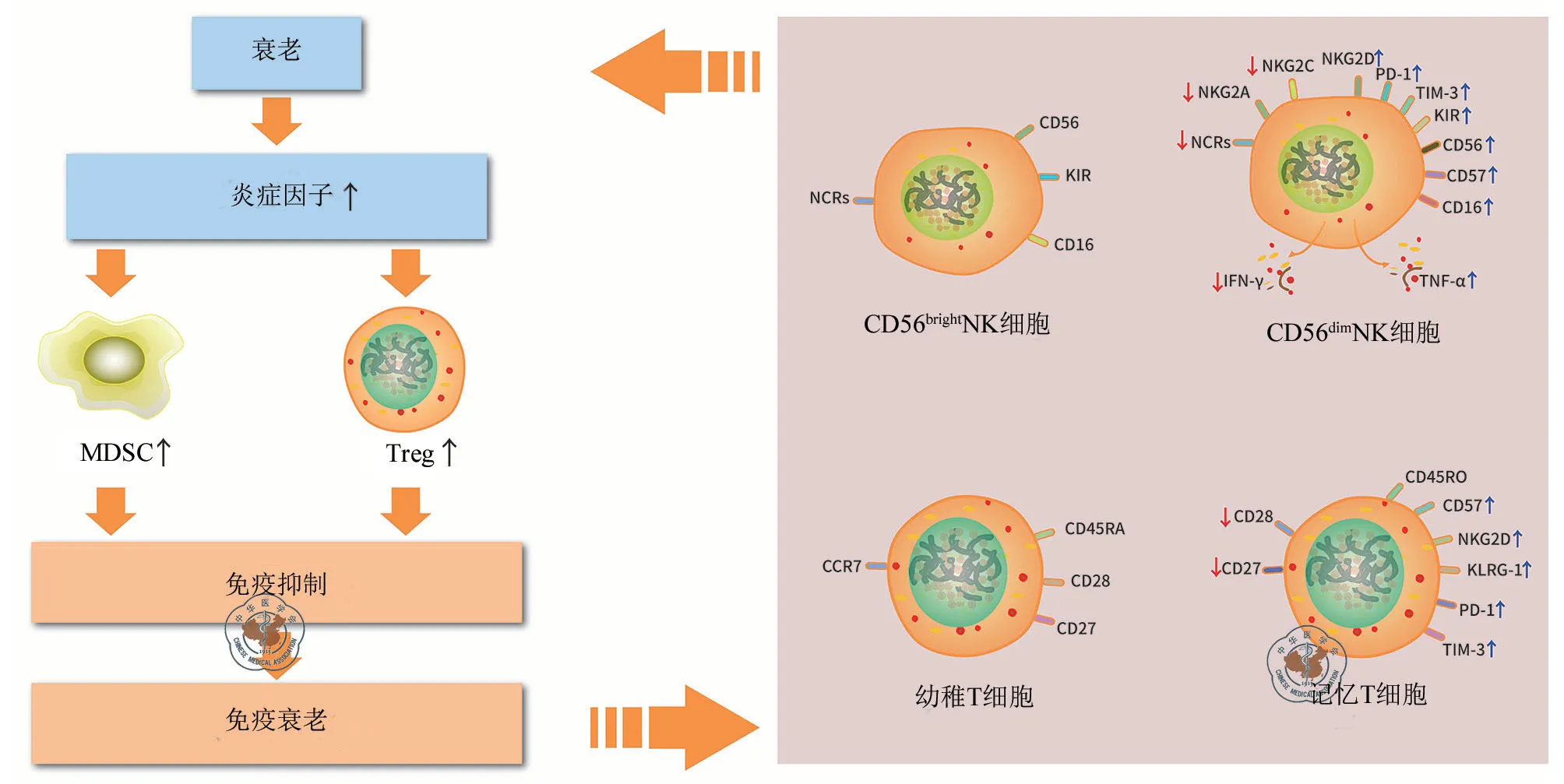
图1 骨髓源性抑制细胞介导机体衰老的过程
2.免疫细胞衰老与心血管疾病:免疫衰老过程中T细胞亚群的变化可能有助于动脉粥样硬化的发生和进展,动脉粥样硬化是一种典型的炎症性疾病,衰老免疫细胞表达衰老相关分泌表型(senescence associated secreting phenotype,SASP),分泌大量IFN-γ,刺激 CD4+T细胞的浸润和先天性免疫反应发生,进一步加重炎症反应,促进冠心病发展[5]。据报道,在慢性心力衰竭(chronic heart failure,CHF)病程中,单核细胞表达TLR-4 增加,可能与血浆中TNF、IL-6和IL-1 等促炎细胞因子的水平增加有关,可以预测CHF 患者的长期生产率,而随着年龄的增长,白细胞的TLR 系统也发生了类似的变化[5]。
3.免疫细胞衰老与糖尿病:糖尿病是老年人最常见的疾病之一。机体衰老过程中,氧化应激增加,血浆中IL-6、TNF和CRP 等炎症标志物升高,可导致一定程度的胰岛素抵抗,促进2 型糖尿病的发展[5]。免疫衰老细胞分泌IFN-γ 增加,介导自身免疫功能障碍,破坏胰岛β 细胞,参与1 型糖尿病的发生[39]。因此,糖尿病被认为是一种与免疫衰老相关的炎症性疾病。
4.免疫细胞衰老与自身免疫性疾病、癌症:B细胞根据来源不同可分为 B1、B2 两个亚群,B1 细胞主要产生自身反应性抗体,介导自身免疫性疾病如系统性红斑狼疮、类风湿性关节炎、Graves 病等疾病的发生发展,衰老个体中B1 细胞数量增加,与老年人自身免疫性疾病的发生率增高有关[40]。此外,免疫衰老会加速衰老细胞的积累,促进组织退化和恶性转化,导致肿瘤细胞出现免疫逃逸,加速癌症的发生发展进程[6]。因此,抑制机体免疫衰老有望成为肿瘤免疫治疗的新策略。
免疫细胞的衰老导致免疫系统整体功能的衰老。因此,免疫细胞的衰老与机体衰老之间联系密切,相互影响、相互促进。随年龄增长,先天性和适应性免疫系统发生细胞亚群和功能的改变,并表达相应的免疫衰老相关指标。因此,建立不同年龄段健康成人外周血淋巴细胞亚群的参考值范围,研究年龄相关性免疫细胞衰老标志物并量化,对机体进行量化的免疫评估,有助于筛选亚临床状态的人群和对重大疾病的预防,指导临床疗效的判定。另外,了解各种免疫细胞发生衰老的标志性改变和机制是进行临床干预的重要基础。在疾病治疗和预防方面,免疫评估将发挥重要的作用。近年来,免疫评估已经被引入恶性肿瘤综合治疗方案中,成为疗效评价和生存期预测的重要指标。上述指标的及时筛查,及时纠正可以最大程度的预防各种慢性疾病和肿瘤的发生,同时也是各类疾病预后的可量化评估指标,笔者希望进一步了解人类免疫细胞衰老和炎症如何与机体衰老相互作用,从而导致发病率和死亡率的增加,并找到改善老年人健康寿命的关键途径。

