国产西罗莫司与原研品在体内外对细胞影响的比较实验
马麟麟 谢林 黄霞 徐炳洋 陈刚
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是丝氨酸-苏氨酸蛋白激酶,参与细胞内多个信号通路的传导,影响细胞生长、增殖、代谢、自噬和血管生成等生物学重要过程[1]。西罗莫司(Sirolimus)是基于上述基础研发的免疫抑制剂“哺乳动物雷帕霉素靶蛋白抑制剂(mammalian target of rapamycin inhibitors,mTORi;商品名:雷帕鸣,Rapamycin,RAPA)” 已经在器官移植临床应用近20年,实验研究已经证实,西罗莫司对外周免疫细胞有影响和调节作用[2-3]。国产西罗莫司(商品名:宜欣可,Yixink,YXK)的抗排斥临床应用已超过十年,取得一定的疗效[4]。器官移植中,免疫抑制剂通过对免疫细胞的影响,达到免疫抑制抗排斥作用。原研品在移植宿主中的免疫调节和免疫细胞变化方面有大量研究[5]。而国产西罗莫司在临床应用证明效果良好的前提下,是否也具有上述对细胞学影响的基础研究和比较实验还很少。在当前国家鼓励和扶持国产仿制品药物研究与应用的政策前提下[6],本文拟比较国产西罗莫司与原研品对移植宿主体内免疫细胞以及体外细胞增殖的影响,进一步评价这两种药在体内外对细胞学影响的的一致性。
材料与方法
一、材料
C57BL/6 小鼠和BalB/c 小鼠(北京维通利华实验动物技术有限公司),手术前后常规饲养于同济医科大学器官移植研究所实验动物中心无菌隔离系统;人膀胱癌T24 细胞株(广州吉尼欧生物技术有限公司)。国产西罗莫司仿制品原粉50 mg/瓶(华北制药股份有限公司);原研品原粉50 mg/瓶(美国西格玛公司),两种药物均在有效期内使用。所使用全部流式细胞检测抗体和病理染色抗体以及相关试剂(美国BD、Backman、eBioscience公司);流式检测仪(美国BD公司)。
二、方法
(一)体外实验
国产西罗莫司与原研品均在无菌条件下用二甲基亚砜(dimethyl sulfoxide,DMSO)分别溶解成浓度为2 mmon/L的储存液备用。选用性质稳定、生长活跃的人膀胱癌T24 细胞株作为观察体外细胞培养中药物影响增殖活力的效应细胞。T24 细胞株常规方法复苏、传代、收集后计数,按1×105个/孔密度接种于96 孔板,贴壁后血清饥饿24 h 使细胞同步化。培养基中分别加入国产西罗莫司和原研品,其终浓度分别为100 nmon/L、1 μmon/L和2 μmon/L,以加入含有0.1﹪(V/V)的DMSO为对照,每个浓度组均设置5个平行,放置于5﹪二氧化碳培养箱37℃无振动孵育24 h 后,常规方法加入含有10﹪CCK- 8[2-(2- 甲 氧 基-4- 硝 苯 基)-3-(4- 硝 苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐]的不含血清1640 培养基常温孵育2 h 后,酶标仪450 nm波长进行比色测定,观察国产西罗莫司和原研品对mTOR的抑制,及比较两种药物对细胞活力变化的影响。
(二)建立小鼠心脏移植模型
1.实验动物及分组:移植受体为雄性C57BL/6小鼠,8~12周龄。移植心脏供体为雄性BalB/c小鼠,8~12 周龄。分组:对照无手术组(对照组)、移植无治疗组(Tx组)、移植+国产西罗莫司组(Tx+YXK组)、移植+原研品组(Tx+RAPA组),每组5 只。
2.建立小鼠颈部异位心脏移植模型。供体、受体小鼠均使用1﹪戊巴比妥钠腹腔注射麻醉。常规备皮、消毒。供体BalB/c 小鼠开胸游离、结扎相应血管后取出供体心脏,4℃冰盐水中保存。受者C57BL/6 小鼠右侧颈部切口,钝性分离暴露右侧颈部血管。供体主动脉与受体右侧颈总动脉用11-0 缝线行端-侧吻合,供体肺动脉与受体右侧颈外静脉行端-侧吻合。移植心脏恢复搏动后,关闭颈部切口。局部使用青霉素预防感染。37℃保温至动物苏醒。
3.造模后用药:Tx+YXK 组和Tx+RAPA组术后分别给予国产西罗莫司和原研品抗排斥治疗。治疗方案:C57BL/6 小鼠心脏移植手术第0、1、2、4、6、8、10 天分别予以国产西罗莫司及原研品腹腔注射,0.5 mg/(kg·d)[7]。对照组给予等剂量0.9﹪氯化钠腹腔注射,注射频次、时间和剂量同移植治疗两组。观察移植心脏搏动情况和实验动物生存状态。
4.取材:Tx组小鼠在移植后7 d 处死,Tx+YXK组和Tx+RAPA组在移植后10 d 处死,取颈部移植心脏组织,用4﹪多聚甲醛固定保存。取一半脾脏研磨制备脾细胞悬液用于流式细胞术实验;另一半与移植心脏一同保存用于病理检测。
(三)检测内容
1.脾脏单个核细胞分离及流式细胞检测术:常规方法获取各组小鼠脾脏,制备脾细胞悬液并依照BD 检测仪染色步骤及方法进行流式检测,采用BD FACS Calibur 仪器检测各抗原荧光信号。以CD11c+I-A+CD86+标记树突状细胞(dendritic cell,DC),以CD8a+标记CD8+淋巴细胞,以CD4+CD25+Foxp3+标记Treg 细胞。采用Flowjo 软件分析各免疫细胞数量。
2.组织病理学观察:常规病理组织学方法制备切片及免疫组化染色。对Tx+RAPA组和Tx+YXK组的移植心脏和脾脏行常规HE 及免疫组化染色,观察比较两组在组织病理学中免疫细胞的变化是否作用一致。免疫细胞组化染色标志:CD11c、CD11b、CD8、CD4、Foxp3和吲哚胺2,3-二氧化酶(Indouleamine 2,3-dioxygenase,IDO)。应用专业图像分析处理软件(Image-Pro Plus 6.0.Media Cybernetics,Inc.,Rockville,MD,USA)测定光密度值,免疫组化累积光密度值(IOD)分析方法:选取相同的棕黄色作为判断所有照片阳性的统一标准,灰度分析软件测定每张照片的免疫组化累积光密度值(IOD)的阳性率,每张染色切片拍照3个点,分析得出每张照片的累积光密度值(IOD)。统计分析两组免疫细胞的浸润异同。
三、统计学分析方法
采用SPSS 19.0 统计软件,SUVmax数据以x±s表示,两组间比较均采用两独立样本的t检验,脾脏流式细胞检测和免疫组化检测结果多组间比较采用单因素的方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
结 果
一、体外实验结果
与含0.1﹪(V/V)DMSO(对照)比较,在2 μmon/L 时T24 细胞活力最低,两种药物之间比较差异均无统计学意义(P>0.05,表1)。
表1 两种西罗莫司对T24 细胞活力影响的比较(±s,n = 5)
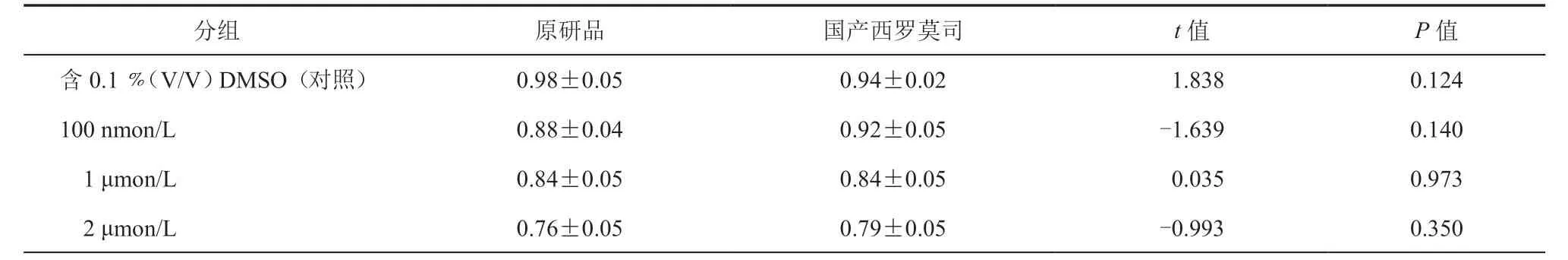
表1 两种西罗莫司对T24 细胞活力影响的比较(±s,n = 5)
注:n为实验重复次数
分组 原研品 国产西罗莫司 t 值 P 值含0.1﹪(V/V)DMSO(对照)0.98±0.05 0.94±0.02 1.838 0.124 100 nmon/L 0.88±0.04 0.92±0.05 -1.639 0.140 1 μmon/L 0.84±0.05 0.84±0.05 0.035 0.973 2 μmon/L 0.76±0.05 0.79±0.05 -0.993 0.350
二、体内实验结果
(一)移植心脏存活时间及脾脏长度
Tx组在术后第6天时移植心脏心跳减弱,第7 天心脏搏动基本消失。Tx+RAPA组和Tx+YXK组小鼠活跃、皮毛有光泽,第10 天心脏搏动仍有力、节律正常。Tx组脾脏标本长度(1.95 cm)大于Tx+RAPA组(1.65 cm)、Tx+YXK 组(1.45 cm)和对照组(1.4 cm)。(图1)
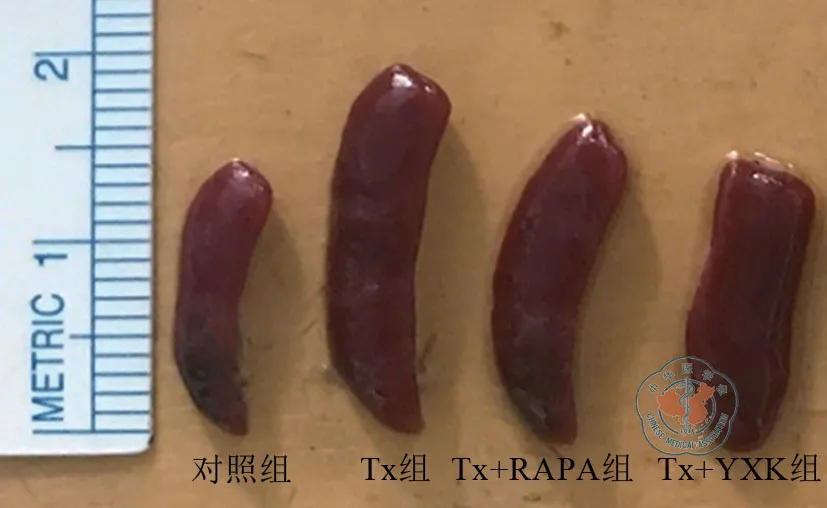
图1 各组脾脏大小比较
(二)脾脏免疫细胞流式细胞学检测结果
心脏移植后,多组间比较CD11c+I-A+CD86+DC、CD8+和CD4+CD25+Foxp3+三种免疫细胞数量,差异有统计学意义(P均<0.05)。与对照组比较,Tx组CD11c+I-A+CD86+DC 细胞 数量增多(P<0.05)。与对照组、Tx组比较, Tx+RAPA组和Tx+YXK组CD11c+I-A+CD86+DC细胞、CD8+淋巴细胞数量均降低,而Tx+RAPA组CD4+CD25+Foxp3+阳性细胞数量升高(P<0.05)。Tx+RAPA组和Tx+YXK 组三种免疫细胞数量差异均无统计学意义(P>0.05)。(表2)
(三)病理学检测
移植心脏HE染色发现,Tx组移植心脏心肌组织内大量淋巴细胞浸润,心肌纤维断裂,小血管壁内炎性细胞浸润,典型血管炎病理改变,符合急性排斥反应病理变化。Tx+RAPA组和Tx+YXK 组,经西罗莫司药物处理两组病理变化基本一致:小鼠移植心肌内淋巴细胞浸润数量明显少于Tx组,心肌纤维未见明显破坏,小血管炎症表现较轻或没有(图2)。
(四)病理组织免疫化学染色
1.移植心脏免疫组化染色:CD4、CD11c、CD11b 散在分布于心肌组织内,Tx+YXK 组数量多于Tx+RAPA组。与Tx组比较,Tx+YXK 组和Tx+ RAPA组Foxp3和IDO的阳性率较低,而CD8和CD11c 在心肌组织中的浸润较高呈散在灶状分布。Tx+RAPA组CD8 阳性细胞多于Tx+YXK 组(图3)。
对灰度分析结果进行方差分析比较显示,Tx组、Tx+YXK 组和Tx+RAPA组的CD4、CD8、IDO和CD11b 细胞数量差异无统计学意义(P>0.05),而CD11c和Foxp3 阳性细胞浸润数量比较差异有统计学意义(P= 0.003,0.013)。与Tx组比较, Tx+RAPA组和Tx+YXK 组CD11c、Foxp3 阳性细胞浸润数量降低,差异有统计学意义(CD11c:P= 0.002,0.003,Foxp3:P= 0.008,0.009)。Tx+YXK组和Tx+RAPA组比较差异均无统计学意义(P>0.05)。(表3)
表2 不同组心脏移植后脾脏流式细胞分析(﹪,±s,n = 5)

表2 不同组心脏移植后脾脏流式细胞分析(﹪,±s,n = 5)
注:Tx组为移植组;Tx+RAPA组为移植+原研品组;Tx+YXK 组为移植+国产西罗莫司组;与对照组比较,aP <0.05;与Tx组比较,bP <0.05;n为实验动物数
分组 CD11c+I-A+CD86+DC CD8+ CD4+CD25+Foxp3+对照组 15.88±4.73 6.32±0.98 7.87±1.95 Tx组 22.90±3.86a 6.75±1.34 10.88±2.08 Tx+RAPA组 4.51±1.57ab 3.03±1.12ab 15.06±3.42ab Tx+YXK 组 5.40±2.54ab 3.23±0.97ab 13.62±1.46a F 值 33.700 16.370 9.196 P 值<0.001<0.001 0.001
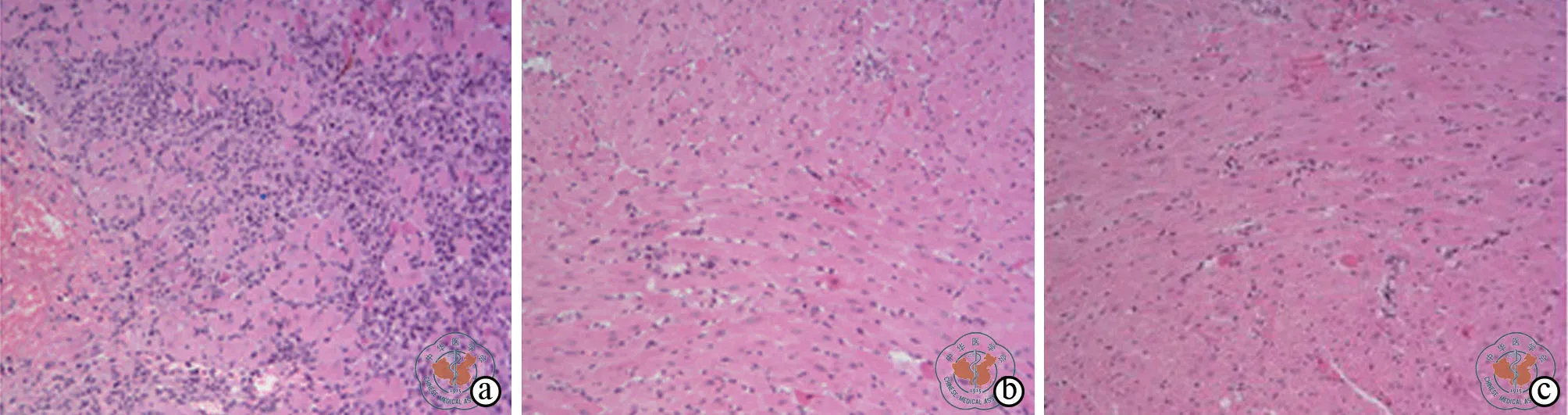
图2 光学显微镜下观察各组移植后心脏内心肌组织形态(HE 染色,×100)
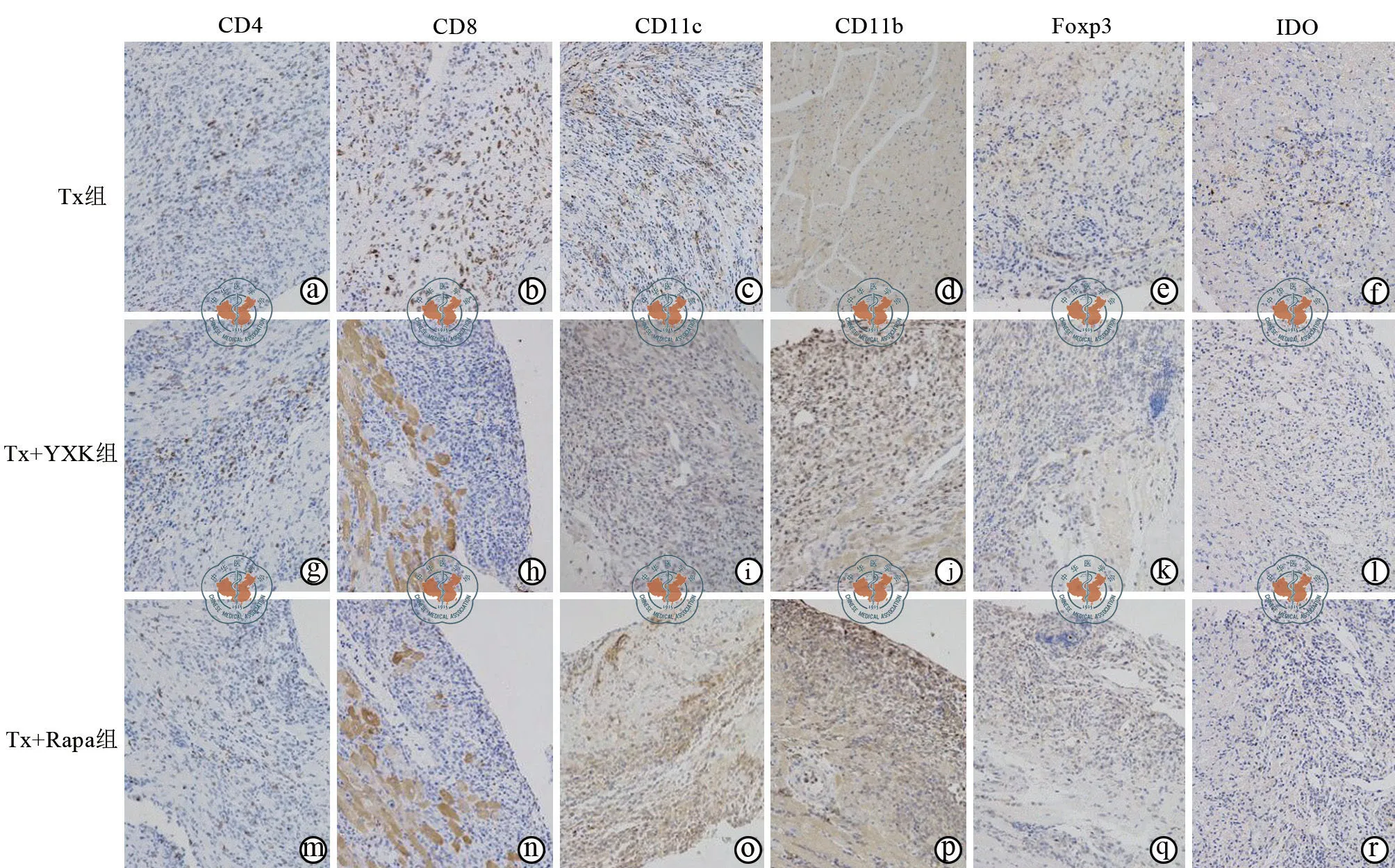
图3 光学显微镜下观察各组移植心脏不同免疫细胞的组化染色(×200)
2.模型动物脾脏免疫组化染色:脾脏组化染色与移植心脏的细胞浸润规律有所不同。CD4 阳性淋巴细胞主要分布在脾组织白髓内的淋巴小结中央区域,少数散在分布于边缘区;其他细胞呈散在分布,主要位于脾索和边缘区内(图4)。对6种细胞在脾脏中的浸润灰度进行单因素方差分析结果显示,CD11c、Foxp3、IDO和CD11b 阳性细胞的灰度值在三组间的差异有统计学意义(P<0.05);与Tx组比较,Tx+YXK 组和Tx+RAPA组CD11c、Foxp3和IDO 阳性细胞的浸润数量均降低,而CD11b的灰度值升高(P<0.05),CD 4和CD8 阳性细胞浸润数量升高,但差异无统计学意义(P>0.05)。Tx+YXK 组和Tx+RAPA组比较,各种细胞染色的IOD 值差异均无统计学意义(P>0.05,表4)。
表3 移植心脏病理免疫细胞组化染色灰度分析[IOD( SUM),±s,n = 3]
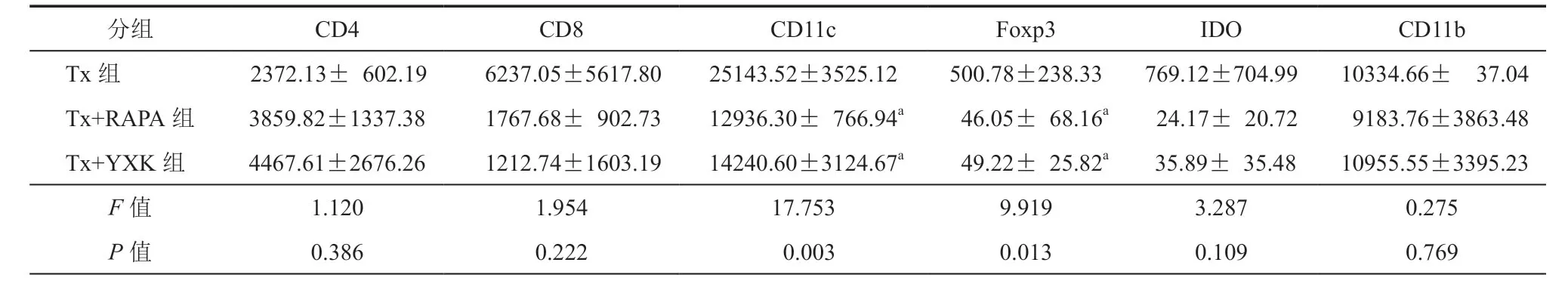
表3 移植心脏病理免疫细胞组化染色灰度分析[IOD( SUM),±s,n = 3]
注:Tx组为移植无治疗组;Tx+RAPA组为移植+原研品组;Tx+YXK 组为移植+国产西罗莫司组;LSD 两两比较结果:与Tx组(移植组)比较,aP <0.05;n为实验动物数
分组 CD4 CD8 CD11c Foxp3 IDO CD11b Tx组 2372.13±602.19 6237.05±5617.80 25143.52±3525.12 500.78±238.33 769.12±704.99 10334.66±37.04 Tx+RAPA组 3859.82±1337.38 1767.68±902.73 12936.30±766.94a 46.05±68.16a 24.17±20.72 9183.76±3863.48 Tx+YXK 组 4467.61±2676.26 1212.74±1603.19 14240.60±3124.67a 49.22±25.82a 35.89±35.48 10955.55±3395.23 F 值 1.120 1.954 17.753 9.919 3.287 0.275 P 值 0.386 0.222 0.003 0.013 0.109 0.769
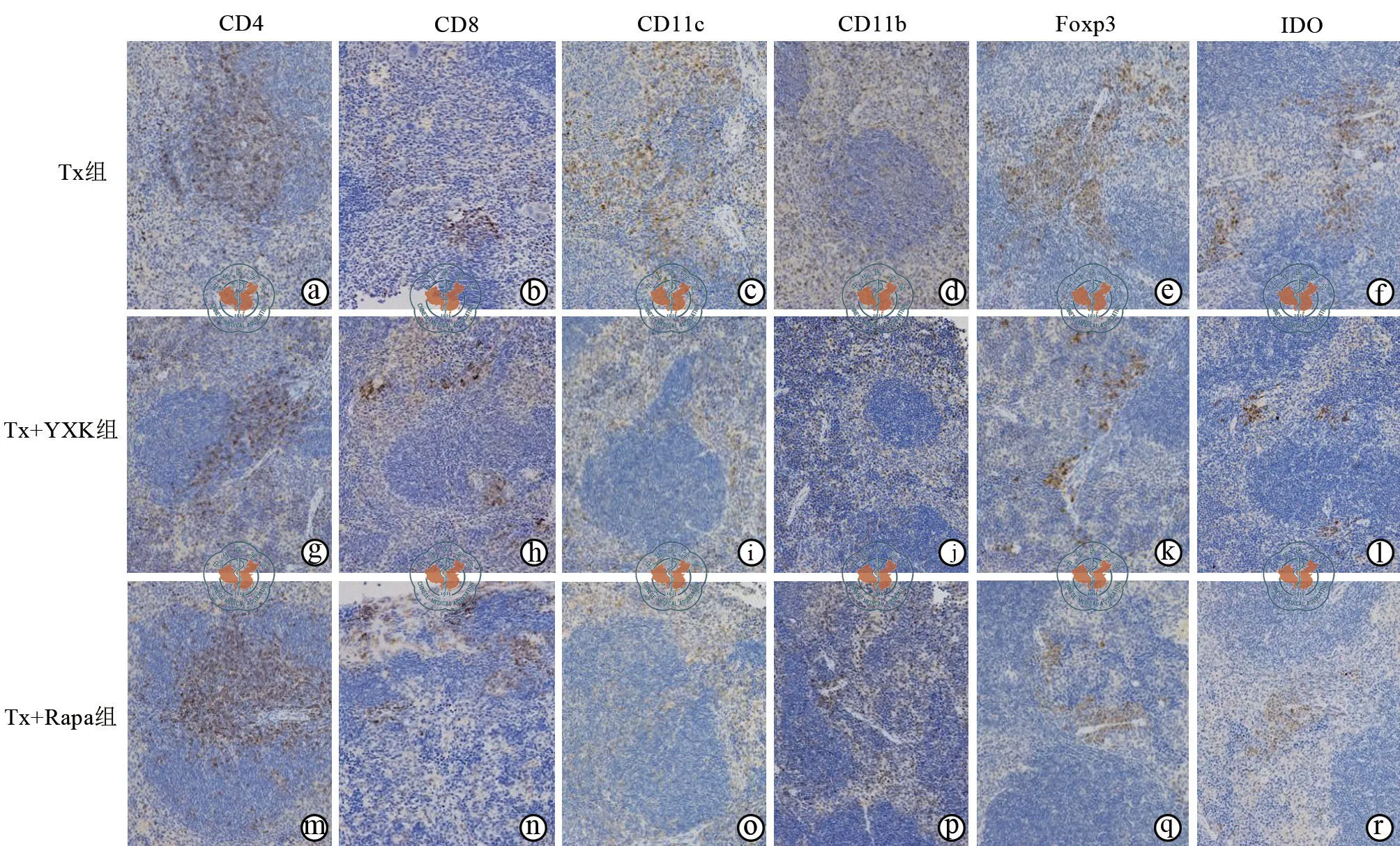
图4 光学显微镜下观察各组移植脾脏不同免疫细胞的组化染色(×200)
表4 模型动物脾脏病理免疫细胞组化染色灰度分析[IOD( SUM),±s,n = 3]
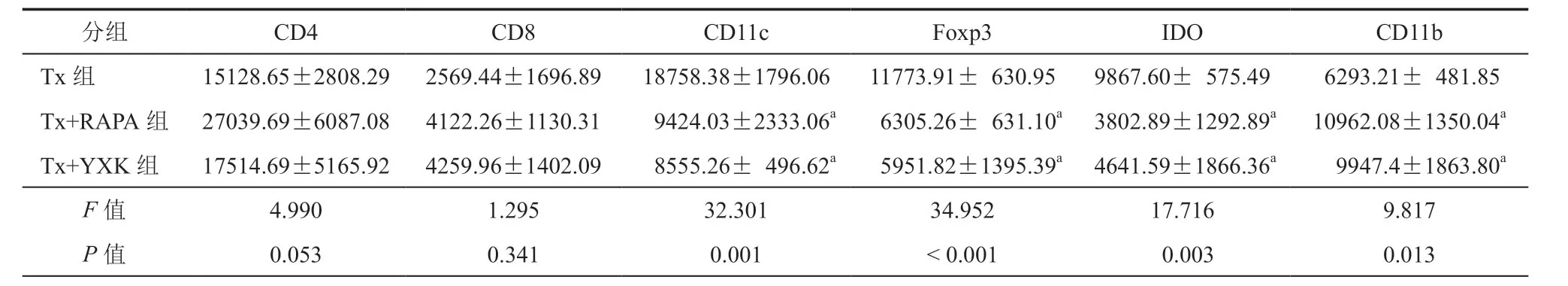
表4 模型动物脾脏病理免疫细胞组化染色灰度分析[IOD( SUM),±s,n = 3]
注:Tx组为移植组;Tx+RAPA组为移植+原研品组;Tx+YXK 组为移植+国产西罗莫司组;与Tx组比较,aP<0.05;n为实验动物数
分组 CD4 CD8 CD11c Foxp3 IDO CD11b Tx组 15128.65±2808.29 2569.44±1696.89 18758.38±1796.06 11773.91±630.95 9867.60±575.49 6293.21±481.85 Tx+RAPA组 27039.69±6087.08 4122.26±1130.31 9424.03±2333.06a 6305.26±631.10a 3802.89±1292.89a 10962.08±1350.04a Tx+YXK 组 17514.69±5165.92 4259.96±1402.09 8555.26±496.62a 5951.82±1395.39a 4641.59±1866.36a 9947.4±1863.80a F 值 4.990 1.295 32.301 34.952 17.716 9.817 P 值 0.053 0.341 0.001<0.001 0.003 0.013
讨 论
移植后宿主外周及移植物中免疫细胞的浸润、蓄积、细胞种类数量及比例的变化,已经成为判断移植后免疫微环境状态的重要参考因素[8]。本组实验通过从体外细胞培养、移植模型排斥反应和病理学实验三方面比较了国产西罗莫司与原研品对移植受者免疫细胞的影响,从而证实两种药物对细胞代谢途径和外周免疫细胞具有同样的影响效果。
国产西罗莫司与原研品对人膀胱癌T24 细胞活性的影响一致,证明两种药物作为mTOR 受体抑制剂对mTOR 及AKT 通路的调控作用一致,两药之间差异无统计学意义。
心脏移植模型组织病理学HE 染色显示:给予国产西罗莫司和原研品治疗后,心肌组织中淋巴细胞浸润明显少于对照组,未见明显心肌细胞破坏和小血管炎。无论移植物存活和动物生存状态,还是移植病理均证明两种药物有同样的抗排斥作用。本研究还发现随着移植后存活时间延长,即使在同一治疗组中细胞浸润程度也会随时间推移而变化。移植后接受抗排斥药物干预后,以免疫细胞为代表的免疫系统存在动态变化的过程。脾脏是外周最大的免疫器官和免疫应答场所,以淋巴细胞为主的各种免疫细胞在此被激活后进行特异性免疫应答反应[9]。这一点在模型动物脾脏的外观大小直接体现出来,其中Tx+YXK 组和Tx+RAPA组脾脏大小差别不大。
流式细胞检测可以直接了解参与免疫反应的免疫细胞变化。近年来,免疫抑制剂对移植受者体内免疫细胞的影响研究越来越被重视。Song 等[10]对22例肝移植受者末梢血的研究发现,西罗莫司可以明显提升受者调节性T、B细胞的生成。本组脾细胞流式检测结果显示,Tx+YXK 组和Tx+RAPA组的CD4+CD25+Foxp3+细胞数量在脾脏中均高于对照组和Tx组;Tx+YXK 组和Tx+RAPA组的CD11c+IA+CD86+DC、CD8+T淋巴细胞数量明显低于对照组和Tx 型;各种免疫细胞比例变化在Tx+YXK 组和Tx+RAPA组之间比较差异无统计学意义。说明两种药物均具有抗排斥作用,对不同的免疫细胞影响相同,以及均具有诱导体内调节性T细胞生成的作用。
移植心脏病理染色灰度分析显示CD11c的细胞浸润情况,符合抗原刺激之后诱发抗原递呈细胞增殖的现象;早期移植物中Treg和IDO的低量表达,提示移植初期尚未达到免疫抑制的状态。心脏移植物中免疫细胞浸润的灰度分析证明国产西罗莫司与原研品对移植物中免疫细胞的作用一致。脾脏组化染色结果与心脏中免疫细胞浸润的规律有所不同,提示脾脏作为外周最大的免疫器官是免疫反应的重要场所,移植物是免疫损伤的直接效应器官。本组脾脏和移植心脏标本中免疫细胞浸润的变化,直接体现了药物干预与否的不同免疫背景下,移植宿主免疫状态的改变和两组药物对免疫细胞的作用相同。
综上所述,通过体外、体内实验的观察、比较,国产西罗莫司与原研品对移植宿主体内免疫细胞的影响是一致的,无论抗排斥效果和免疫细胞的改变,还是体外对细胞增殖的影响,均证明国产西罗莫司与原研品作用相同。
病理切片的组化染色仅对最具代表性的单一细胞表面标志染色,可能是造成流式检测与组化染色之间存在分歧的原因。此研究为描述性研究,仅以比较国产西罗莫司与原研品对移植宿主外周血免疫细胞影响、抗排斥作用以及mTOR的抑制效果为目的,相关机理探讨还有待深入。
志谢感谢华北制药股份有限公司在实验中提供的药品。感谢首都医科大学郑君芳老师、刘芬老师在课题设计和统计学给予的指导。感谢华中科技大学附属同济医院器官移植研究所郭晖教授在病理学方面给予的指导。感谢首都医科大学附属北京友谊医院仇玮博士后和姚静怡技师、中国医学科学院苏明博士在分子生物学中给予的帮助。
本研究与厂家利益无关

