脐血干细胞移植对儿童重组活化基因突变重症联合免疫缺陷病疗效分析
刘超凡 钱晓文 王宏胜 江文晋 王苹 朱晓华 俞懿 孙金峤 王晓川 翟晓文
重症联合免疫缺陷病(severe combined immunodeficiency disease,SCID)是由于先天遗传因素导致体液和(或)细胞免疫缺陷所致的一种罕见的原发免疫缺陷病,临床表现为反复的细菌、病毒、真菌和结核等感染,伴发生长发育迟缓和自身炎症性疾病,是原发性免疫缺陷病中最严重的一种。SCID患儿通常在婴儿期就有严重或复发性的感染,如果免疫功能不能恢复,将在1~2年内死亡。在北美和欧洲等开展新生儿筛查(newborn screening,NBS)的国家,NBS 出现之前SCID的患病率为十万分之一,现在已知的数字接近六万分之一到五万分之一。根据NBS 报告,重组活化基因(recombination activating genes,RAG)1和2是SCID 相关的第二大流行基因,预计在美国的患病率为1/330 000,是泄漏型SCID 最常见的基因[1]。
RAG是编码重组激活蛋白的基因,RAG1和RAG2 启动了通过V(D)J 重组导致淋巴细胞受体形成的分子通路。RAG1和RAG2 突变可表现为一系列疾病,包括典型SCID、泄漏型SCID和Omenn综合征[2]。RAG1和RAG2 蛋白结合形成异四聚体复合物,作为一种内切酶。重组酶复合物是重组可变性(V)、多样性(D)和连接抗原受体基因(J)片段关键的第一步,这些抗原受体基因片段产生T细胞受体和B细胞受体的多样性。T细胞受体和B细胞受体不仅对T细胞和B细胞的抗原识别功能有重要作用,而且对T细胞和B细胞的发育和生存也有重要作用[3]。RAG1 突变与V(D)J 重组缺失有关,而V(D)J 重组缺失又产生未成熟淋巴细胞导致SCID,经典免疫表型为T-B-NK+,RAG1的半纯突变是与泄漏型SCID 相关的最常见的基因型。在这些患儿中,V(D)J 重组的缺陷导致T细胞和B细胞低于正常值,但仍存在一定数量。
RAG 突变所致的SCID患儿常规对症治疗预后不佳,需接受造血干细胞移植治疗[4]。2015年1月至2019年6月复旦大学附属儿科医院采用脐血干细胞移植(umbilical cord blood transplantation,UCBT)治疗8例RAG 突变SCID患儿,现总结如下。
资料与方法
一、一般资料
2015年1月至2019年6月,在复旦大学附属儿科医院明确诊断并接受UCBT的RAG 突变SCID患儿共8例,男6例,女2例,移植年龄8.5(4.0~120.0)个月,移植体重7.5(5.0~29.5 )kg。
二、方法
1.供体选择和预处理方案:所有患儿经国家认证的脐血库检索配型,脐血配型符合HLA-A、B、C、DRB1和DQ基因型≥7/10相合,总有核细胞数≥3×107个/kg 受者体重,CD34+细胞数≥1×105个/kg 受者体重。7例患儿采用白消安+环磷酰胺预处理方案:白消安 0.8 mg/kg×4次 ×3 d(移植前5~7 d)+环磷酰胺 50 mg/(kg·d)×2 d(移植前2~3 d),1例采用氟达拉滨+白消安+环磷酰胺的预处理方案:氟达拉滨 40 mg/(m2·d)×2 d(移植前2~3 d)+白消安 0.95 mg/kg×4次×3 d(移植前5~7 d)+ 环磷酰胺50 mg/(kg·d)×2 d(移植前2~3 d),移植脐血干细胞参数及预处理方案见表1。所有患儿接受常规真菌、病毒预防,有卡介菌感染患儿接受抗结核药物预防,移植物抗宿主病(graft versus-host disease,GVHD)预防采用他克莫司单药口服预防。
2.免疫功能检测:免疫功能评价指标主要为各淋巴细胞亚群绝对计数。8例患儿均采用流式细胞仪检测外周血淋巴细胞亚群,采集静脉血2 ml,使用肝素钠抗凝,使用荧光标记单克隆抗体分别标记外周血淋巴细胞亚群,其中抗CD3、抗CD4 抗体标记CD4+T细胞,抗CD3、抗CD8抗体标记CD8+T细胞,抗CD19 抗体标记B细胞,抗CDl6CD56 抗体标记NK细胞。分别在移植前,移植后每个月检测1次。
3.基因检测:取得患儿父母知情同意后,抽取患儿及其父母外周静脉血2 ml 使用EDTA 抗凝,提取基因组DNA,采用高通量测序法行全外显子组测序。采用Sanger法和荧光定量PCR 分别对点突变和缺失突变进行验证。
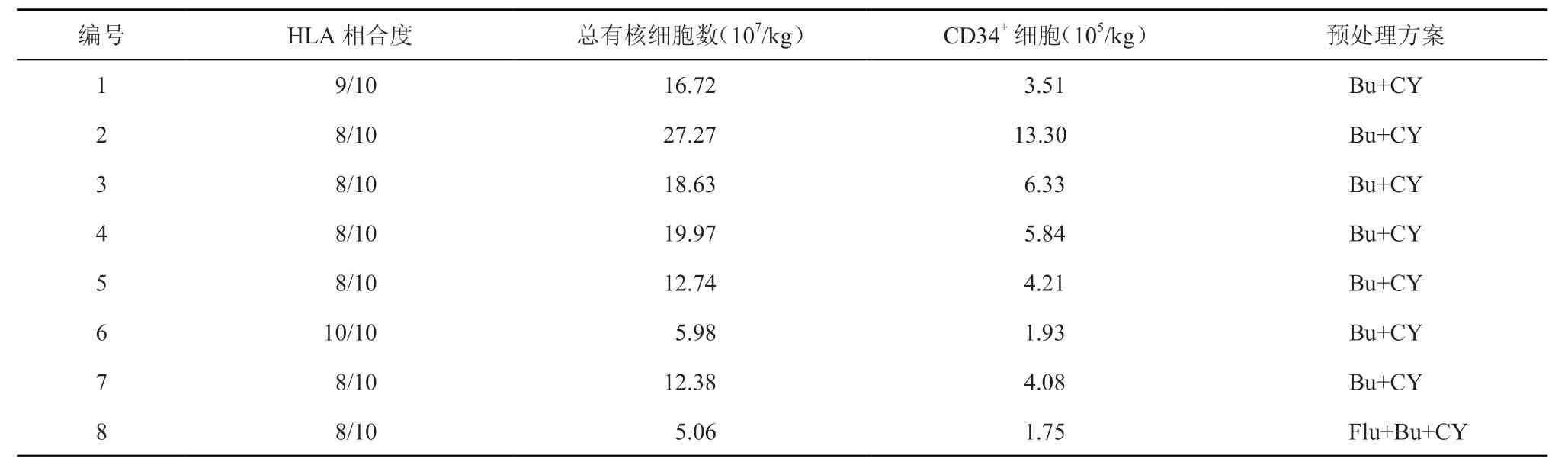
表1 8例患儿脐血干细胞参数及预处理方案
4.嵌合检测:抽取患儿外周血2 ml,使用EDTA抗凝,在脐血干细胞移植后2 周进行第1次检测,第4周进行第2次检测,之后每月检测1次;6个月之后,每2个月检测1次,直至嵌合率稳定。嵌合状态界定:完全嵌合状态:嵌合率≥ 95﹪;混合嵌合状态,5﹪≤嵌合率<95﹪;微嵌合状态:嵌合率<5﹪。
三、统计学分析方法
对8例患儿的临床及实验室数据进行描述性统计分析,包括患儿植入情况、造血及免疫重建情况、嵌合状态、移植后感染、GVHD 及其他移植后并发症、移植后生存情况。不符合正态分布的连续性变量资料用中位数(最小值~最大值)表示,分类资料用例数(相对比)表示。
结 果
一、患儿脐血干细胞移植前临床及实验室特征
8例患儿临床表现以感染为主,包括呼吸道感染(8例)、肠道感染(4例)、皮肤软组织感染(5例)、血流感染(3例)、卡介菌病(3例)。8例患儿免疫表型主要表现为T-B-NK+,通过流式细胞仪检测淋巴细胞亚群,具体临床及实验室特征见表2。
二、患儿脐血干细胞移植后造血及免疫重建情况
8例患儿中7例获供者细胞完全植入,中性粒细胞中位植入时间25(15~45)d,血小板中位植入时间34(33~43)d,脱离静脉丙种球蛋白输注中位时间84(63~100)d。8例患儿脐血干细胞移植后+30d有3例(3/8)T细胞>500个/μl,移植后+ 60 d 有2例(2/8)T细胞>500个/μl;移植后+ 90d有2例(2/8)T细胞>1 500个/μl,移植后+ 120 d有2例(2/8)T细胞>1 500个/μl,移植后+ 330 d有1例(1/8)T细胞>1 500个/μl;移植后+ 60 d有1例(1/8)B细胞>200个/μl,移植后+ 90 d 有2例(2/8)B细胞>200个/μl,移植后+120d有1例(1/8)B细胞>200个/μl,移植后+ 150 d 有1例(1/8)B细胞>200个/μl。6例在移植后14 d 达完全嵌合,1例在移植后120 d 达完全嵌合,1例检测嵌合前已死亡。患儿脐血干细胞移植后造血重建及免疫重建情况见表3。
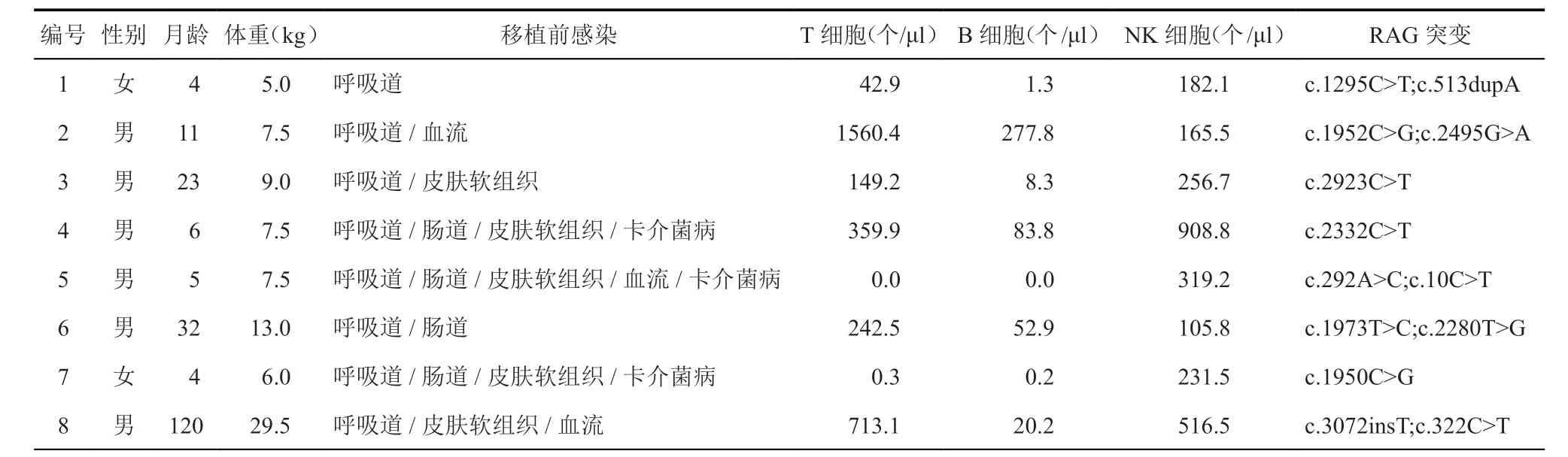
表2 8例患儿脐血干细胞移植前临床及实验室特征
三、患儿脐血干细胞移植后并发症及随访情况
8例患儿移植后均发生感染,包括肺部感染(结核感染、真菌感染)、脓毒血症(近平滑假丝酵母菌)、肠炎(轮状病毒感染、艰难梭菌、产酸克雷柏氏菌、C 组沙门菌、阿氏肠杆菌感染)、泌尿道感染(奇异变形杆菌)、巨细胞病毒感染等,经治疗5例(5/8)获得控制,3例(3/8)发生死亡。移植后5例(5/8)发生急性GVHD(aGVHD),其中1例(1/8)发生Ⅲ-Ⅳ度GVHD。移植后中位随访时间9.2(0.3~31.3)个月,截至末次随访无慢性GVHD(cGVHD)发生,5例(5/8)获得长期免疫重建和存活。接受Fu+Bu+CY 移植的1例患儿移植后中性粒细胞植入时间为23 d,血小板植入时间为33 d,脱离静脉丙种球蛋白输注时间100 d,移植后14 d 达到完全嵌合;移植后发生呼吸道、泌尿道、消化道及巨细胞病毒感染,100 d 内发生消化道aGVHD,无cGVHD 发生,末次随访时间6个月,目前在抗排异和抗感染治疗中。脐血干细胞移植后并发症及随访情况见表4,移植后皮肤GVHD 见图1。
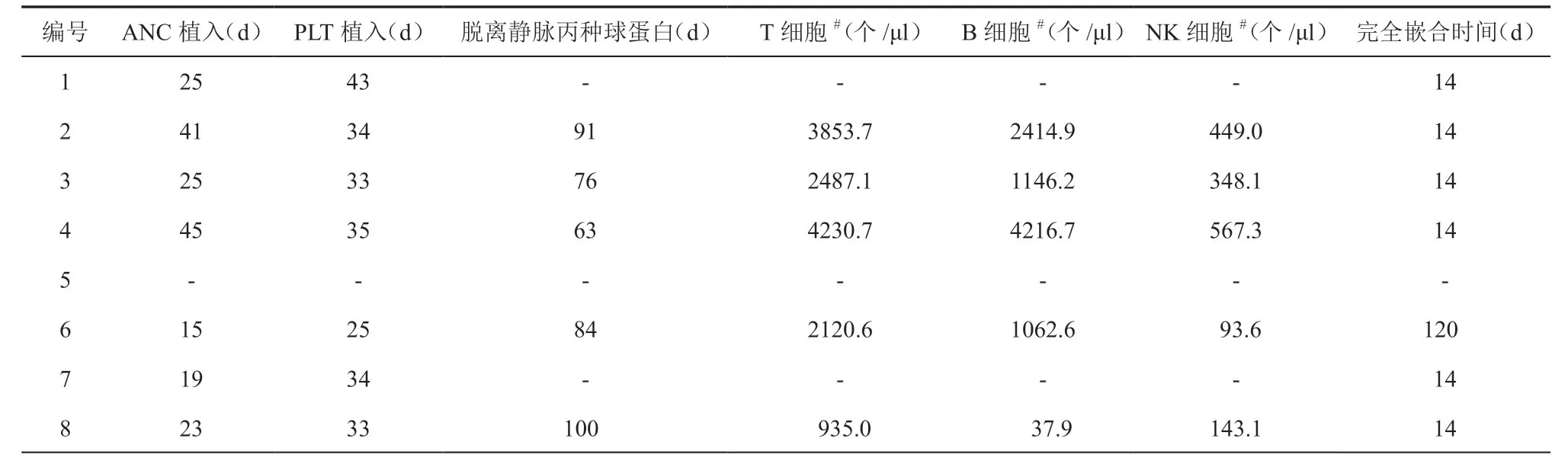
表3 8例患儿脐血干细胞移植后造血重建及免疫重建情况
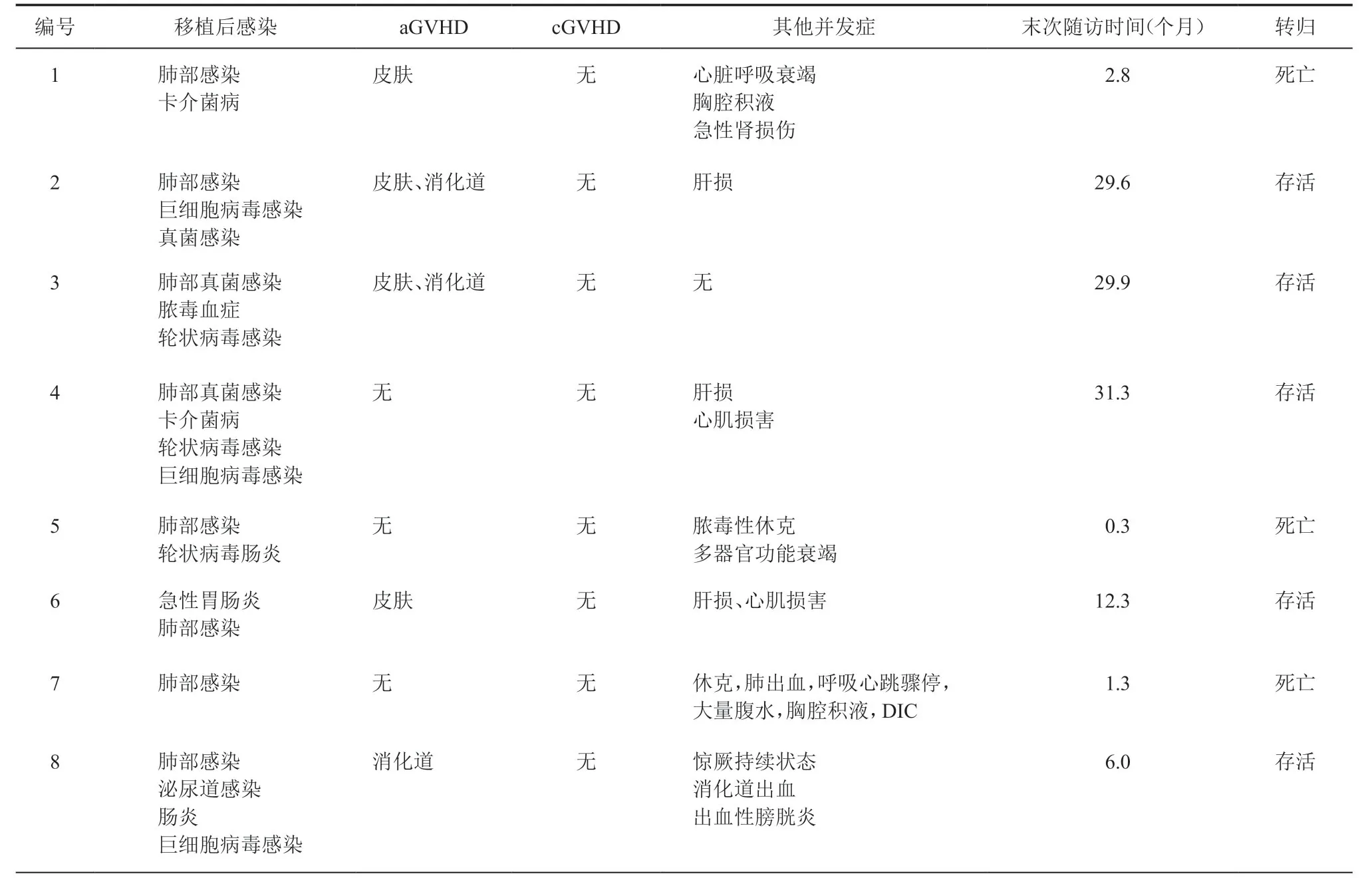
表4 8例患儿脐血干细胞移植后并发症及随访情况
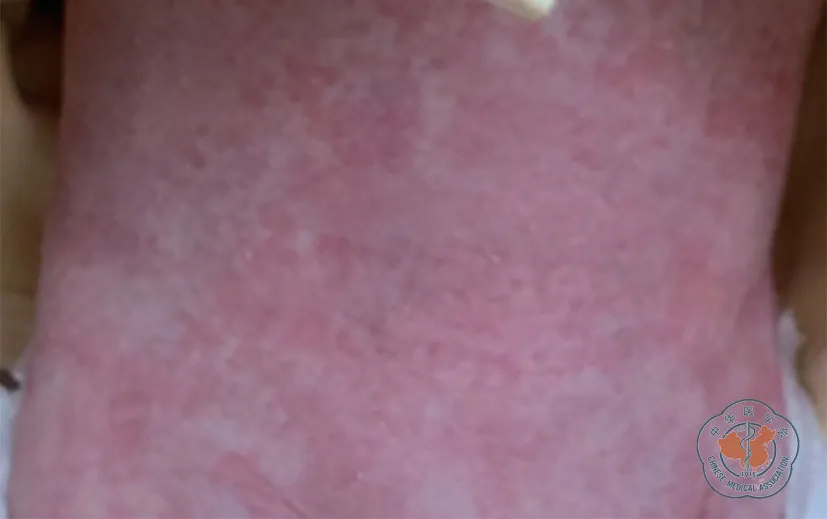
图1 脐血干细胞移植后患儿皮肤移植物抗宿主病表现
讨 论
RAG 突变导致的SCID是一种罕见病,国内曾有会议报道数例SCID患儿的临床特征与基因突变分析,以往国内主要以免疫支持、姑息治疗为主,患儿无法获得长期高质量的生存[5]。近年来,造血干细胞治疗此类疾病受到关注,既往文献显示造血干细胞移植治疗RAG 突变所致SCID(特点为T-B-SCID)的结果比其他SCID 差,但最近的一份报告显示RAG 突变所致SCID的生存率与其他基因表型为T-B+SCID 相似[6-7]。
目前国内无UCBT 治疗RAG 突变SCID 相关报道。本文采用UCBT 治疗8例患儿,7例获得供者细胞植入,5例生存并获得造血及免疫重建,说明UCBT是此类患儿的一种可行选择。脐血干细胞作为造血干细胞的供者来源之一,具有获取快捷,配型要求相对低,GVHD 发生率较低的优点,此组患儿体重较轻,单份脐血干细胞数量足够,输注TNC 中位数14.73×107个/kg,CD34+细胞中位数4.14×105个/kg,可以满足移植需要,使患儿获得供者细胞植入。目前国际上此类疾病供者选择遵循原则是首先选择非缺陷基因同胞供者,其次是非亲缘骨髓库供者和脐带血供者,最后考虑亲缘单倍体供者。我国同胞供者少,骨髓库非亲缘供者检索配型周期相对长,并存在悔捐风险,选择非亲缘脐血供者可以及时有效实施移植。
然而,与其他来源干细胞相比,脐血含有的CD34+细胞和成熟淋巴细胞较少,导致植入失败的风险较高、移植后免疫重建延迟、早期非复发性死亡率增高[8]。文献比较了采用不同强度的预处理方案,包括清髓性预处理、减低强度预处理和无预处理(非清髓性预处理)的SCID 移植治疗疗效,接受减低强度预处理治疗的患儿总体生存率高于接受清髓性预处理治疗(分别为94﹪和53﹪)的患儿,无预处理化疗的患儿,B细胞植入延迟或不植入,仍需要静脉丙种球蛋白替代治疗[9]。因此对于此类患儿宜采用减低强度预处理方案,目的是让此类在移植前存在严重感染和脏器损害的患儿更好地耐受预处理化疗,并获得更好植入。本研究中,患儿在接受移植前都存在感染,部分患儿存在脏器损害,难以耐受清髓性预处理,故而采用以Bu/CY为主的减低强度预处理方案,87.5﹪(7/8)患儿获得顺利植入,耐受性良好。
SCID患儿尽快获得免疫重建能有效的控制感染及脏器损害,既往研究显示,影响免疫重建的因素包括患儿年龄相关的胸腺退化、预处理方案、供受者HLA 相合度、GVHD的发生以及用于预防或治疗GVHD的药物,如抗胸腺细胞球蛋白等[10-11]。采用减低毒性并不含抗胸腺细胞球蛋白的预处理,有利于患儿更快获得免疫重建,此外,Sauter 等[12]对没有抗胸腺细胞球蛋白的UCBT 进行了类似的观察,10例显示出稳定的免疫恢复,120 d 后感染相关死亡率较低,但与在UCBT 之前接受抗胸腺细胞球蛋白治疗的患儿相比,GVHD 风险更高。本研究采用不含抗胸腺细胞球蛋白的减低毒性预处理,62.5﹪(5/8例)患儿顺利获得免疫重建。
既往研究结果显示,在婴儿期早期接受移植的SCID患儿,≤3.5个月患儿移植后5年生存率为94﹪,而>3.5个月且移植前有感染的患儿移植后5年生存率为50﹪,≤3.5个月患儿预后更好;移植前无活动性感染的患儿,无论接受何种移植物,均可获得较好预后[13-14]。因此新生儿SCID 筛查并尽早接受移植可以提高SCID患儿存活率[15]。在移植时预防和成功治疗感染是保证移植成功的主要因素。在移植治疗前后积极合理应用抗感染药物,移植后及时的通过多学科团队合作处理感染相关并发症,最大程度提高SCID患儿移植后生存。
UCBT是治疗RAG 突变SCID患儿的一种有效方式。不含抗胸腺细胞球蛋白的减低毒性预处理方案使此类患儿易耐受、可获得完全植入及免疫重建,值得推荐。开展新生儿SCID 筛查,使此类患儿能及早诊断并接受移植。有效控制移植前感染,可进一步提高此类患儿生存率。本研究因病例数量少,未做分组研究,后续有必要扩大病例数进行相关探讨。

