甲磺酸阿帕替尼联合放疗治疗局部晚期胰腺癌的临床观察
安召伟 张楠 赵亚红 窦珊珊 张凯
胰腺癌是消化系统常见的恶性肿瘤之一,具有诊断难度大、恶性程度高、易发生复发及转移及预后差的特点,5年生存率不足5%。由于胰腺癌在早期阶段症状缺乏特异性,大约60%的胰腺癌患者在确诊时已发生远处转移,约25%的患者在确诊时已为局部晚期,无法耐受手术[1],故手术切除难以取得较好效果。三维适形放射治疗为不可切除局部晚期胰腺癌的常用方法[2],因胰腺癌毗邻的脏器对放疗耐受性低,且胰腺癌对放疗敏感性差,因此单纯放疗效果欠佳。因此对于晚期胰腺癌如何进行有效的治疗是广大临床医师亟需解决的问题[3]。胰腺癌的进展、局部浸润及转移均有赖于新生血管的生成,甲磺酸阿帕替尼 (Apatinib)是我国自主研发的新型口服小分子血管内皮细胞生长因子受体2(VEGFR-2)酪氨酸激酶抑制剂,可抑制肿瘤血管生成[4]。临床上常用于治疗胃腺癌等消化系肿瘤。因此甲磺酸阿帕替尼联合放疗为临床治疗胰腺癌提供了一条新的治疗途径。本研究收集50例局部晚期胰腺癌患者,随机分为甲磺酸阿帕替尼联合三维适形放疗组和三维适形放疗组治疗局部晚期胰腺癌,观察研究两种治疗方式的临床疗效及不良反应,并研究其作用机制,为临床治疗提供依据。
1 资料与方法
1.1 一般资料 选取2017年6月至2019年6月我院收治的初治的局部晚期胰腺癌患者60例,随机分为联合组和单放组,每组30例。联合组中男17例,女13例;年龄47~78岁,平均年龄(57.31±7.14)岁。原发肿瘤部位:胰头部18例,胰尾部12例;KPS评分71~86分,平均(76.79±7.56)分;病理类型:高分化腺癌12例,中分化腺癌8例,低分化腺癌10例。单放组中男15例,女15例;年龄45~75 岁,平均年龄(54.81±5.82)岁;原发肿瘤部位:胰头部20例,胰尾部10例;KPS评分73~87分,平均(77.12±7.76)分;病理类型:高分化腺癌11例,中分化腺癌7例,低分化腺癌12例。2组患者在性别比、年龄、原发肿瘤部位、KPS评分及病理类型方面比较差异无统计学意义(P>0.05),具有可比性。
1.2 入组标准 患者经组织细胞学证实为晚期胰腺癌;经CT、MRI或术中探查无法实施手术切除;患者均经初次治疗,未经任何抗肿瘤治疗;KPS标准≥70分;病灶经临床测量或可评估;肝肾功能正常,无凝血功能障碍;无放疗禁忌;患者签署知情同意书。
1.3 方法 2组患者均接受三维适形放疗,同时遵循胰腺癌放射治疗规范,定位前1 h口服造影剂泛影葡胺显示胃和小肠位置,体膜固定,平静呼吸状态下行腹部增强CT扫描,有条件者可行腹部增强MRI或PETCT扫描,扫描时患者仰卧于CT机平板床上,双手交叉抱头,确定好摆位位置,应用三维激光定位系统,在皮肤上画出标记点。扫描层厚为5 mm,扫描范围上界为膈肌顶,下界为髂嵴水平。根据CT图像(或与MRI/PETCT图像融合)勾画肿瘤靶区(gross tumor volume,GTV):影像学所见的胰腺肿瘤区域,以及影像学所见的阳性腹腔及腹膜后淋巴结;按肿瘤生物学特性GTV外放5 mm为临床靶区(clinical target volume,CTV);考虑到器官运动及摆位误差,计划靶区(plan target volume,PTV)为CTV上下外扩10 mm,前后、左右方向外扩5 mm。勾画周围重要器官如肝、双肾、胃、小肠、脊髓,限定安全剂量,95%PTV接受处方剂量,治疗计划系统设计照射野,根据剂量体积直方图评估、优化放疗计划。处方剂量PTV 50.4~59,4 Gy/1.8 Gy/28~33 F, 5次/周。联合组放疗第1天同步应用甲磺酸阿帕替尼500 mg/d抗血管生成,放疗结束后继续口服甲磺酸阿帕替尼治疗,直至出现不能耐受的不良反应或者病情进展。治疗期间每周复查血常规。
1.4 评价标准 治疗结束后1个月进行腹部CT或MRI等影像学评价,依据WHO实体瘤疗效评价标准,完全缓解(CR)指肿瘤完全消失,持续>4周;部分缓解(PR)指肿瘤2个最大垂直直径线乘积缩小≥50%,持续>4周;稳定(SD)指肿瘤病灶长径总和有缩小但未达PR或有增加但未达PD;进展(PD)指肿瘤增大25%或出现新病灶。胰腺癌局部控制率(RR)=(CR+PR)/总例数×100%。毒性反应:按照WHO分级标准评价毒副反应,分为Ⅰ~Ⅳ[5]。
1.5 统计学分析 应用SPSS 17.0统计软件,计数资料以百分率表示,采用χ2检验,Kaplan-Meier法计算生存率,P<0.05为差异有统计学意义。
2 结果
2.1 2组患者局部控制率比较 治疗结束后1个月进行腹部CT或MRI等影像学评价,联合组患者的胰腺癌控制率(RR)为 63.3%,单放组为30.0%,差异有统计学意义(P<0.05)。见表1。
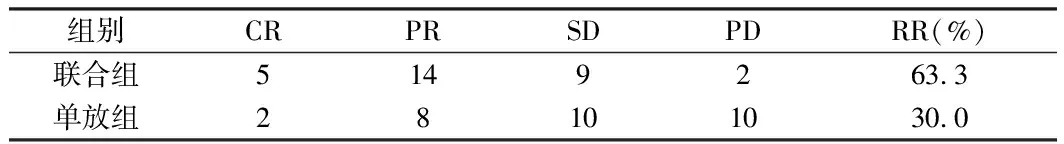
表1 2组患者局部控制率比较 n=30,例
2.2 2组不良反应比较 2组的血液学毒性、胃肠道反应及肝肾损伤不良反应发生率相比,差异无统计学差异(P>0.05)。见表2。
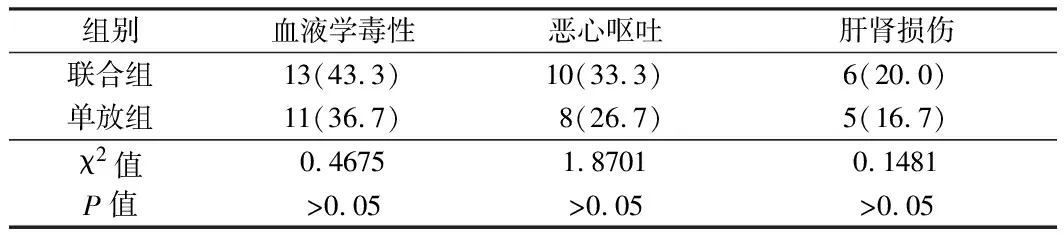
表2 2组不良反应比较 n=30,例(%)
2.3 2组患者生存率比较 随访截止时间2019年6月30日,中位随访时间20个月,随访率100%。联合组与单放组1、2年生存率分别为66%、29%和38%、15%,中位生存期分别为16个月和11个月(χ2=4.21,P<0.05),差异有统计学意义(P<0.05)。有效率分别为65%和32%(χ2=5.22,P<0.05),差异有统计学意义(P<0.05)。见表3。
3 讨论
胰腺癌是指源自外分泌细胞的癌,恶性程度较高的疾病,近年来胰腺癌的发病率呈现上升的趋势,并且年龄趋向于年轻化,疾病死亡率也呈上升趋势[6]。胰腺癌的具体发病原因尚未完全清楚,一般认为吸烟、饮酒、环境污染、遗传、高蛋白质饮食等因素与胰腺癌的发病有关。目前,外科根治性切除术是治疗胰腺癌最有效的方法。但是由于早期胰腺癌无特异性症状,确诊时大多数病例已属中晚期,而且胰腺癌呈浸润性生长,周围解剖关系复杂等原因,确诊时已无胰腺癌根治性手术的适应症,所以胰腺癌发展迅速,预后极差,患者总的5年生存率极低,仅为1%~5%[7]。胰腺癌对传统的化疗和放射治疗高度抵抗。吉西他滨在目前局部进展和转移性胰腺癌的治疗中具有重要的地位,但是无论是吉西他滨单药化疗,还是以吉西他滨为主的联合化疗未见明显的生存优势[8]。放射治疗是为晚期不可切除胰腺癌常用的治疗方法,可以有效地控制病情发展、延长患者生存时间。但是,由于存在以下原因:腺位于腹腔深部,胰腺周围存在胃、小肠、肾脏、肝脏等重要器官,胰腺癌对放射线敏感性较低,而胰腺周围正常脏器组织对放射线耐受剂量低[9],如果增加胰腺癌的放射剂量杀灭异常增殖的胰腺癌细胞,同时也会对周围正常的组织器官造成放射性损伤,导致患者生活质量下降。如果降低放疗剂量,会影响放射治疗杀灭异常增殖的胰腺癌细胞[10]。限制了放疗的安全性和局部控制率,故放射治疗对胰腺癌效果不理想。

表3 2组患者生存率比较 n=30
胰腺癌细胞会分泌大量促进新生血管和淋巴管生成的细胞因子,起到促进新生血管和淋巴管形成的作用,所以胰腺癌细胞的生长与转移和肿瘤组织中新生血管的形成密切相关。血管内皮生长因子(VEGF)为胰腺癌细胞主要的促血管生成因子[11],VEGF与其受体VEGFR通过激活一系列信号通路来促进新生血管的形成,而新生血管的形成能够促进恶性肿瘤的生长和转移,是恶性肿瘤的重要标志之一[12],是引起肿瘤相关死亡的主要原因。胰腺癌预后不良因素也和肿瘤的生长和转移密切相关,半数以上的胰腺癌患者确诊时已有远处转移。促进肿瘤血管形成的通路主要有3条:VEGF/VEGFR、血管生成素(ANGPT)家族以及Notch-Notch配体通路,其中VEGF与其受体VEGFR信号传导通路是促进肿瘤血管生成的重要的环节。VEGF和VEGFR的过表达与肿瘤生长速度增快、肿瘤增殖和转移能力增强、微血管密度增加等不良预后因素密切相关[13]。VEGF通过与VEGFR-2结合发挥促新生血管生成的作用,同时VEGF也可诱导VEGFR-2下游分子的激活。VEGFR-2主要是在血管内皮细胞上表达,与新生血管的形成有关,在很多肿瘤组织中(包括胰腺癌)表达都是上调的[14]。Doi等[15]报道了VEGF与其受体VEGFR信号传导通路在胰腺癌细胞的迁移和侵袭中起到了重要的作用。因此,近年来拮抗血管形成治疗已经成为肿瘤治疗的研究热点,靶向阻断VEGF和VEGFR-2的结合,即高效的阻断了肿瘤组织新生血管的形成,为恶性肿瘤组织的抗血管生成治疗提供了新的思路。
甲磺酸阿帕替尼(Apatinib)是目前临床常用的小分子血管内皮细胞生长因子受体2(VEGFR-2)酪氨酸激酶抑制剂,其作用机制是竞争性结合VEGFR-2胞内酪氨酸ATP结合位点,高度选择性地抑制VEGFR-2酪氨酸激酶活性,从而阻断血管内皮生长因子(VEGF)结合后的信号传导通路,有效地抑制肿瘤新生血管的生成[16],对于抑制肿瘤细胞的增殖与转移发挥着重要的作用。动物试验发现,甲磺酸阿帕替尼可以抑制小鼠主动脉环萌芽,降低肿瘤微循环,同时甲磺酸阿帕替尼还可以抑制细胞蛋白质合成,其进入线粒体,通过线粒体对肿瘤细胞进行靶向诱导,从而促使肿瘤细胞凋亡[17]。研究表明EGFR在胰腺肿瘤组织中表达水平高于正常组织,EGFR的表达和激活与肿瘤放疗及化疗敏感性密切相关,因此,抗血管生成治疗与放疗的结合成为胰腺癌治疗的新方向。
林远洪等[18]从分子生物学水平证实了胰腺癌细胞放疗敏感性增高与EGFR基因低度表达相关,为抗血管生成治疗联合放射治疗局部晚期胰腺癌临床试验提供了理论基础。本研究探讨分析了甲磺酸阿帕替尼联合放疗治疗局部晚期胰腺癌的临床疗效。联合组患者的RR(63.3%)显著高于单放组(30.0%),差异有统计学意义(P<0.05),这就说明甲磺酸阿帕替尼联合放疗能够有效的抑制肿瘤新生血管的形成,疗效更优于单放组。在上述研究中通过观察两组的各项不良反应发生率,联合组与单放组均可有血液学、胃肠道反应及肝肾损伤,差异无统计学意义(P>0.05),这就说明联合组患者在治疗过程中毒副反应及安全性均未高于单放组,甲磺酸阿帕替尼联合放射治疗未增加毒性反应。研究表明,中位生存期越长,疾病预后越好,本文联合组中位生存期较单放组高5个月,有效率分别为65%和32%,差异有统计学意义(P<0.05)。提示联合组患者的生存预后要优于单放组。
综上所述,和单纯放射治疗相比,采用甲磺酸阿帕替尼联合放射治疗局部晚期胰腺癌,具有较好的临床治疗效果,且未增加毒副反应。但本研究样本量较小,观察时间短,以后需要扩大样本量、延长观察时间深入观察及研究,为提高胰腺癌的治疗提供高级别的循证医学证据。

