十二指肠镜下经乳头胆管腔内球囊扩张联合胆管活检对肝外胆管狭窄的诊治价值
李祥玉 仲恒高 王芸 丁瞿晨 王娟 仇咏欣 杨丽华
肝外胆管狭窄是一种常见的临床表现,病因包括肝外胆管的良恶性肿瘤、炎症、结石等,其中肝外胆管癌引起的肝外胆管狭窄尤其应引起重视。胆管癌(cholangiocarcinoma,CCC)是指起源于胆管上皮细胞的恶性肿瘤,是仅次于肝细胞癌的第二大原发性肝胆系统肿瘤[1],预后差。根据发病部位不同,胆管癌分为肝内胆管癌(intrahepatic cholangiocarcinoma,iCCA)和肝外胆管癌(extrahepatic cholangiocarcinoma,eCCA),而后者又分为肝门部胆管癌(perihilar cholangiocarcin-oma,pCCA或Klatskin瘤)和远端胆管癌(distal cholangiocarcinoma,dCCA)[2]。由于肝外胆管癌起病隐匿,早期诊断是正确选择治疗时机和治疗策略以提高远期生存率的关键。经内镜逆行胰胆管造影(endoscopic retrograde cholangiogancretography,ERCP)方法用于肝外胆管狭窄诊断和治疗,属于微创方法,尤其对不能或不愿接受外科手术的老年患者的早期发现及早期诊断非常重要。本文对30例肝外胆管狭窄的患者,在ERCP下行球囊扩张术并钳取活组织病理检查的结果进行总结分析如下。
1 资料与方法
1.1 一般资料 选择我院消化医学中心2015年1月至2018年5月疑有肝外胆管狭窄的患者30例,其中男16例,女14例;年龄29~81岁,平均年龄(61.4±9.1)岁。其中首发症状为无痛性黄疸者10例,腹痛者17例,恶心呕吐者1例,因发现肝功能异常而就诊者2例。所有患者无内镜检查禁忌症,术前完善腹部B超或计算机断层扫描(CT)或磁共振成像(MRI)或磁共振胰胆管成像(MRCP)检查。见表1。
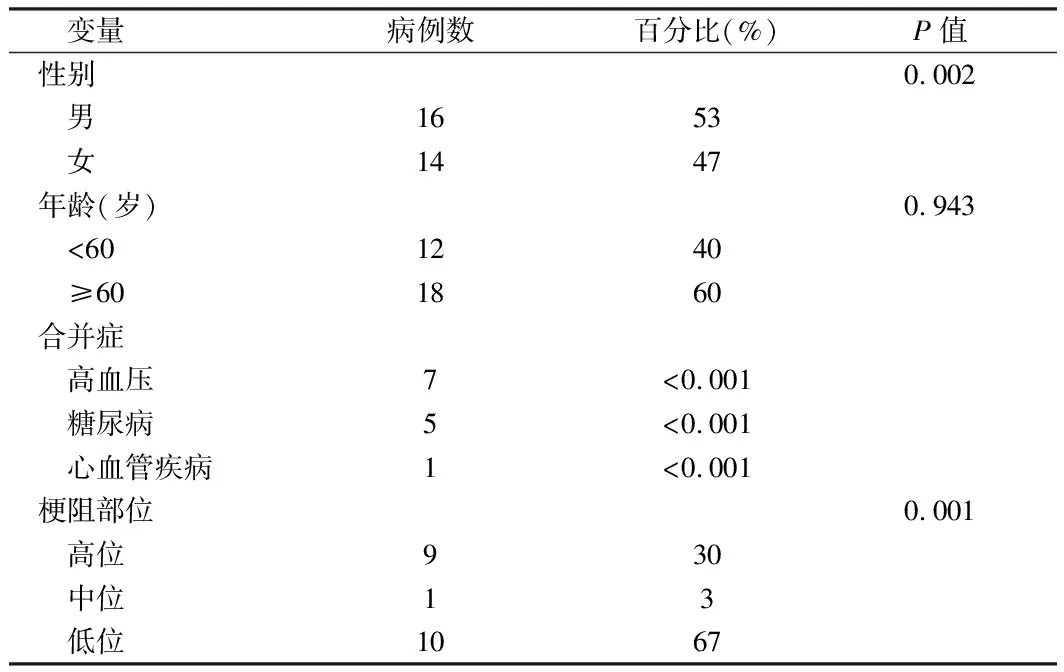
表1 临床资料分析
1.2 材料与方法
1.2.1 材料及仪器:Olympus TJF-240电子十二指肠镜,Olympus KD-40lQ-0725 型三腔乳头切开刀及0.035英寸导丝,Olympus PR-24Q-1型活检钳,Olympus PR-104Q-1型造影管,Anrei一次性球囊扩张器,Wilson-Cook ENBD-7-NAG-C型鼻胆引流管,Wilson-Cook TTSO-8.5-11型胆道支架,碘佛醇注射液。
1.2.2 方法:术前予以肌内注射度冷丁50 mg、654-2 10 mg及安定10 mg进行镇静处理,充分术前准备后患者取侧腹卧位行电子十二指肠镜检查,将十二指肠镜(TJF-240型)循腔插入至十二指肠降部后,观察十二指肠乳头情况,经内镜孔道插入带导丝的切开刀行十二指肠乳头插管,X线下可见导丝顺利插入胆总管,插入造影管,推注造影剂,造影可显示胆道狭窄或者梗阻的部位、范围及程度,行十二指肠乳头括约肌切开约0.5~0.8 cm,撤出切开刀,插入导丝并尽可能逾越狭窄段,经导丝引导,循导丝插入1.0~1.2 cm柱状球囊至乳头口,待球囊约2/3进入乳头口后,球囊内注入造影剂,持续加压,行乳头口切开部位扩张,至1.0~1.2 cm,持续30 s,重复2~3次,待十二指肠乳头口充分扩张后,插入常规活检钳,进入到十二指肠镜前端后,松开十二指肠镜抬钳器,使活检钳出镜身约1.5~2.5 cm,调整十二指肠镜身位置,在抬钳器的辅助下,活检钳经扩张后的十二指肠乳头口进入胆管,X线引导下,在胆管狭窄部位取材活检,松开抬钳器后,拔出活检钳,留置样本,根据需要重复上述程序,取材送检。根据胆道狭窄的部位和程度置入预先选择好的鼻胆管或支架,放置鼻胆管位于合适的引流部位,留置支架者,其近端置于十二指肠乳头外,远端多置于狭窄段>2 cm,对于胆道阻塞明显者可先行胆道狭窄段扩张,其后根据患者病情及意愿选择不同的胆道引流方法,包括单纯鼻胆管引流(endoscopic nose-biliary drainage,ENBD)、金属支架引流(endoscopic metal biliary drainage,EMBD)、塑料支架引流(endoscopic retrograde biliary drainage,ERBD)或支架联合ENBD。放置胆道引流完毕后,重复吸引见胆汁流出,X线下复透确认鼻胆管或支架在位,扩张好,胆道内造影剂显影淡,流出通畅,术毕。见图1。
1.3 术后处理 手术后常规禁食,给予抗菌药物预防胆道感染,并予抑酸、抑制胰酶活性药物等预防急性胰腺炎,记录患者生命体征,记录观察患者腹痛、腹胀及黄疸等症状的变化情况,于术后3 h及24 h查血常规及血淀粉酶,术后2~7 d内复查肝功能。行ENBD引流者观察引流胆汁的量及颜色,根据患者腹痛、腹胀及黄疸的改善情况以及血常规和血淀粉酶相关检查结果,选择合适的时间拔除鼻胆管。随访期间动态监测血清肿瘤标志物的变化。
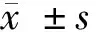


ABCD
图1术中影像学图像;A:X线下球囊扩张技术的应用;B:肝门部狭窄患者ERCP行球囊扩张术图示;C:胆总管中段狭窄患者ERCP行球囊扩张术图示;D:胆总管下段狭窄患者ERCP行球囊扩张术图示
2 结果
2.1 影像学检查结果 30例患者中CT或MRCP提示胆道系统或胰腺可疑恶性病变的有11例,15例提示胆管狭窄或闭塞(上段狭窄者1例,中段狭窄者1例,下段狭窄者13例),4例提示肝门部异常信号。见图2。
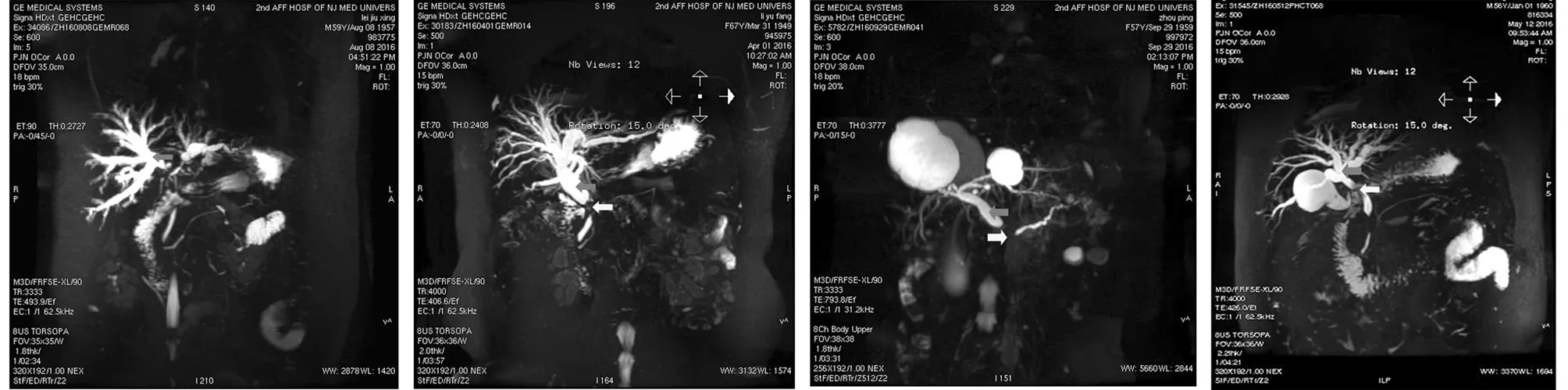

ABCD
图2影像学检查结果;A:肝门部占位,伴肝内胆管扩张(红色箭头);B:胆总管中段闭塞(黄色箭头),伴胆道扩张(红色箭头);C:胆总管及胰管下段截断(黄色箭头)伴胆道及胰管扩张;D:胆道系统扩张
2.2 ERCP及组织病理学结果 30例均成功行内镜下逆行胰胆管造影术,ERCP显示狭窄部位位于肝外胆管高位、中位、低位病例数分别为9、1、20个。所有患者均在内镜下行球囊扩张联合活检钳钳取活组织,活检组织病理结果显示:腺癌10例,高级别上皮内瘤变4例,低级别上皮内瘤变2例,异型增生6例,炎症性改变8例。
2.3 外科手术结果 30例患者中有11例患者进行外科手术治疗,10例患者术后病理为胆管癌,1例患者提示低级别上皮内瘤变(轻-中度异型增生)。
2.4 CT或MRCP、ERCP病理及外科手术病理对肝外胆管恶性肿瘤诊断率比较 30例患者中影像学提示恶性11例,ERCP病理提示癌及癌前病变22例(腺癌10例,高级别上皮内瘤变4例,低级别上皮内瘤变2例,异型增生6例),8例为炎性改变。与影像学相比,ERCP活检组织病理对肝外胆管病变的诊断更有意义(P=0.007)。11例外科手术治疗的患者,术前CT或MRCP提示恶性病变的有5例,ERCP病理明确诊断为恶性病变的有5例,癌前病变4例(低级别上皮内瘤变1例,异型增生3例),炎症改变的有2例。ERCP与外科手术对肝外胆管癌的诊断无明显差异(P=0.5),而影像学对肝外胆管癌的诊断明显低于外科手术病理(P=0.031)。见表2,图3。
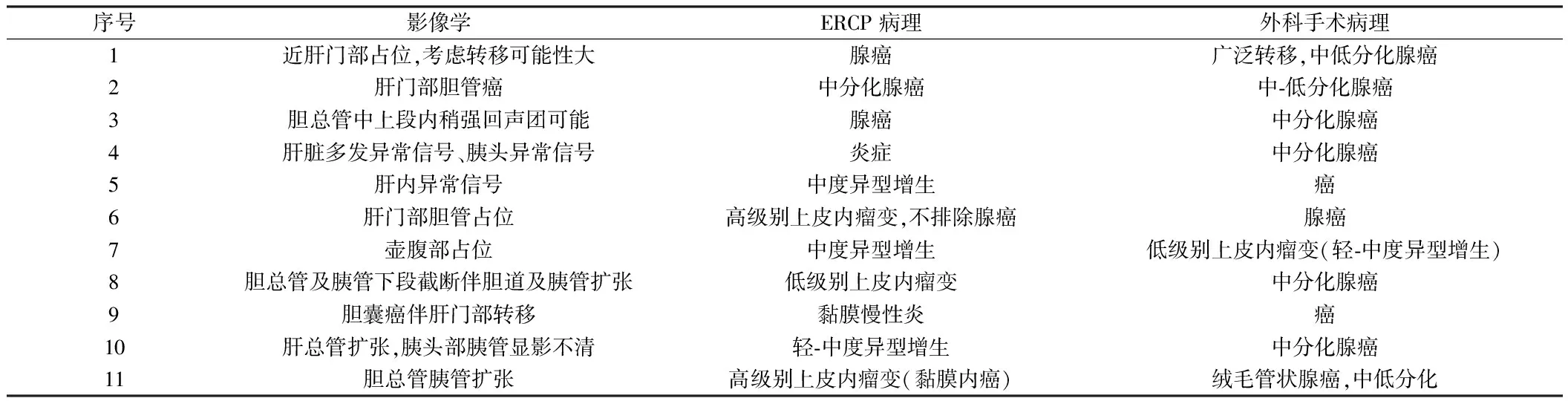
表2 手术患者影像学(CT或MRCP)、ERCP病理及外科手术病理比较

ABCD
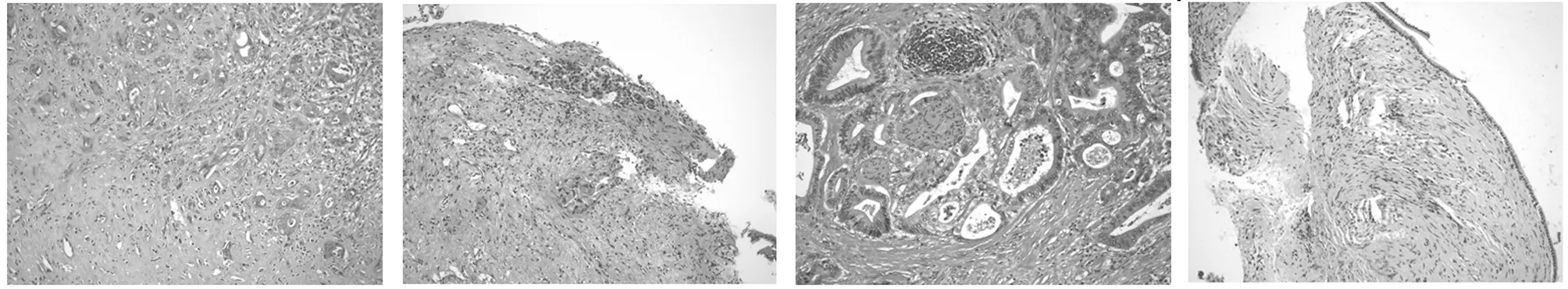
图3术后病理图像;A:外科手术病理提示胆总管下段针尖大小黏膜组织内见少数炎细胞浸润伴机械性损伤(×200);B:ERCP病理可见大量胆管异型细胞,考虑胆管腺癌(×200);C:外科手术病理示胆总管中分化腺癌(×200);D:ERCP病理提示黏膜慢性炎
2.5 临床症状、肝功能及肿瘤标记物变化情况 术后患者腹痛、腹胀等不适症状均明显缓解,皮肤及巩膜黄染、大便发白、小便深黄等表现减弱或消失。血清总胆红素(TBIL)、直接胆红素(DBIL)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)水平术后均明显降低(P<0.05)。血清肿瘤标志物(CA125、AFP)术后较术前有明显改变(P<0.05)。见表3、4。
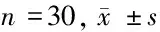

时间TBIL(μmol/L)DBIL(μmol/L)ALT(U/L)AST(U/L)ALP(U/L)GGT(U/L)术前204.8±157.2161.2±128.0253.6±184.6160.8±86.8620.8±461.7918.0±563.0术后119.3±132.3∗92.6±98.4∗100.4±75.4∗47.2±20.7∗401.6±278.5∗443.8±353.4∗
注:与术前比较,*P<0.05
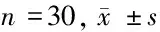

时间CA125CA199CEAAFP术前14.57±5.00203.00±391.803.08±1.393.08±1.00术后37.97±24.86∗86.05±166.401.92±0.772.36±1.08∗
注:与术前比较,*P<0.05;CEA:癌胚抗原;AFP:甲胎蛋白
2.6 术后并发症 30例患者ERCP术后,4例患者出现高淀粉酶血症,3例患者术后并发急性胰腺炎,无出血、穿孔。所有高淀粉酶血症及急性胰腺炎的患者给予对症治疗后好转,淀粉酶均恢复正常。无因行ERCP术而死亡的病例。
2.7 术后随访 30例患者术后均纳入回访,随访时间至2018年6月,其中有10例患者失访,4例随访期间死亡(4例患者在院期间均明确诊断为胆管癌,均行手术治疗,生存时间3~12个月),2例出现恶性病变(2例患者首次住院期间影像学及ERCP下组织病理均未提示恶性病变,1例患者1个月后再次返院行内镜下活组织检查,提示腺癌,该患者外科手术治疗3个月后死亡。1例患者3个月后因腹痛返院复查ERCP病理提示异型增生,外科手术病理提示中分化腺癌),余14例患者随访一般情况明显改善,其中再次返院行内镜下治疗者3例(2例为先天性胆管狭窄患者,1例为胆管癌转移患者入院行支架解除梗阻,缓解临床症状)。见图4。
3 讨论
肝外胆管狭窄是一种比较常见的临床表现,原因多种,以eCCA恶性度最高及预后最差。eCCA即是一种原发于左右肝管汇合部至胆总管下端的肝外胆管恶性肿瘤,常表现为无痛性进行性黄疸以及胆道梗阻症状[3]。目前eCCA的手段检查主要包括影像学技术、肿瘤标志物及组织学检查,而组织学检查因活组织较难获取而未普及。
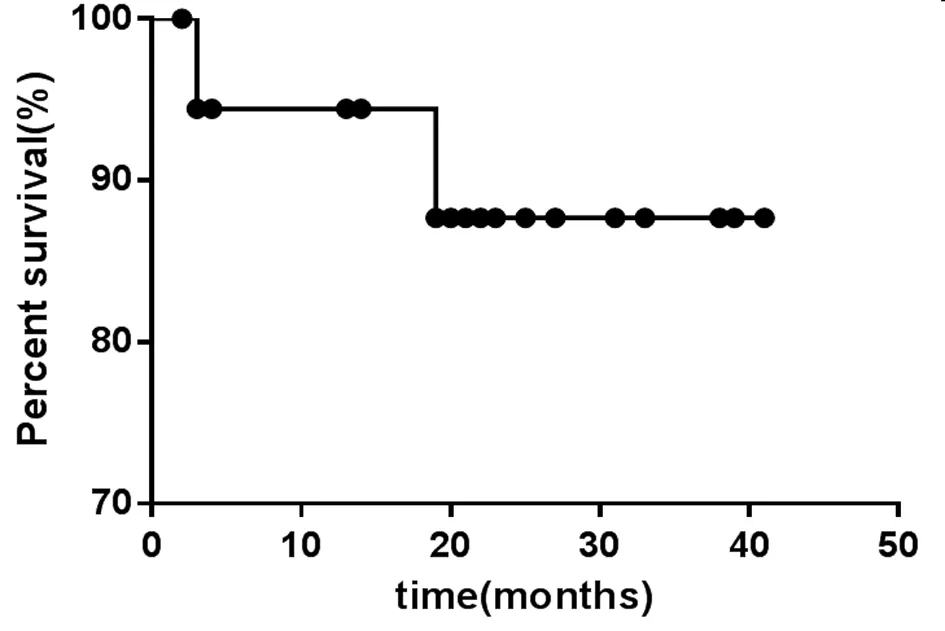
图4 患者随访生存曲线
腹部B型超声因简便易行是诊断eCCA的首选检查方法[4]。CT可更加全面地显示肿瘤的部位、范围及周围脏器受侵犯情况[5],尤其多排螺旋CT能提供良好的空间分辨率和肿瘤与肝动脉、门静脉的最佳描述关系[6]。MRCP检查是目前用于胆道系统疾病非侵入性检查的金标准[1],多项研究显示MRCP检查对eCCA具有较高的灵敏度,可明确病变部位[7,8]。我们的研究结果提示影像学(CT或MRCP)的诊断率为45.5%,其联合ERCP检查确诊率可达90.9%。
有研究提出联合检测≥2 种的肿瘤标志物可提高诊断的敏感性和特异性,联合检测CA199、CA125、CEA和AFP可提高CCA和肝癌的诊断率[9,10]。我们对手术病理明确诊断为eCCA的患者的血清肿瘤标志物进行了随访观察,发现CA125、AFP术后较术前变化具有统计学意义。
然而,恶性肿瘤最有力的诊断依据为病理组织学,世界卫生组织对实体瘤的诊断目前仅肝癌可根据影像学检查明确诊断。目前常用的用于确诊肝外胆管狭窄获取组织病理的操作方法有ERCP、超声内镜(EUS)、Spyglass等。一项针对恶性胆道梗阻患者的Meta分析结果显示EUS-FNA对肝外胆管狭窄诊断的总体敏感度和特异度分别为80%和97%,不良事件发生率为0.3%[11]。但相对于EUS及Spyglass方法,ERCP检查方法更方便易行,获取活组织方法对患者的创伤更小,并且在诊断的同时采取支架植入、鼻胆管引流等姑息的治疗措施。ERCP下获取胆管组织病理学的方法包括胆管组织活检、刷检及脱落细胞检查。ERCP细胞学曾被认为是诊断胰胆管疾病的金标准[12],然而,胆管刷片常常因取材量不足而导致病理诊断无法给出肯定的结论,Paul等[13]研究显示敏感性仅为30%~57%。ERCP组织学诊断特异性强,另有研究表明胆管狭窄活检的敏感性为53.85%,其特异性高达100%[14]。但单纯常规十二指肠乳头切开术常常很难将活检钳从切开口推送至胆管内需要行活检的部位,因此,我们用ERCP下联合球囊扩张术,通过球囊扩张,降低活检钳推送的难度,提高活组织的获取准确率,从而提高诊断率。
我们的研究表明ERCP下联合球囊扩张术可用于肝外胆管狭窄的诊断的准确率为(81.8%),明显高于Chen等[14]报道的53.85%。与影像学相比,ERCP活检组织检查为病理学诊断,对肝外胆管病变的诊断更有意义(P=0.007)。在11例外科手术治疗的患者,术前ERCP病理明确诊断为恶性病变的有5例,癌前病变4例(低级别上皮内瘤变1例,异型增生3例)。尤其对老年人不能接受外科手术而又希望得到病理明确诊断的患者,提高ERCP方法活检的成功率尤为重要,因此,本研究显示十二指肠镜下联合胆管腔内球囊扩张应为提高ERCP胆管活检成功率的有效方法。
近年来,SpyGlass胆道镜检查被证实是胆道系统疾病的有效诊治工具,有研究显示SpyGlass胆道镜活检诊断恶性胆管狭窄的灵敏度为60.1%,特异度为98.0%[15]。但因其使用的活检器具价格相对昂贵,目前尚没有在临床上广泛推广。因此,为提高eCCA的早期诊断率及外科手术前的诊断率,我们建议对临床或影像学高度怀疑为eCCA的患者,首先行ERCP下联合球囊扩张术获取活组织病理学诊断,本方法行胆管活检具有操作简便易行,取材充足,活检阳性率高,尤其在不具备SpyGlass操作系统的内镜单位。有条件的地方可联合EUS或SpyGlass获取活组织病理学检查,以进一步提高早期及外科手术前诊断率。
因此,ERCP下球囊扩张联合活检技术用于肝外胆管狭窄的取材活检具有一定的效果,对于老年患者,有外科手术禁忌,且高度怀疑CCA而不能确诊者,可通过此项技术明确诊断,并可经内镜下置入支架等介入性姑息性治疗,减轻患者痛苦,提高患者生存质量。

