解淀粉芽胞杆菌中speE基因在亚精胺合成中的功能鉴定
闵钰,魏雪团
(华中农业大学 食品科学技术学院,湖北 武汉,430070)
亚精胺(spermidine)是一种具有强烈生物活性的低分子脂肪族含氮碱[1],作为多胺的一种,广泛分布于生物体内,参与细胞的增殖、生长、组织再生、DNA和RNA的稳定等过程,在细胞代谢中起重要作用[2-5]。随着人们对亚精胺的逐步研究,发现亚精胺在机体健康和疾病方面具有重要功能,具有诱导细胞自噬、延缓衰老、提高记忆力、保护心血管、预防癌症等多种生物活性[6-9]。有研究表明,随着年龄的增长,人体内亚精胺浓度逐渐降低,这可能会影响人体的健康与寿命[10-13]。而通过外源摄入适量亚精胺来实现人体内亚精胺浓度的平衡,可能是促进健康、延缓衰老的有效策略[14-15]。
目前已报道多种微生物具有合成亚精胺的能力[16-19]。在微生物体内亚精胺可由腐胺(putrescine)和S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)合成,腐胺在亚精胺合成酶(spermidine synthase)作用下接受S-腺苷甲硫氨酸脱羧提供的氨丙基生成亚精胺[20-22]。KIM等[23]通过在酿酒酵母中强化表达鸟氨酸脱羧酶SPE1,S-腺苷甲硫氨酸脱羧酶SPE2和亚精胺合成酶SPE3,同时敲除了鸟氨酸脱羧酶的抑制基因OAZ1,亚精胺的产量达到了63.6 mg/L。随后研究发现,进一步敲除多胺转运蛋白TPO1,亚精胺的产量进一步提升,最终通过发酵放大产量达到了224 mg/L[24]。也有研究者通过在集胞藻中强化表达精氨酸脱羧酶Adc1和Adc2基因,提高了细胞内亚精胺产量[25]。然而,目前的亚精胺产量普遍偏低,亚精胺合成机制和代谢工程育种还有待进一步发展。
解淀粉芽胞杆菌(Bacillusamyloliquefaciens)具有安全性良好、生长快、易于培养等特点,广泛应用于食品、医药、化妆品和农业领域[26-27]。随着芽胞杆菌遗传背景和分子操作工具的不断完善和发展,芽胞杆菌已发展成为新的代谢工程底盘微生物,目前已逐渐被用来生产各种营养强化剂和食品添加剂[28-29],但目前尚未有通过解淀粉芽胞杆菌合成亚精胺的相关报道。KEGG数据库已预测解淀粉芽胞杆菌含有亚精胺合成途径相关基因:speE基因编码亚精胺合成酶,腐胺和S-腺苷甲硫氨酸在亚精胺合成酶催化下生成亚精胺。speE基因处于至关重要的位置,是合成亚精胺的关键,然而其功能尚未通过实验验证。本研究通过基因缺失和回补表达技术,从体内水平探究speE基因对亚精胺合成的影响,首次证实了speE基因在解淀粉芽胞杆菌亚精胺合成中的功能,为后续构建亚精胺高产工程菌株提供了理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
本研究所用到的菌株和质粒如表1和2所示。其中大肠杆菌DH5α用于构建载体,HSPM1为本实验室保存的1株高产SAM的工程菌株。

表1 实验用菌株

表2 实验用质粒
注:Tetr:四环素抗性;Kanr:卡那霉素抗性;orits:温敏型复制子
1.1.2 PCR引物
本研究所用的主要引物见表3。
1.1.3 主要试剂
TransStartRFastPfu DNA聚合酶和 TransStartReasyTaqDNA聚合酶,北京全式金公司;dNTPS、DNA限制性内切酶、T4DNA连接酶、DL5000 Marker,TaKaRa公司;DNA抽提试剂盒,武汉楚诚正茂科技工程有限公司;DNA回收试剂盒和质粒抽提试剂盒,美国OmegaBio-Tek公司;基因引物合成、测序,武汉擎科创新生物科技有限公司;乙腈为色谱级,其他主要生化试剂均为国产分析级纯。

表3 本研究所使用的PCR引物
注:粗体为限制性内切酶酶切位点,下划线为重叠延伸拼接SOE-PCR的重叠区域
1.1.4 主要培养基
LB培养基(g/L):蛋白胨10.0,酵母浸出粉5.0,NaCl 10.0,固体培养基加15~20 g/L的琼脂粉。抗生素培养基添加相应抗生素终质量浓度为20 μg/L。亚精胺发酵培养基(g/L):木糖20.0,(NH4)2SO46.3,蛋白胨10.0,玉米浆20,NaCl 2.5,KH2PO43.0,MgSO4·7H2O 4.2,尿素2.0,天冬氨酸3.0,pH 6.5。
1.1.5 仪器与设备
Thermal Cycler(My Cycler)PCR仪,美国 Bio-Rad 公司;DYY-8C型电泳仪,北京六一仪器厂;HQL300B恒温大幅振荡摇床,武汉中科科仪技术发展有限责任公司;CR21G高速冷冻离心机,日本Hitachi公司;Legend Micro17R高速冷冻离心机,美国Thermo Fisher Scientific 公司;SKP-02.420电热恒温培养箱,黄石市恒丰医疗器械有限公司;Agilent Technologies1260高效液相色谱,美国Agilent公司。
1.2 实验方法
1.2.1 敲除载体的构建
2014年3 月—2017年1月间,采用回顾性、抽样调查方法,选择118例在重庆市开州区人民医院诊治的老年膝关节周围骨肿瘤患者,纳入标准:就诊的初发未治膝关节周围骨肿瘤患者;年龄≥60岁;膝关节周围骨肿瘤诊断依据WHO标准;既往未曾治疗;具有手术指征与化疗指征;本研究得到了本院伦理委员会的批准。排除标准:精神疾病患者;合并严重心肝肾异常患者;妊娠与哺乳期妇女。根据治疗方法不同将其分为各59例患者的观察组与对照组,统计学对比基础资料,两组患者间无差异。见表1。
以B.amyloliquefaciensHZ-12的基因组DNA作为模板,利用上游同源臂引物(ΔspeE-AF,ΔspeE-AR)和下游同源臂引物(ΔspeE-BF,ΔspeE-BR)分别扩增出同源臂序列A和B,产物纯化回收后通过SOE-PCR用引物ΔspeE-AF,ΔspeE-BR将A和B连接起来,并与T2(2)-ori载体同时用限制性内切酶BamH I和XbaI进行双酶切,回收后用T4DNA连接酶连接,采用CaCl2转化法转化到E.coliDH5α感受态细胞。钙转化成功后提取质粒进行双酶切验证并送往测序公司测序,构建成功的敲除质粒命名为T2(2)-oriΔspeE。
1.2.2 基因敲除菌株的构建
将构建成功的质粒电转化入HSPM1感受态细胞中,涂布至含Kan的抗性平板,37 ℃静置培养16~18 h。挑选转化子单菌落于Kan平板上划线,培养8~12 h后用进行PCR菌落验证(引物T2-F,T2-R)。将电转正确的菌株45 ℃下进行单交换,ΔspeE-YF引物和T2引物验证;获得的单交换菌株在37 ℃下双交换,挑选在LB板上长而在Kan抗性板上不长的单菌落,用ΔspeE-YF和ΔspeE-YF验证,筛选到敲除菌株,命名为HSPM1ΔspeE。
1.2.3 游离表达载体的构建
以分别以B.subtillis168基因组、B.amyloliquefaciensHZ-12基因组和B.licheniformisWX-02基因组,根据表3相对应的引物,扩增出P43启动子、speE基因、终止子TamyL。纯化回收PCR产物,以P43-F、TamyL-R为引物通过SOE-PCR连接起来,与pHY300PLK质粒分别用BamH I和XbaI进行双酶切,用T4连接酶连接PCR产物和质粒,并转化至E.coliDH5α感受态细胞。用pHY300-F和pHY300-R对单菌落进行PCR验证,初步确定为阳性转化子后,抽取质粒进行双酶切和DNA测序验证,构建成功的游离表达载体命名为pHYspeE。
1.2.4 基因回补菌株的构建
将抽提的pHYspeE和空载体pHY300PLK电转化至HSPM1ΔspeE感受态中,涂布于Tet抗性平板,37 ℃静置培养。挑选转化子单菌落于Tet平板上划线,用pHY300-F、pHY300-R进行PCR菌落验证。
1.2.5 发酵培养条件
1.2.6 亚精胺液相检测
取0.5 mL发酵液与1.5 mL 0.4 mol/L的高氯酸,混合酸提1 h,(12 000 r/min下离心5 min。吸取250 μL上清液,并依次加入100 μL(1 mg/mL)1, 7-二氨基庚烷,75 μL饱和NaHCO3溶液,50 μL 2 mol/L NaOH溶液以及500 μL(5 mg/mL丙酮)丹磺酰氯衍生剂,上下颠倒混匀。50 ℃水浴,避光反应45 min。再加入25 μL体积分数25% NH3·H2O并上下颠倒混匀,继续放于50 ℃水浴中,避光静置15 min。最后加入30 μL 6 mol/L HCl和575 μL乙腈,10 000 r/min离心5 min,取800 μL上清液0.22 μm有机膜过膜进行测定。
液相检测使用ZORBAX Eclipse XDB-C18 色谱柱,流动相采用超纯水和乙腈进行梯度洗脱,流速1 mL/min,检测波长254 nm,柱温30 ℃,进样量10 μL。
1.2.7 数据统计分析
每组实验设计3个平行,采用SPSS 20.0进行数据统计分析,Origin 8.5进行图表绘制。
2 结果与分析
2.1 speE基因缺失菌的构建及其对亚精胺合成的影响
2.1.1speE基因缺失菌的构建
根据表3中引物获得T2(2)-oriΔspeE敲除质粒的上下游同源臂,分别为546、520 bp,其中speE基因和其启动子一同设计为被敲掉部分,SOE-PCR产物大小为1 066 bp。SOE-PCR融合产物与T2(2)-ori载体分别用BamHⅠ和XbaⅠ进行酶切、酶连后钙转化至E.coliDH5α感受态细胞。PCR验证显示条带正确的单菌落,抽提质粒测序并用BamHⅠ和XbaⅠ酶切质粒,电泳检测结果如图1-a所示,质粒双酶切的跑胶条带大小与预期相符合,测序结果显示正确,表明敲除质粒T2(2)-oriΔspeE构建成功。
将敲除质粒T2(2)-oriΔspeE电转化至HSPM1感受态细胞中,经过单双交换筛选敲除菌株。抽提正确敲除菌株和未敲除菌株DNA,以speE-YF/speE-YR为引物,扩增的片段分别是1 291和2 232 bp,电泳检测结果如图1-b。将PCR扩增产物送往测序公司测序,比对结果正确,表明HSPM1敲除speE基因菌株构建成功,命名为HSPM1ΔspeE。

a-重组质粒T2(2)-oriΔspeE的双酶切验证; b- HSPM1ΔspeE菌株的PCR验证;泳道 1:speE基因上下同源臂SOE-PCR融合片段;泳道 2:BamHⅠ和XbaⅠ双酶切质粒T2(2)-ori;泳道 3:BamHⅠ和XbaⅠ双酶切质粒T2(2)-oriΔspeE;泳道 4:引物ΔspeE-YF和ΔspeE-YR验证HSPM1(2 232 bp);泳道 5:引物ΔspeE-YF和ΔspeE-YR验证HSPM1ΔspeE(1 291 bp)
2.1.2speE基因缺失对亚精胺合成的影响
speE基因编码亚精胺合成酶,腐胺和S-腺苷甲硫氨酸在亚精胺合成酶催化下生成亚精胺。为了考察speE基因对亚精胺合成的影响,按照材料与方法中1.1.5和1.2.5的发酵培养基和培养条件对工程菌株HSPM1ΔspeE进行发酵验证,发酵周期60 h。用分光光度计测生物量OD600,HPLC检测亚精胺含量。结果如图2所示。

图2 speE基因缺失对亚精胺合成的影响
从发酵验证图上看出,HSPM1与HSPM1ΔspeE的生物量OD600无显著差别。对照菌株HSPM1亚精胺产量为36.6 mg/L,而工程菌株HSPM1ΔspeE,未检测到亚精胺。在细菌的生长未受太大影响的情况下,工程菌株HSPM1ΔspeE未检测到亚精胺,说明敲除speE基因后阻断了亚精胺的合成,亚精胺的缺失是由speE基因引起,而不是生物量的降低。为了进一步确认亚精胺的降低是由speE基因缺失引起,构建speE基因回补菌株。
2.2 speE基因回补菌株的构建及其功能验证
2.2.1speE基因回补表达菌株的构建
由于敲除speE基因后,完全不产亚精胺,推测亚精胺合成能力的丧失是由speE基因引起,为了证实speE基因在解淀粉芽胞杆菌中的功能,在HSPM1 ΔspeE菌株的基础上构建speE回补表达菌株,探究speE基因在解淀粉芽胞杆菌中对亚精胺合成的影响。
根据表3的引物扩增出P43启动子、speE基因、TamyL终止子大小与理论值大小一致(分别是305、831和501 bp)。SOE-PCR产物大小为1 637 bp,纯化后与pHY300PLK载体分别用BamH I和XbaI进行酶切,用T4连接酶酶连后钙转化至E.coliDH5α感受态细胞。选取验证正确的阳性转化子,抽提质粒并用BamH I和XbaI酶切质粒,电泳检测结果如图3-a,条带大小与预期符合一致,测序结果显示正确,表明pHY-speE质粒构建成功。
游离表达质粒pHY-speE电转化至HSPM1ΔspeE中,挑选阳性转化子用pHY300-F、pHY300-R进行PCR验证,验证结果如图3-b。并送往测序公司进一步验证碱基序列,比对结果无误后表明HSPM1ΔspeE/pHYspeE工程菌株构建成功。

a-重组质粒pHY-speE的双酶切验证;b-菌株HSPM1ΔspeE/pHYspeE的PCR验证;泳道1:speE基因、P43启动子、TamyL终止子SOE-PCR融合片段;泳道2:BamH I和Xba I双酶切质粒pHY300PLK;泳道3:BamH I和Xba I双酶切质粒pHY-speE;泳道4~5:引物pHY300F和pHY300R验证HSPM1ΔspeE/pHYspeE电泳图
2.2.2speE基因回补对亚精胺合成的影响
按照材料与方法中1.1.5和1.2.5的发酵培养基和培养条件对工程菌株HSPM1、HSPM1ΔspeE、HSPM1ΔspeE/pHY300、HSPM1ΔspeE/pHYspeE进行发酵验证,发酵周期60 h。发酵终点检测生物量OD600和亚精胺产量。结果如图4所示。
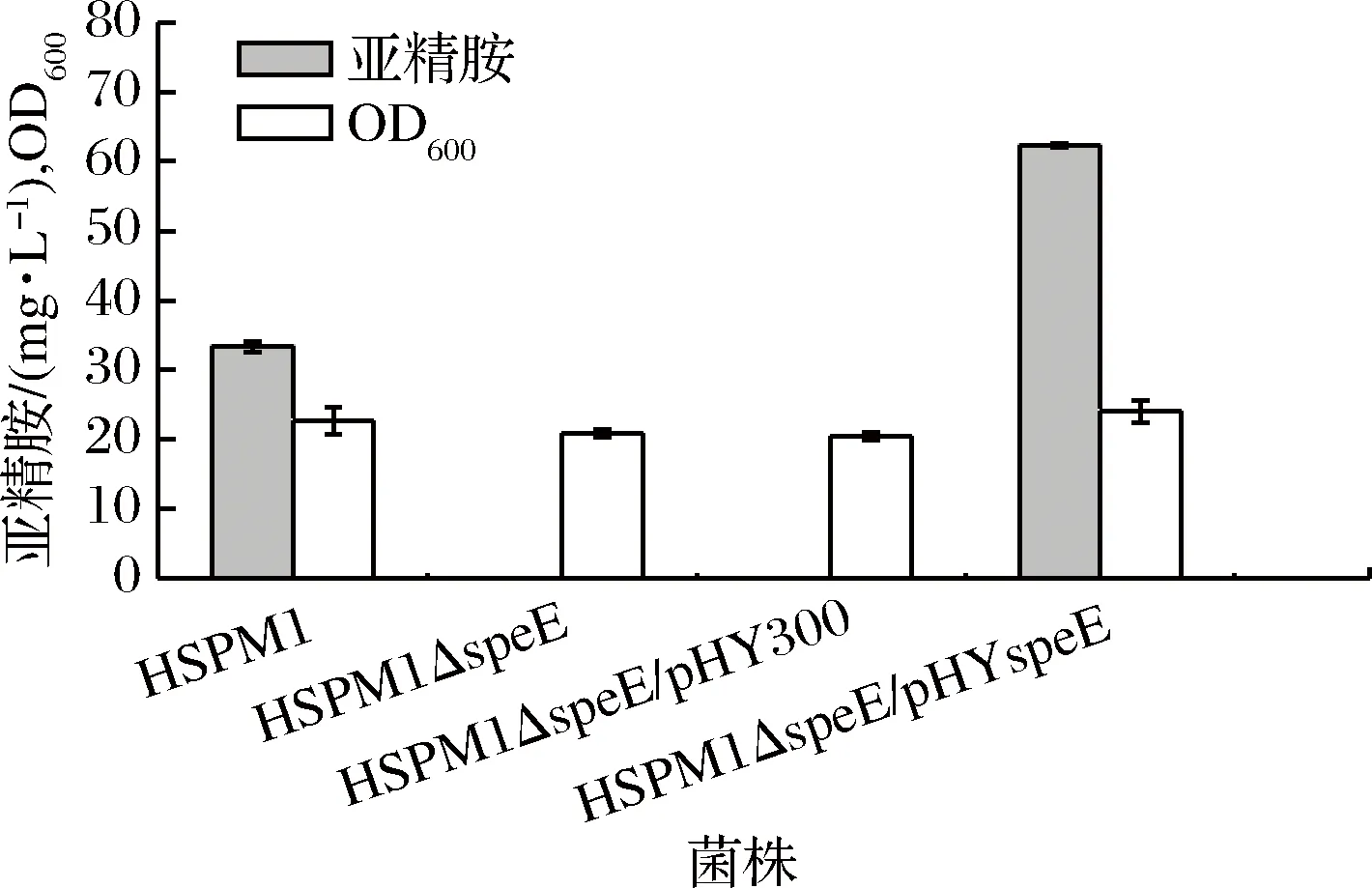
图4 speE基因回补对亚精胺合成的影响
从图4看,4株工程菌的生物量OD600值无明显差别。工程菌株HSPM1ΔspeE/pHYspeE的发酵产量是62.32 mg/L,与对照菌HSPM1ΔspeE相比,回补speE基因后,亚精胺合成得到恢复,甚至高于未敲除speE基因的初始菌株HSPM1(33.34 mg/L),这可能是由于游离表达质粒的拷贝数高所引起的。上述结果表明基因互补后,被阻断的亚精胺合成途径被修复,亚精胺的合成能力也得到恢复,进一步证实了speE基因是亚精胺合成途径上的关键基因,证实了speE基因在亚精胺合成中的必要性,鉴定了speE基因在解淀粉芽胞杆菌中的功能。
3 结论
亚精胺是一种具有广泛生物活性的生物胺,参与人体各类代谢反应。但是其高效生物合成却一直是广大科研工作者难以攻破的难题。本研究首次探究了解淀粉芽胞杆菌所预测的speE基因在亚精胺合成中的功能,成功构建了speE基因的缺失菌株HSPM1ΔspeE、回补菌株HSPM1ΔspeE/pHYspeE。通过发酵实验,发现缺失speE并不会影响菌株的生物量,但却显著影响亚精胺的产量,直接导致菌株不产亚精胺;回补speE基因后菌株恢复亚精胺合成能力,从体内水平证实了speE基因在亚精胺合成中的功能。本研究首次证实了speE基因在解淀粉芽胞杆菌合成亚精胺中的功能,为亚精胺高产菌株的代谢工程育种提供了重要的基因资源。

