德式乳杆菌保加利亚亚种的乳清蛋白利用能力比较
陈嘉琪,崔树茂,唐鑫,刘小鸣,赵建新,陈卫
(江南大学 食品学院,江苏 无锡,214122)
德式乳杆菌保加利亚亚种是一种常用于发酵食品生产的乳酸菌。除了产生乳酸外,德式乳杆菌保加利亚亚种还普遍具有良好的蛋白质水解体系[1],其蛋白水解体系主要包括:将大分子蛋白水解成多肽的胞外蛋白酶、将多肽转运至胞内的转运系统、将多肽进一步水解成寡肽或氨基酸的肽酶。氨肽酶是一类从肽链的氨基末端水解肽并释放N端氨基酸的酶,是蛋白代谢的关键酶之一,包括特异性较差的金属氨肽酶PepN和巯基氨肽酶(半胱氨酸氨肽酶)PepC和丝氨酸酶X-脯氨酰二肽氨基肽酶PepX[2-3]。PepN和PepC能够水解2~12个氨基酸组成的寡肽[4],但是对含有脯氨酸(Pro)的氨基肽酶底物活性较低;而PepX能够从富含脯氨酸的乳清蛋白寡肽中释放X-Pro二肽,其对Gly-Pro-对硝基苯胺(pNA)以及其他X-Pro-pNA底物均具有高活性[5]。
乳清蛋白的主要成分β-乳球蛋白(β-Lg)和α-乳白蛋白(α-La)是主要过敏原之一[6-9]。在超过80%的牛乳过敏病例中,β-Lg是儿童和婴儿牛奶过敏的主要诱因。而人群研究结果表明,牛奶过敏患者中α-La特异性血清免疫球蛋白E的患病率为27.6%~62.8%[10]。已有研究发现,微生物发酵过程中产生的蛋白水解酶具有降解牛奶蛋白过敏原的能力,德式乳杆菌保加利亚亚种可通过水解α-La和β-Lg,有效降低乳清蛋白的过敏性。BU等[11]的研究结果表明,经德氏乳杆菌保加利亚亚种发酵后,乳清蛋白的抗原性显著降低,α-La和β-Lg的抑制率分别为53%和89%(P<0.05)。此外,保加利亚乳杆菌发酵还可提高α-La和β-Lg的消化率,降低乳清蛋白的抗原性。KLEBER等[9]发现德氏乳杆菌保加利亚亚种和嗜热链球菌联合发酵对降低甜乳清和脱脂乳中的β-lg抗原性也非常有效。
虽然前期研究发现了德氏乳杆菌保加利亚亚种在乳清蛋白水解方面的应用潜力,但是尚未阐释发酵过程中菌株的氨肽酶活力与乳清蛋白水解能力之间的相关性。因此本文选取了8株德氏乳杆菌保加利亚亚种菌株,检测其在乳清蛋白培养体系中的3种主要氨肽酶PepN、PepC和PepX活力变化情况,探讨不同菌株氨肽酶活力变化与乳清蛋白水解能力之间的相关性,进一步探讨应用德式乳杆菌保加利亚亚种制备低致敏性发酵乳清蛋白饮料的机制。
1 材料与方法
1.1 材料与试剂
1.1.1 实验试剂
WPI(分离乳清蛋白,美国安格普有限公司,货号LE 007-7-297,主要成分包括蛋白干态(Nx6.38)95.7%,水分4.4%,灰分1.7%,脂肪0.4%,乳糖0.2%);BCA蛋白浓度测定试剂盒P0010(上海碧云天有限公司);氨肽酶底物L-赖氨酸-对硝基苯胺(L-Lys-pNA);H-精氨酸-对硝基苯胺(H-Arg-pNA);H-甘氨酰-脯氨酸-对硝基苯胺(H-Gly-Pro-pNA)(江苏吉泰肽业有限公司);5’-磷酸吡哆醛、苯丙酮酸钠、对硝基苯胺(阿拉丁试剂有限公司);MRS培养基、MgSO4·7H2O、FeSO4·7H2O、1水合α-乳糖、MnSO4·H2O、吐温80、对氨基苯甲酸、叶酸、L-苯丙氨酸、α-酮戊二酸、EDTA二钠、乙腈、三氟乙酸(国药集团化学试剂有限公司)。以上均为分析纯。
1.1.2 实验菌株
实验所使用的8株德式乳杆菌保加利亚亚种均保存于江南大学食品生物技术中心,其中6株分离筛选自中国青海西宁、四川阿坝及新疆塞铃木的牦牛酸奶和牦牛曲拉,菌株保藏编号分别为DQHXNS1L2、DQHXNS8L6、DQHXNS15M2、DXJSLMS1M5、DSCAB10M20和D11M188,2株对照菌株编号分别为Lb.2038(分离筛选自日本明治酸奶)和ATCC 11842(购于北纳生物有限公司,分离自保加利亚酸奶)。
1.2 仪器与设备
SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;AW500SG厌氧工作站,英国依莱泰科公司;立式自动压力蒸汽灭菌器GR60DA,厦门致微仪器有限公司;蒸汽灭菌锅 SX-300,日本Tomy;分析天平,梅特勒-托利多(上海)有限公司;HWS-150恒温恒湿培养箱,上海森信实验仪器有限公司;pH计ST3100,常州奥豪斯仪器有限公司;台式高速冷冻离心机TGL-16M、台式高速离心机TG16A,上海卢湘仪离心机仪器有限公司;多功能酶标仪Varioskan LUX,赛默飞世尔科技有限公司;Waters 1525EF高效液相色谱仪,美国沃特世公司。
1.3 实验方法
1.3.1 培养条件
乳清蛋白培养基组成参考LIU等[1]的配方并进行修改。每100 mL乳清蛋白培养基包含4.5 g乳糖、1 g WPI、0.024 g MgSO4、0.003 g MnSO4、0.001 g FeSO4、0.100 g吐温80、20 μg对氨基苯甲酸和10 μg叶酸。用HCl溶液调节培养基pH分别至6.5、6.0、5.5和5.2后,用0.45 μm的无菌滤膜进行过滤,分装至5 mL灭菌试管后使用。
1.3.2 发酵过程中生长及产酸速率的测定
接种后的发酵液置于40 ℃培养,于0、3、6、9及12 h取样测定pH,并进行10 倍稀释至10-6,MRS平板计数。
1.3.3 无细胞提取液的制备
分别取发酵至0、3、6、9及12 h的样品,4 000×g,4 ℃ 离心10 min,用50 mmol/L 磷酸钠缓冲液(pH 7.5)重悬并离心,重复3次后将菌体重悬于相同的缓冲液中至终体积为2 mL。采用液氮研磨的方法破碎细胞,将含有菌体的缓冲液振匀后置于研钵中,加入一定体积的液氮不断研磨,反复冻融3次,之后收集研磨物,12 000×g,4 ℃离心10 min,收集上清液,-80 ℃冰箱保存,备用。
1.3.4 氨肽酶活力的测定
根据STEFANOVIC等[12]的方法,将底物L-Lys-pNA、H-Arg-pNA及H-Gly-Pro-pNA用50 mmol/L磷酸钠缓冲液(pH 7.5)制成1 mmol/L的溶液。96孔板每个孔中加入50 μL底物和50 μL无细胞提取液后,37 ℃孵育30 min,于405 nm处测定吸光值,每个样品重复测定3次。氨基酸肽酶的活性定义为:单位酶量每分钟每毫克蛋白释放对硝基苯胺的量。标准曲线的绘制:配制不同浓度(5~300 μmol/L)的对硝基苯胺溶液,每个浓度取100 μL在 405 nm 测定吸光值,重复测定3次,获得标准曲线。空白对照用缓冲液代替CFE;蛋白含量用BCA试剂盒平行测定3次。
1.3.5 乳清蛋白利用情况的测定
参考朱鑫鑫等[13]的方法并进行修改。采用反向液相色谱的方法对8株德式乳杆菌保加利亚亚种(以下简称保加利亚乳杆菌)水解乳清蛋白主要成分的能力进行分析。(1)样品预处理:取0、3、6、9及12 h的发酵样品,6 000×g,4 ℃离心10 min,取上清液,用0.45 μm的尼龙膜过滤。(2)色谱条件:以Xbridge Peptide BEH C18为色谱柱(300 A,3.5 μm),检测波长为215 nm,进样量为10 μL,流速为0.8 mL/min,柱温30 ℃,洗脱时间22 min,流动相A为体积分数0.1%的三氟乙酸水溶液,流动相B为体积分数0.1%的三氟乙酸乙腈溶液,采用梯度洗脱方式。洗脱梯度:0 min:体积分数64%流动相A;2 min:体积分数64%流动相A;7~17 min:体积分数58%流动相A;19 min:体积分数64%流动相A;19~22 min:体积分数64%流动相A。
1.3.6 统计分析及数据处理
本文中所有数据均采用Microsoft excel 2016软件统计分析,采用Origin 2017软件绘图,每个试验重复3次。
2 结果与讨论
2.1 乳清蛋白培养基初始pH对菌株生长能力的影响
为了探讨乳清蛋白培养基初始pH对菌株的生长能力的影响,选择已报道可利用乳清蛋白的Lb.2038分别在初始pH值为6.5、6.0、5.5和5.2四种体系中进行发酵,比较不同条件下菌株的生长和产酸速率的差异性(图1)。
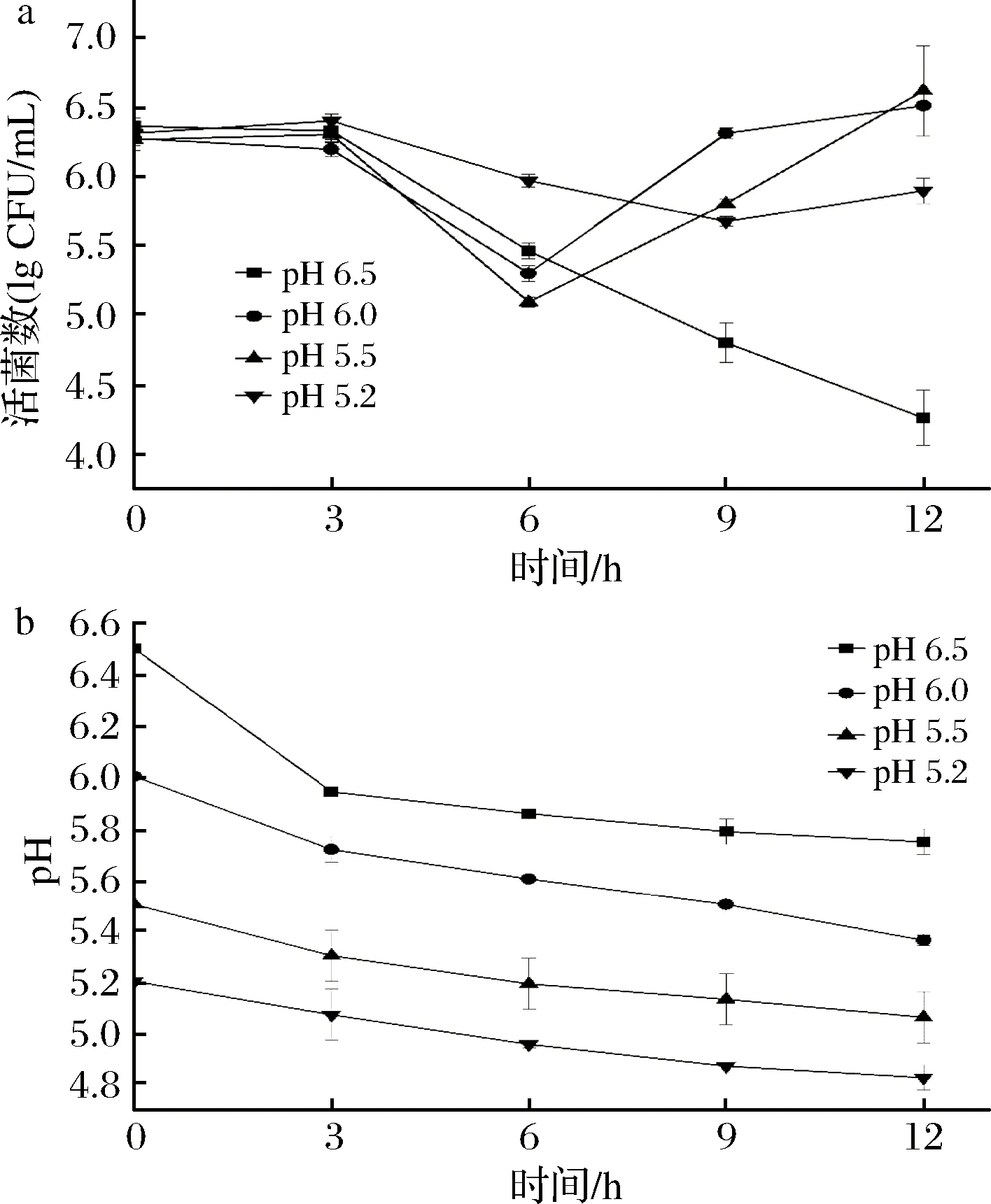
a-活菌数;b-pH
菌株Lb.2038在不同初始pH的乳清培养基中展示出了差异显著的生长曲线,从MRS培养基体系接种到营养限制型的乳清蛋白培养基后出现了一段时间的调整期,在0~6 h期间,4种条件下的活菌数均低于初始接种量。培养6 h后,在pH 6.0和pH 5.5条件下的菌株生长速率优于pH 6.5和pH 5.2,12 h后,在pH 6.0和pH 5.5体系下的菌株生长量接近于初始接种量,pH 5.2体系下的活菌数低于初始接种量,而在pH 6.5的培养条件下活菌数持续下降。与本文研究结果一致,LIU等[14]在相似的乳清蛋白培养基中的实验中也发现,初始pH 5.5时菌株Lb.2038的生长速率较高。初始pH对菌株在乳清蛋白培养基中生长的影响可能与乳清蛋白的构象有关。根据SCAR等[15]的研究结果,当乳清蛋白的pH接近等电点时,蛋白分子间静电排斥力减弱,会发生结构重排,蛋白的α-螺旋结构降低,表面疏水性增大,—CO与NH—之间的氢键被破坏,因此在初始pH 5.5时,菌株对蛋白的水解程度增大,从而有效水解蛋白以维持自身的生长繁殖,表现出比其他3种初始pH值更高的生长量。
初始pH值对菌株产乳酸能力也有影响。在pH 6.5的培养条件下,菌株在0~3 h内迅速产酸,之后随着活菌数的下降产酸几乎停滞。在其他3种初始pH值的培养条件下,各菌株的产酸速率大致相仿,初始pH值为6.0时的产酸速率略快于初始pH值为5.5和5.2时的产酸速率。基于以上实验结果,本文的后续实验中均采用初始pH为5.5的乳清蛋白培养基对菌株进行活化与发酵。
2.2 发酵过程中不同菌株的生长情况及产酸速率
8株保加利亚乳杆菌的生长曲线如图2所示。
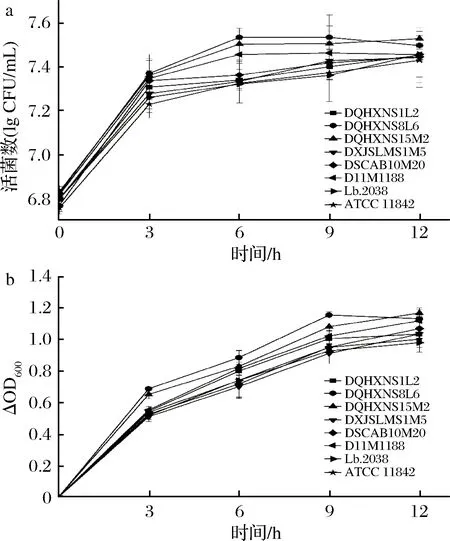
a-活菌数;b-OD600
在乳清蛋白培养基中,8株保加利亚乳杆菌的生长对数期均在0~3 h内、3~6 h之后缓慢生长至稳定期,而在MRS培养基[16]或脱脂乳[17]中保加利亚乳杆菌则会经历4 h的延滞期。这一结果表明,保加利亚乳杆菌在经过同体系活化后,能够快速利用乳清蛋白。其中,生长量最高的是菌株DQHXNS8L6和DQHXNS15M2,12 h时活菌数分别达到7.50和7.53 lg CFU/mL,而生长量最低的是菌株DXJSLMS1M5和ATCC 11842,12 h时活菌数分别为7.44和7.43 lg CFU/mL。但可能由于营养物质及单一氮源的限制,12 h内8株菌的活菌数增量仅为0.6~0.7个数量级,且菌株间无显著性差异。OD600测定值表现出相似的生长情况,菌株在3 h内即进入对数期,9 h后到达稳定期。其中,生长速率最快的是DQHXNS8L6和DQHXNS15M2,ΔOD600分别为1.14±0.02和1.17±0.02,而菌株2038仅为0.98±0.03。营养成分不同的乳清蛋白对于菌株的生长能力具有较大影响,PESCUMA等[19]利用含10%蛋白、76.5%乳糖及0.45%钠盐的重组乳清蛋白粉对64株乳酸菌的生长进行研究时发现,81%的菌株活菌数增量在6 h内时大于1个数量级,而LIU等[14]利用牛奶中沉淀酪蛋白后的乳清蛋白发酵德式乳杆菌保加利亚亚种和嗜热链球菌4 h后,菌株的生长量与本文一致。
8株保加利亚乳杆菌的pH变化曲线如图3所示。其中,pH变化最快的是菌株D11M188和DQHXNS15M2,12 h分别达到0.84±0.08和0.77±0.07,pH下降最慢的是菌株ATCC 11842,12 h pH仅下降0.56±0.12,且其生长能力也较差。相比于在氮源丰富的脱脂乳中部分保加利亚乳杆菌能够在6 h内pH从6.5下降至5.2~4.7[19],在乳清蛋白体系中,所有菌株均表现出较低的生长速率和产酸能力。但这一结果仍然表明,保加利亚乳杆菌可以仅利用乳清蛋白进行生长和代谢,这与LIU等[1]的结论一致。
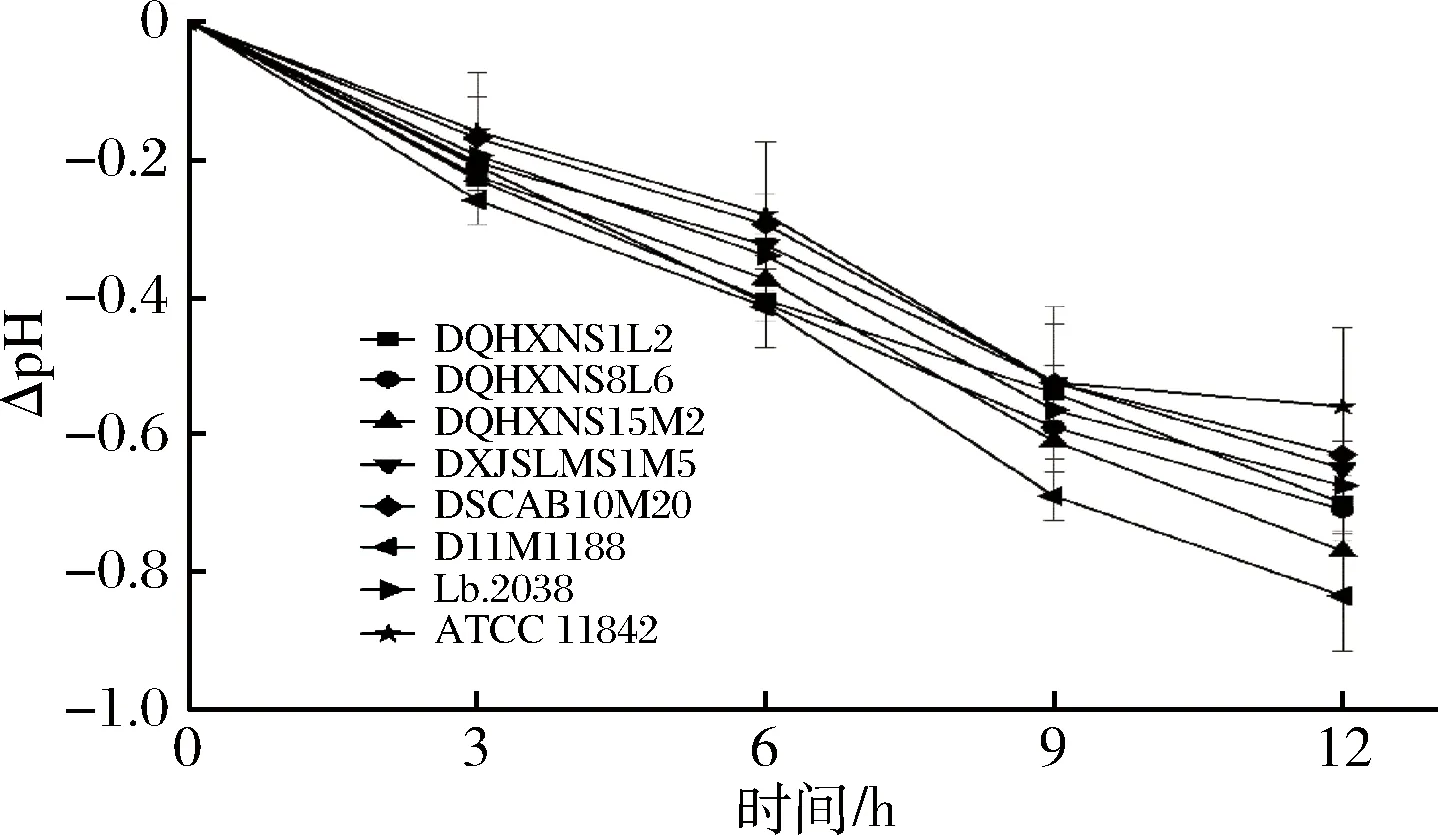
图3 德式乳杆菌保加利亚亚在乳清蛋白培养基中的pH变化
2.3 发酵过程中不同菌株的3种氨肽酶活力
为了评估8株保加利亚乳杆菌在乳清蛋白培养基发酵过程中的氨肽酶(PepN、PepX、PepC)活力,分别使用含L-Lys-pNA、H-Arg-pNA和H-Gly-Pro-pNA的显色底物测定保加利亚乳杆菌氨肽酶PepN、PepC和PepX的酶活力水平,结果如图4所示。
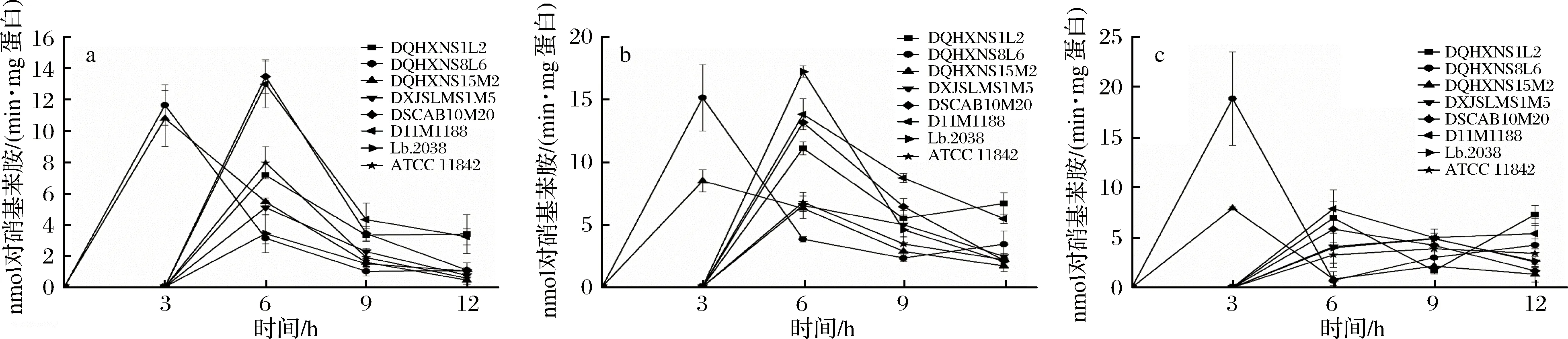
a-PepN;b-PepC;c-PepX
从图4可以看出,在12 h的发酵过程中,8株保加利亚乳杆菌对3种不同肽酶底物的酶活力和变化趋势显示出显著差异(图4)。在3 h时菌株DQHXNS8L6和DQHXNS15M2具有最高的3种氨肽酶活力,而其余菌株由于生长速率相对缓慢,此时仍未表现出氨肽酶活性,6 h之后8株菌均具有3种氨肽酶活力且大部分菌株在6 h时3种氨肽酶活力最高。菌株的PepN和PepC酶活力变化趋势相似,大部分菌株都呈现出先上升后下降的趋势,而8株保加利亚乳杆菌的PepX酶活力普遍低于PepN和PepC,且不同菌株的变化趋势差异较大。整个发酵过程中,达到最高PepN酶活力的是菌株DSCAB10M20和D11M188,其PepN酶活力范围分别为从0~13.49和13.00 nmol 对硝基苯胺/(min·mg蛋白);达到最高PepC酶活力的是菌株Lb.2038,其PepC酶活力范围从0~17.17 nmol对硝基苯胺/(min·mg蛋白);菌株DQHXNS8L6在3 h表现出18.81 nmol对硝基苯胺/(min·mg蛋白)的PepX酶活力,显著高于其他菌株。比较3种不同的氨肽酶活力,发现除菌株DQHXNS8L6对PepX表现出最高的酶活力外,其余菌株的3种氨肽酶最高活力基本表现为PepC>PepN>PepX,这与MARIE等[5]对瑞士乳杆菌在MRS和脱脂乳培养基的研究结果一致,研究表明菌株对不同底物的酶活力表现为L-Arg-pNA>H-Lys-pNA>H-Gly-Pro-pNA。
2.4 发酵过程中不同菌株的乳清蛋白组分消耗率分析
如图5所示,8株保加利亚乳杆菌对于乳清蛋白中的4种主要成分具有不同的水解能力。其中,8株菌株对BSA和α-La的水解能力无明显差异(图5),而8株菌株对于β-Lg的利用能力具有显著的菌株差异性。8菌株对于α-La均具有较强的水解能力,消耗量范围为26.93%~31.33%,但菌株间无显著性差异。值得注意的是,8株保加利亚乳杆菌对β-Lg的变异体[20]β-LgA和β-LgB的消耗量范围分别为10.56%~22.82%和9.04%~23.83%。从3 h起,菌株DQHXNS8L6、DQHXNS15M2和DQHXNS1L2对于β-LgA的利用能力就显著高于其他菌株。对于β-LgB,菌株DQHXNS8L6、DQHXNS15M2同样在3 h就表现出较强的水解能力,而菌株ATCC 11842对于β-LgA和β-LgB的水解能力均较弱。实验结果表明,部分保加利亚乳杆菌具有潜在发酵乳清蛋白的能力。与本文研究结果一致,PESCUMA等[21]发现部分菌株具有更强的蛋白水解能力,他们使用3种不同的乳酸菌水解补充浓缩乳清蛋白的CDM培养基时发现,保加利亚乳杆菌CRL 454比其他菌株更大程度地降解α-La和β-Lg(分别为26%和21%)。
根据实验结果,8株保加利亚乳杆菌对α-La的水解能力相似,而对β-Lg的水解能力表现出较大的菌株差异性,同时菌株对β-Lg的水解能力与氨肽酶PepN、PepC和PepX酶活力之间存在相关性,在发酵过程前期表现出高氨肽酶活力的菌株对于β-Lg的2种变异体均有较高的水解能力。由于3种氨肽酶底物分别为L-Lys-pNA、H-Arg-pNA和H-Gly-Pro-pNA,α-La序列由146个氨基酸组成,其中PepN和PepC对应的Lys和Arg切割位点分别有12个和1个,PepX对应的X-Pro位点共2个;β-Lg及其前体肽序列由182个氨基酸组成,其中PepN和PepC对应的Lys和Arg切割位点分别有16个和3个,PepX对应的X-Pro位点共8个,β-Lg含有的3种氨肽酶对应的切割位点均多于α-La,而BSA虽然含有较多的3种底物酶切位点,但其在WPI中的含量(3.38%)远低于β-Lg和α-La,因此PepN、PepC和PepX的酶活力更能反映出β-Lg的水解情况。然而,蛋白水解体系是一个复杂的系统,除了氨肽酶活力外,一方面菌株的胞壁酶活力和多肽转运系统对菌株的蛋白水解能力具有重要影响[22-23];另一方面乳清蛋白本身的特性及变性程度也会影响菌株的蛋白利用能力[24],因此要深入研究保加利亚乳杆菌对于乳清蛋白利用能力的机制仍需结合多方面因素进一步分析。
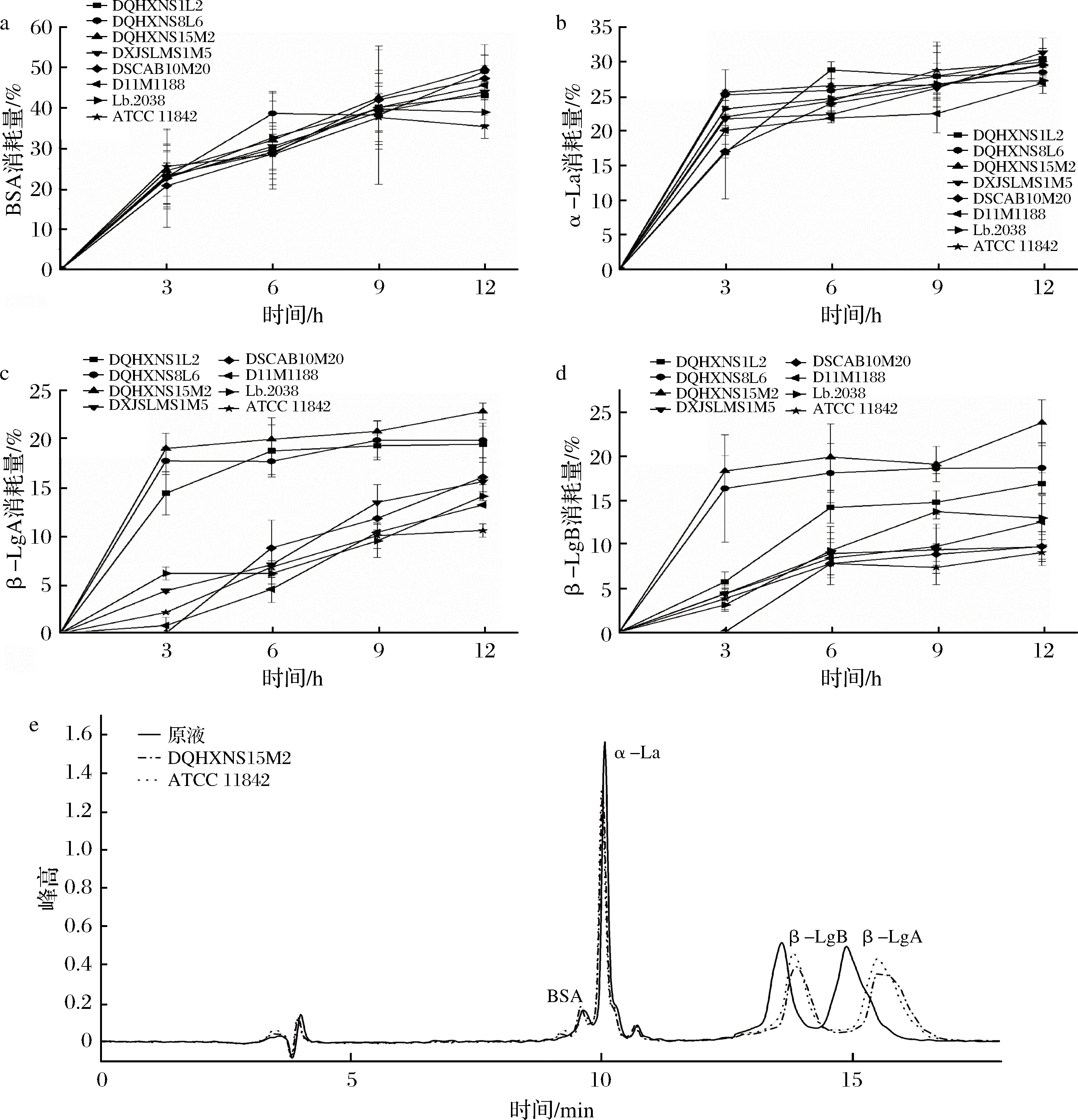
a-BSA消耗量;b-α-La消耗量;c-β-LgA消耗量;d-β-LgB消耗量;e-菌株DQHXNS15M2和ATCC 11842蛋白消耗量峰面积对比图
3 结论
实验结果表明,德式乳杆菌保加利亚亚种在乳清蛋白培养基中最适宜菌株生长的初始pH值是5.5,在该体系中,德式乳杆菌保加利亚亚种能够在3 h内快速生长到达稳定期。菌株的3种氨肽酶活力(PepN、PepC、PepX)在发酵12 h过程中均表现出先升高后降低的变化趋势,但不同菌株之间的氨肽酶活力也存在显著差异性。不同德式乳杆菌保加利亚亚种对于乳清蛋白组分BSA和α-La的水解能力基本相同,但对于β-Lg的水解能力存在明显的菌株差异性,β-乳球蛋白的变异体A和B的水解范围分别是10.56%~22.82%和9.04%~23.83%。此外,菌株的氨肽酶活力与β-Lg水解能力之间存在一定相关性,菌株DQHXNS8L6和DQHXNS15M2在3 h即能达到最高的氨肽酶活力并较大程度地水解β-Lg,而其余菌株在6 h时表现出发酵过程中的最高酶活力,这类菌株对于β-Lg的水解能力也相对较弱。
本文基于德式乳杆菌保加利亚亚种在乳清蛋白培养体系的氨肽酶活力及蛋白利用能力进行分析,可筛选出具有较高氨肽酶活力并具有良好α-La和β-Lg利用能力的菌株,对发酵乳清蛋白饮料的研究具有一定价值,但尚需对于不同菌株水解乳清蛋白后的产物分析进行进一步研究。

