PMP柱前衍生化HPLC法测定地参多糖的单糖组成
黄小兰,何旭峰,杨勤,张椿翊,周浓
1(重庆三峡学院 生物与食品工程学院,三峡库区道地药材绿色种植与深加工重庆市工程实验室,重庆 万州,4041200 2(重庆市万州食品药品检验所,重庆 万州,404120)3(重庆三峡医药高等专科学校 中医学院,重庆 万州,404120)
地参俗称虫草参、银条菜、瓜儿苗,为唇形科植物毛叶地瓜苗(LycopuslucidusTurcz.var.hirtusRegel)的干燥根茎,是一种传统的药食兼用佳品[1-2]。地参含有丰富的多糖类、萜类与甾体、酚酸类、黄酮类、挥发油等化合物[3-6],其中地参多糖因具有抗氧化[7]、抗肿瘤[8]、免疫调节[6,9]、降血糖[10]等生物活性而备受关注。
地参在我国分布较为广泛,主要产区包括云南、重庆、山东、四川、陕西、河北及东北等地[11]。目前有关地参多糖的研究多集中于总多糖的提取工艺优化[12-14]及其生物活性[7-10]方面,但是对地参多糖整体的单糖组成分析及深入研究鲜见报道。而植物多糖的生物活性与其单糖组成、比例等密切相关[15-18]。本研究采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone, PMP)柱前衍生化法[19-22],即单醛糖在碱性条件下,与PMP相结合生成具有紫外吸收的化合物,建立高效液相色谱仪-二极管阵列检测器(high performance liquid chromatography-photo diode array, HPLC-PDA)检测地参单糖组成的方法,并通过主成分分析对不同产地的地参样品中单糖进行差异分析,旨在为地参多糖的研究提供参考。
1 材料与方法
1.1 材料与试剂
地参采自或委托采集于云南、重庆、广西、江苏、山东等地参栽培基地(表4),鉴定为唇形科植物毛叶地瓜苗(LycopuslucidusTurcz.var.hirtusRegel)的干燥根茎。
D-甘露糖、鼠李糖、葡萄糖醛酸、D-半乳糖、阿拉伯糖、岩藻糖标准品(批号分别为:DST170307-047、DST190315-033、DST1180427-567、DST190312-063、DST190304-011、DST180427-565,纯度均≥98%以上),成都德思特生物技术有限公司;半乳糖醛酸标准品(批号:111646-200301,纯度≥98%以上),中国食品药品检定研究院;D-无水葡萄糖标准品(批号:Must-3122601,纯度≥98%以上),成都曼思特生物科技有限公司。
石油醚(60~90 ℃)、无水乙醇、正丁醇、三氯甲烷、三氟乙酸(TFA)、HCl、NaOH、PMP、NaH2PO4、Na2HPO4均为分析纯,成都科龙化学品有限公司;色谱纯乙腈,迪马科技公司。
1.2 仪器与设备
LC-20AT型高效液相色谱仪(配二极管阵列检测器PDA),日本岛津公司;Milli-Q Advantage A10型超纯水机(电阻率≥18.2 MΩ·cm),美国Millipore公司;Sigma 4-16S型与Sigma 3-30KS型高速离心机,德国Sigma公司;IKA MS3型涡旋混合器,德国IKA公司;Sartorius SQP电子分析天平(精密度为0.01 mg),德国Sartorius公司;KH-2000DB型超声波清洗机(功率2 000 W,频率40 kHz),昆山禾创超声仪器有限公司;DZKW-S-6型电热恒温水浴锅,北京市永光明医疗仪器有限公司;BPG-9240A型精密鼓风干燥箱,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 对照品溶液的制备
分别称取D-甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、D-无水葡萄糖、D-半乳糖、阿拉伯糖、岩藻糖8种单糖对照品适量,用水溶解制得质量浓度分别为0.672 2、1.330 8、0.834 0、0.568 0、2.071 7、2.039 4、0.514 5、0.576 2 mg/mL的对照品储备液,并逐级稀释成不同质量浓度的混合对照品溶液。
1.3.2 样品溶液的制备
1.3.2.1 地参多糖的提取[12-14]
地参样品经50 ℃干燥,粉碎过35目筛,备用。
脱脂:取一定量的地参粉末,加入适量石油醚(60~90 ℃),在60 ℃水浴中回流1.5 h脱脂,挥干溶剂。
提取:准确称取1 g(精确至0.000 1 g)脱脂后的样品于50 mL离心管中,加入10 mL 80 ℃蒸馏水超声提取(功率300 W,频率40 kHz),30 min取出放至室温,加入Sevage试剂[V(正丁醇)∶V(三氯甲烷)=1∶5]10 mL,涡旋2 min,4 000 r/min离心5 min,取上清液于锥形瓶中,加水10 mL,重复操作2次,合并上清液,加入5倍体积的无水乙醇,摇匀。于4 ℃条件下静置24 h,离心,弃去上清液,用无水乙醇洗涤沉淀2次,除掉单糖及低聚糖成分,水浴挥干无水乙醇,用水将沉淀溶解并转移至10 mL容量瓶中,定容至刻度,摇匀,制得地参多糖溶液,备用。
1.3.2.2 地参多糖的水解
取上述地参多糖溶液1.0 mL于顶空瓶中,加入2.0 mol/L三氟乙酸溶液2.0 mL,迅速密封。110 ℃条件下水解5 h,取出,冷却至室温,用5 mol/L NaOH溶液调节pH至7.0,转移至5 mL容量瓶中并定容至刻度,摇匀备用。
1.3.2.3 地参单糖的衍生
分别取1.3.1的单糖混合标准溶液及1.3.2.2中的地参多糖水解溶液200 μL于10 mL离心管中,加入0.5 mol/L NaOH溶液200 μL,混匀,再加入0.5 mol/L PMP甲醇溶液500 μL,混匀,在70 ℃水浴条件下衍生1 h,取出,冷却至室温,加入0.5 mol/L HCl溶液200 μL,混匀,加入三氯甲烷1.0 mL,涡旋1 min,8 000 r/min冷冻离心5 min,弃去下层液,重复3次,除掉多余的PMP溶液,取上清液定容至2 mL,用0.22 μm微孔滤膜过滤,即得。
1.3.3 色谱条件[19-20,22]
色谱柱:资生堂CAPCELL PAK C18柱(4.6 mm×250 mm,5 μm);检测波长249 nm;柱温30 ℃;进样量10 μL;流速1.0 mL/min;流动相:A为乙腈,B为0.1 mol/L磷酸盐缓冲溶液(pH 6.75),梯度洗脱程序如表1所示。

表1 单糖衍生物的梯度洗脱程序
1.3.4 地参多糖水解条件的单因素实验
1.3.4.1 三氟乙酸浓度的考察
分别取1.0 mL多糖水溶液(S1)于5个顶空瓶中,平行3份,分别加入2.0 mL浓度为1.0、1.5、2.0、2.5、3.0 mol/L的三氟乙酸溶液,110 ℃水解5 h,以水解后的葡萄糖、半乳糖含量以及单糖总含量考察三氟乙酸溶液浓度的影响。
1.3.4.2 水解温度的考察
分别取1.0 mL多糖水溶液(S1)于5个顶空瓶中,平行3份,加入2 mol/L三氟乙酸溶液2.0 mL,分别在80、90、100、110、120 ℃水解5 h,以水解后的葡萄糖、半乳糖含量以及单糖总含量考察水解温度的影响。
1.3.4.3 水解时间的考察
分别取1.0 mL多糖水溶液(S1)于5个顶空瓶中,平行3份,加入2 mol/L三氟乙酸溶液2.0 mL,于110 ℃下分别水解3、4、5、6、7 h,以水解后的葡萄糖、半乳糖含量以及单糖总含量考察水解时间的影响。
1.3.5 数据处理
采用Microsoft Excel 2007软件和SPSS 22.0软件对数据进行处理。
2 结果与分析
2.1 流动相体系的选择
参考文献[19-20,22],流动相体系主要为磷酸盐缓冲液-乙腈反相等度洗脱。本试验采用V(0.1 mol/L磷酸盐缓冲液)∶V(乙腈)=83∶17等梯度洗脱时,8种单糖衍生物均能够很好的分离,但是分析时间长达65 min。提高乙腈比例可以有效缩短分析时间,但是会造成鼠李糖和葡萄糖醛酸分离度不够,故本试验采用梯度洗脱,既能达到良好的分离度,同时缩短分析时间,目标物在45 min出峰完成。在优化后的色谱条件下对标准品和样品进行测定,结果见图1。

1-甘露糖;2-鼠李糖;3-葡萄糖醛酸;4-半乳糖醛酸;5-葡萄糖;6-半乳糖;7-阿拉伯糖;8-岩藻糖
2.2 地参多糖水解条件的确定
2.2.1 三氟乙酸浓度对地参多糖水解的影响
由图2可知,随着三氟乙酸浓度的增大,地参多糖水解能力增强,相应的单糖含量增多,当浓度大于2.0 mol/L时,单糖含量略有下降趋势,这可能与多糖在高浓度酸的条件下发生水解逆反应有关,故本实验选择三氟乙酸的浓度为2.0 mol/L。

图2 三氟乙酸浓度对地参多糖水解的影响
2.2.2 水解温度对地参多糖水解的影响
由图3可知,随着水解温度的升高,地参多糖糖苷键水解成单糖的速率加快,温度在110 ℃后单糖含量基本稳定,表明地参多糖已经水解完全,故本方法确定水解温度为110 ℃。
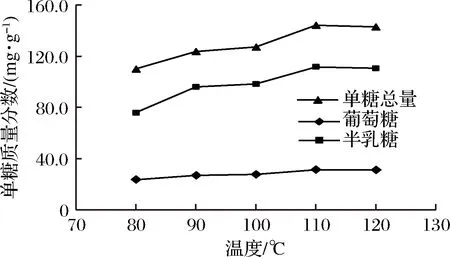
图3 水解温度对地参多糖水解的影响
2.2.3 水解时间对地参多糖水解的影响
由图4可知,随着水解时间的延长,地参多糖水解效率提高,在5 h内达到峰值随后趋于稳定,表明地参多糖已经水解完全,为了缩短分析时间、节约能源,本实验确定水解时间为5 h。
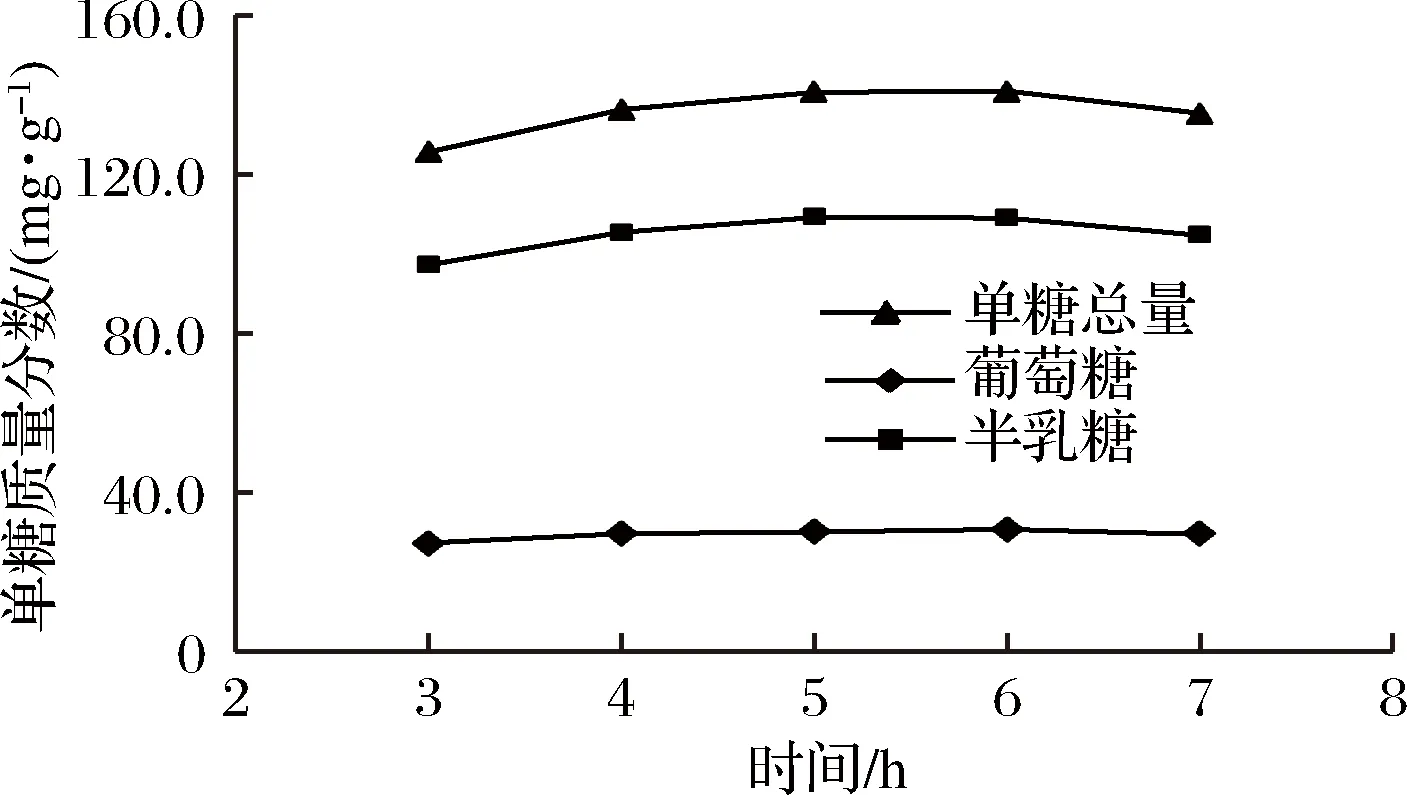
图4 水解时间对地参多糖水解的影响
2.2.4 最佳条件的确定
根据单因素实验结果,地参多糖完全水解最佳条件为:三氟乙酸浓度2.0 mol/L,水解温度110 ℃,水解时间5 h。
2.3 线性关系、检出限的考察
取1.3.1的8种单糖混合标准工作液按照1.3.2.3的步骤进行衍生,以1.3.3的色谱条件依次进样分析,记录色谱峰面积,以各单糖标准品的峰面积(y)与其相应的质量浓度(x)进行线性回归,绘制标准曲线,根据信噪比计算检出限(RS/N=3),结果如表2所示。8种单糖的相关系数均大于0.999 5,表明线性关系良好;8种单糖的检出限范围为0.16~0.85 μg/mL,表明仪器灵敏度高。
2.4 仪器精密度考察
取同一衍生后的标准品溶液按照1.3.3的色谱条件连续进样6次,记录各单糖色谱峰峰面积,并计算相对标准偏差(relative standard deviation, RSD)值。结果表明:甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖峰面积的RSD值分别为0.50%、0.38%、0.60%、0.56%、1.09%、1.20%、0.37%、0.38%,均小于1.50%,表明仪器精密度良好,可进行样品分析。

表2 八种单糖的标准曲线、线性范围、相关系数和检出限
2.5 衍生试样稳定性考察
取衍生后的样品溶液(S1),分别在0、2、4、8、12、16、24 h时间点按照1.3.3进样,计算各单糖色谱峰的RSD值。结果表明:甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖峰面积的RSD值分别为2.81%、1.55%、2.64%、1.90%、0.26%、0.71%、1.92%、2.75%,表明单糖经衍生后生成的物质在24 h内稳定性良好,对进样时间无特殊要求。
2.6 方法重复性考察
精密称取样品(S1)1.0 g,平行6份,按照1.3.2制备样品溶液,并按1.3.3的色谱条件进样测定,记录各单糖色谱峰峰面积,并计算RSD值。结果表明:甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖峰面积的RSD值分别为2.86%、2.15%、1.17%、2.10%、0.25%、0.68%、1.83%、3.07%,表明该方法的重复性良好,可用于其他地参样品中单糖的组成和含量测定。
2.7 加标回收试验考察
移取制备好的多糖样品溶液(S1)0.50 mL于顶空瓶中,分别加入高、中、低3个水平的混合标准储备液,按照1.3.2.2及1.3.2.3进行水解、衍生化操作,各加标水平平行测定6次,计算回收率及RSD值,见表3。

表3 八种单糖的回收率测定结果(n=6)
结果表明8种单糖高、中、低3个水平的平均回收率为82.58%~108.71%,RSD值为0.03%~1.44%,表明该方法的准确性好,精密度高。
2.8 地参多糖的单糖组成及含量
取6个不同产地地参样品按照1.3.2进行制备样品溶液,注入高效液相色谱仪测定其多糖中单糖组成及含量,并计算各单糖组分间物质的量比,结果见表4、表5。地参样品中均含有甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖8种单糖,但含量上存在一定的差异,甘露糖的含量为0.099~0.230 mg/g,鼠李糖的含量为0.048~0.114 mg/g,葡萄糖醛酸含量为0.052~0.093 mg/g,半乳糖醛酸含量为0.150~1.429 mg/g,葡萄糖含量为26.063~47.666 mg/g,半乳糖含量为98.693~145.308 mg/g,阿拉伯糖含量为0.454~0.566 mg/g,岩藻糖含量为0.099~0.176 mg/g。同时,从表4可以看出地参中半乳糖、葡萄糖的含量较高,为地参单糖的主要成分。由表5可知,8种单糖组分的平均物质的量比为:甘露糖∶鼠李糖∶葡萄糖醛酸∶半乳糖醛酸∶葡萄糖∶半乳糖∶阿拉伯糖∶岩藻糖=1.00∶0.60∶0.54∶5.15∶266.53∶890.11∶4.12∶1.05。
表4 地参多糖的单糖组成及含量 单位:mg/g

表5 地参多糖中单糖的物质的量比(n=3)
2.9 主成分分析
采用SPSS 22.0软件对6个样品的单糖含量进行主成分分析,并对其进行主成分得分计算以及排序,结果见表6、表7。

表6 样品主成份距阵
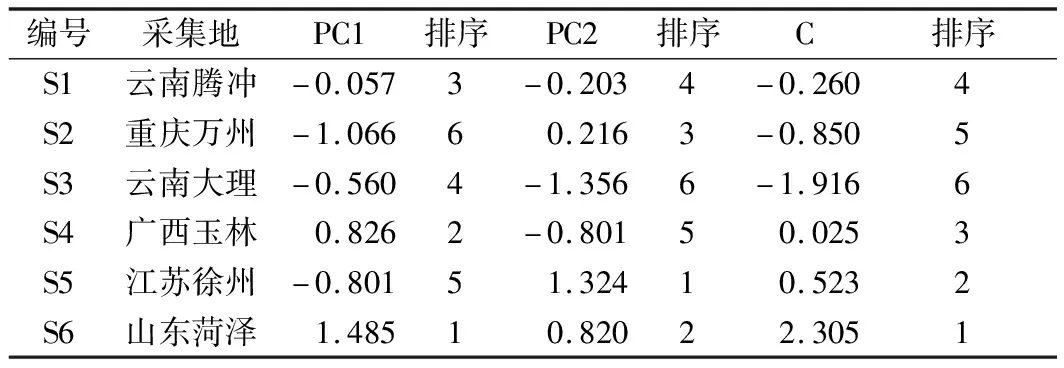
表7 样品主成分得分、综合得分及其排序
注:PC1,PC2为主成分得分;C为综合得分
从多糖的8个单糖组分中提取出了2个主成分(特征值>1),主成分1的特征值为5.334,特征贡献率为66.67%;主成分2的特征值为1.180,特征贡献率为14.75%,2个主成分的累积贡献率为81.42%。主成分1中岩藻糖、阿拉伯糖、半乳糖醛酸、半乳糖、葡萄糖和鼠李糖为主要影响因子;主成分2中甘露糖、葡萄糖醛酸为主要影响因子。
根据得分排序来看:相对于主成分1,采自山东菏泽的地参得分最高;相对于对主成分2,采自江苏徐州的地参得分最高;说明采自山东菏泽、江苏徐州单糖成分含量较高。综合得分排序由高到低依次为:山东菏泽、江苏徐州、广西玉林、云南腾冲、重庆万州、云南大理。说明地参单糖含量的高低在我国地域上呈现出北方>南方>西南的趋势,这可能与日照时间、昼夜温差等因素影响了糖分的积累有关[23-24]。
3 结论
不同产地地参多糖均具有相似的单糖组成,即甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖和岩藻糖等,其中半乳糖、葡萄糖为主要成分,但各单糖含量及组成比例有明显差异。因此,基于地参多糖的特征单糖组分分析研究,有助于完善地参的质量控制与开发利用。
本研究建立了水提醇沉法、PMP柱前衍生HPLC法测定地参多糖中8种单糖组成和含量,该方法的灵敏度高、分离效果好,线性范围宽、检出限低,精密度、重复性、稳定性和回收率良好,操作简便,结果稳定可靠,可用于地参样品中多糖的单糖组成分析及定量测定,也可为其他药食同源植物多糖组成研究提供参考。

