气肿疽梭菌CctA全长基因的克隆及生物信息学分析
陈晓洁,李新苹,何高明>,王 钢,凌 晨,张 飞
(1.石河子大学 动物科技学院,新疆 石河子 832000;2.天康生物股份有限公司,新疆 乌鲁木齐 830000)
气肿疽也称为黑腿病,其病原菌是气肿疽梭菌,该病被列为第三类传染病,是一种严重的人畜共患细菌传染疾病,可引起发热、严重的肌坏死、水肿,最终导致受感染动物死亡,对全球范围的畜牧业生产造成了重大损失。气肿疽梭菌是一种严格的厌氧、孢子形成、具有组织毒性、单形性和运动性的革兰氏阳性致病菌,其生存能力强,在世界范围内广泛传播[1]。美国和日本报道人感染气肿疽梭菌死亡的案例,从而打破了气肿疽梭菌只感染动物的言论,也将该病视为重要研究对象[2]。
黑腿病是影响反刍动物最古老的临床疾病之一,但其发病的确切机制仍不清楚,关于气肿疽梭菌产生的毒素和毒力因子的作用也存在知识缺口[3,4]。CctA是 Joachim Frey等经过全基因序列分析得出的一种新型蛋白质毒素,属于细菌毒素杀白细胞素超家族β-微孔形成毒素[5]。其具有很强的致病性,是气肿疽梭菌的主要细胞毒素和溶血素[5]。有研究表明,将重组CctA接种动物后,可针对气肿疽梭菌的感染产生保护作用,因此,在预防黑腿病疫苗的研究中是非常有价值的候选抗原[6]。本研究扩增出气肿疽梭菌的细胞毒素CctA基因序列,并通过氨基酸序列分析该基因编码蛋白质的理化性质和功能域,预测该蛋白的二级结构、三级结构,旨在为研究气肿疽梭菌CctA基因功能提供一定参考。
1 材料与方法
1.1 材料
气肿疽梭菌C54-2标准菌株购自中国药品监察所。Ex Taq酶、DL5000 DNA Maker购自TaKaRa宝生物有限公司。
1.2 方法
1.2.1 引物的设计与合成 根据GenBank中公布的CctA基因序列(登录号:JQ692583),采用primer Premier 5.0软件设计编码序列的特异性引物。引物序列为:上游引物CctA-F:5'-CGAG CTCATGATAAAAAGAATATTAATGCTTGCTTTA GC-3';下游引物CctA-R:CCGCTCGAGTTAATA TCCTGCATGCTCAACAGTATGG-3'。由生工生物工程(上海)股份有限公司合成。
1.2.2 CctA基因的扩增 以气肿疽梭菌C54-2标准菌株的基因组为模板,PCR扩增CctA基因片段。反应体系50 ul:Taq酶25 ul,引物CctA-F和CctA-R各1 ul,DNA模板2 ul,ddH2O 21 ul。PCR反应条件为:95℃预变性,5 min;95℃变性,45 s;58℃退火,45 s;72℃延伸,45s;72℃终延伸,10 min,共30个循环。反应结束,用1%琼脂糖凝胶电泳验证。
1.2.3 CctA编码蛋白的相关生物信息学分析 对CctA编码蛋白的理化性质预测应用ExPASY在线分析软件ProtParam完成,具体内容包括氨基酸组成、分子量、等电点、不稳定指数、脂溶指数等。此外,利用ProtScale工具还进一步对该蛋白的亲水/疏水性作在线预测,以确定该蛋白在生理条件下是属于亲水性蛋白还是疏水性蛋白。在线软件TMHMM对CctA编码蛋白的跨膜结构域进行预测和分析。SignaIP 4.1 Server在线预测CctA编码蛋白氨基酸序列信号肽。利用在线软件NetNGlyc 、NetOGlyc 4.0 Server预测CctA编码蛋白的糖基化位点,NetPhos 3.1 Server预测CctA编码蛋白的磷酸化位点。通过SOPMA、SWISSMODEL软件分别对其二级、三级结构进行预测。利用在线软件 ABCpred对CctA编码蛋白潜在的B细胞抗原表位进行预测。
2 结果与分析
2.1 气肿疽梭菌CctA基因扩增结果
琼脂糖凝胶电泳结果显示,在970 bp处出现特异条带(见图1),与预期片段大小相符,说明通过PCR扩增得到CctA基因片段。
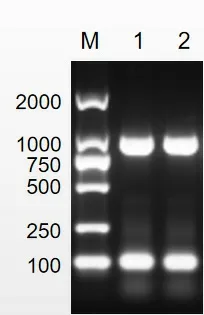
图1 CctA全长基因PCR扩增
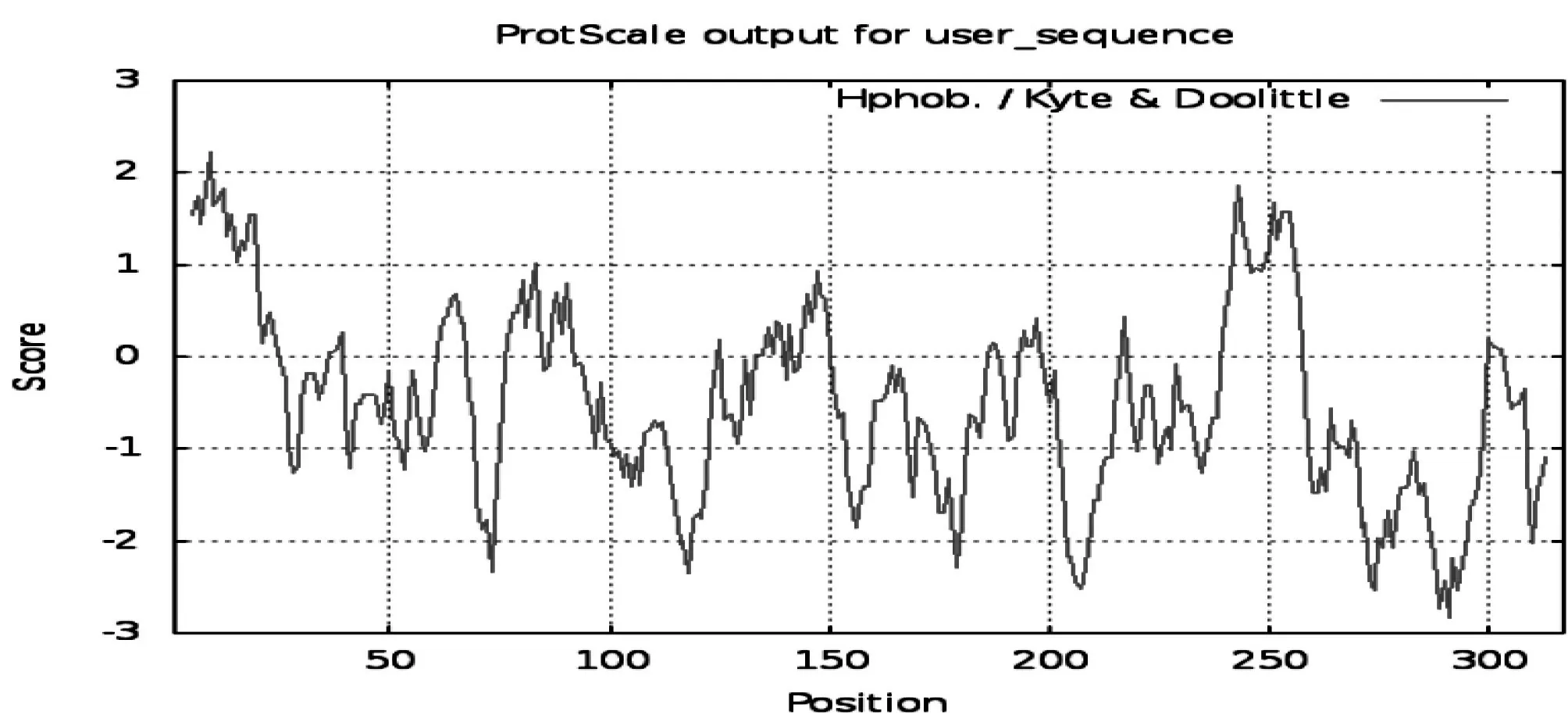
图2 CctA编码蛋白疏水性分析
2.2 CctA编码蛋白的结构和功能预测
2.2.1 CctA编码蛋白的理化性质分析 应用ExPASY在线分析软件ProtParam对CctA编码蛋白的理化性质分析后,该蛋白分子量约为35.57KD,其分子式为C1577H2411N421O503S8,由317个氨基酸组成;CctA蛋白中带正电荷的氨基酸残基(Asp+Glu)总数为31,带负电荷的氨基酸残基(Arg+Lys)总数为29;等电点(PI)理论值为6.13;在哺乳动物体外培养细胞中的半衰期约为30 h,在大肠杆菌体内大于10 h;脂溶指数为69.50;不稳定指数为28.28(<40为稳定蛋白),属于稳定蛋白。
2.2.2 CctA蛋白氨基酸序列的亲疏水性分析 使用ProtScale分析CctA蛋白的亲疏水性氨基酸残基分布(见图2),在第9位氨基酸处有最大疏水值为2.222,在第291位氨基酸处有最小疏水值为-2.833,其平均疏水值为-0.496,预测该蛋白为亲水性蛋白。

图3 CctA编码蛋白信号肽预测
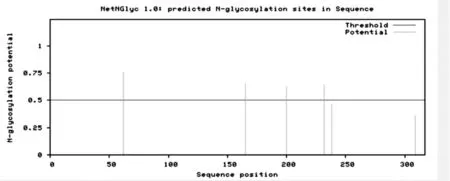
图4 CctA蛋白N-糖基化位点预测
2.2.3 CctA蛋白的结构预测 利用TMHMM对CctA编码蛋白的跨膜结构域进行预测和分析,显示CctA蛋白不具有跨膜结构。表明为该蛋白全部1-317位氨基酸序列均属于膜外侧,不存在跨膜螺旋区。SignaIP 4.1 Server在线预测CctA编码蛋白氨基酸序列,分析表明CctA蛋白于第1~29位氨基酸存在信号肽序列(见图3)。应用interpro在线软件预测CctA蛋白的保守域和功能结构,分析表明CctA蛋白于34~313位有1个杀白细胞素成孔超家族蛋白,且含有杀白细胞素结构域位于第62~309位。经UniProt的Blast比对分析显示,CctA与肉毒杆菌α溶血素有相似性;与蜡样芽胞杆菌溶血素Ⅱ相似性为35.9%;与金黄色葡萄球菌α溶血素相似性为30.9%。
2.2.4 蛋白质糖基化位点及磷酸化位点的预测 通过NetNGlyc 1.0 Server和NetOGlyc 4.0 Server软件对氨基酸序列进行N-糖基化位点及O-糖基化位点预测,得分高于0.50分时才会被预测为糖基化位点,经预测显示该蛋白有4个N-糖基化位点(见图4),1个O-糖基化位点。通过NetPhos 3.1 Server 软件对CctA蛋白进行磷酸化位点预测,经分析发现该蛋白多数在丝氨酸处最可能通过相应位点的磷酸化来实现其功能的调控,丝氨酸位点的最大值多数在0.99以上,且多数属于丝氨酸>苏氨酸>酪氨酸,其中含有丝氨酸磷酸化位点39个;苏氨酸磷酸化位点18个,酪氨酸磷酸化位点15个,由此表明,CctA蛋白在丝氨酸和苏氨酸处的磷酸化位点较多,这一结果也说明了该蛋白在丝氨酸与酪氨酸处更易发生磷酸化(见图5)。

图5 CctA蛋白磷酸化位点预测

图6 CctA编码蛋白的二级结构预测
2.2.5 CctA蛋白的二级、三级结构预测 通过SOPMA软件对CctA编码蛋白氨基酸序列进行二级结构的预测,显示该蛋白有31个α-螺旋,占所有氨基酸比例的9.78%;20个β-转角,占所有氨基酸比例的6.31%;97个延伸链,占所有氨基酸比例的30.60%;169个无规卷曲,占所有氨基酸比例的53.31%(见图6)。应用SWISS-MODEL预测得到CctA编码蛋白的三维结构模型(见图7),该模型与模板序列4i0n.1.A的相似度为50.18%

图7 CctA编码蛋白的三级结构预测
2.2.6 CctA编码蛋白质潜在抗原表位的预测 利用在线软件 ABCpred对CctA编码蛋白潜在的B细胞抗原表位进行预测,结果显示该蛋白有22个优势的B细胞抗原表位,分别是33~47位、105~120位、212~227位等。利用在线软件NetMHCIIpan 3.1 Server对CctA编码蛋白的抗原表位进行预测,限制性 Th 细胞表位为DRB1-0101,得到3个强结合多肽段和33个弱结合多肽段。
3 讨论
气肿疽梭菌主要影响牛,其引起暴发性肌坏死,迅速导致动物死亡。由于黑腿病具有高致死率,因此在全球范围内造成畜牧业生产的重大损失[1,4,7,8]。据推测,该菌孢子是由巨噬细胞从肠道或口腔损伤处运送到肌肉的,一旦进入这些组织,孢子就处于休眠状态,直到形成厌氧环境,就会导致孢子的增殖和外毒素的释放[9]。Jayaramaiah等[10]鉴定了气肿疽梭菌的一些细胞表面相关蛋白,如烯醇化酶、黄素蛋白等,但这些表面相关蛋白在预防黑腿病中的作用还需进一步研究。有研究表明,DNAse、透明质酸酶和唾液酸酶、鞭毛蛋白以及气肿疽梭菌毒素A(CctA)均为气肿疽梭菌的重要毒力因子[11-14]。其中最典型的CctA是气肿疽梭菌的主要细胞毒性和溶血性[5],表明除CctA外,无其他可产生溶血活性的物质。CctA在全球50多年间采集的气肿疽梭菌菌株之间完全保守[1],它们都编码相同的CctA的氨基酸序列,进而证明了从易与气肿疽梭菌混淆的败血症梭菌、产气荚膜梭菌、诺维梭菌、肉毒梭菌、艰难梭菌等相关菌株中不能扩增出CctA基因。
CctA蛋白结构域分析显示,该蛋白无跨膜区,有信号肽存在,于34~313位有1个杀白细胞素成孔超家族蛋白,且含有杀白细胞素结构域位于第62~309位。这与Frey等[5]报道的CctA属于杀白细胞素超家族β-桶状造孔毒素家族相一致。分析显示,CctA与肉毒杆菌α溶血素有相似性;与蜡样芽胞杆菌溶血素Ⅱ相似性为35.9%;与金黄色葡萄球菌α溶血素相似性为30.9%,也佐证了CctA与肉毒杆菌α溶血素有相似性[15];与蜡样芽胞杆菌溶血素II[16]有48%氨基酸相似;与金黄色葡萄球菌α毒素有50%氨基酸相似的报道。经分析表明,该蛋白有4个N-糖基化位点,1个O-糖基化位点,该蛋白有1个糖基化位点,周小菊等[17]表明,糖基化修饰差异,可能会影响相关蛋白的表达水平、结构及功能,对重组蛋白生物学活性及免疫原性均有重要影响。为CctA重组蛋白的研究提供一定参考。预测该蛋白有多个磷酸化位点,而蛋白质的修饰往往也影响这蛋白的稳定性,研究表明,一些蛋白底物的丝氨酸或苏氨酸位点磷酸化后与E3泛素连接酶的结合力增强,其稳定性会明显减弱[18]。CctA蛋白二级结构分析显示含有大量无规卷曲,是构成酶活性部位和其他蛋白质特异的功能部位[19]。由此可推测该蛋白可能含有较多抗原表位,这一结论也在抗原表位预测中得到证实。蛋白质的结构及功能预测为找到其致病的分子机理提供一定依据,对气肿疽的免疫及防治工作具有重要意义。

