棕榈酸对绵羊前体脂肪细胞增殖的影响
卢美琳 ,石嘉琛,王家敏,乔自林
(1.西北民族大学生物医学研究中心 甘肃省动物细胞技术创新中心,甘肃 兰州 730030;2.西北民族大学生物医学研究中心 生物工程与技术国家民委重点实验室,甘肃 兰州 730030;3.西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
随着肥胖和肥胖相关疾病的普遍,脂肪细胞增殖和分化机制引起人们的重视,脂肪前体细胞在经历细胞形态学和一系列相关基因表达变化后分化为成熟脂肪细胞,三酰基甘油的合成增加,脂质积累[1]。PA是一种16碳长链饱和脂肪酸,分子式为C16H32O2,在肥胖患者中血液浓度会升高[2]。其是棕榈油中饱和脂肪酸的主要成分[3],在细胞中,该脂肪酸被转化为磷脂,二酰基甘油和神经酰胺。Ahmed B S[4]等研究表明100 uM对牛卫星细胞增殖是促进作用,而200 uM是抑制其增殖;因此,在体外培养绵羊前体脂肪细胞时添加不同浓度PA,检测其对绵羊前体脂肪细胞增殖的影响,为研究能量对肥胖机制提供基础理论。
1 材料
1.1 主要材料试剂
小尾寒羊前体脂肪细胞,从健康的雌性1日龄小尾寒羊尾部脂肪组织采集经培养后液氮中保存,保存的细胞代次为P3代。
DMEM/F12培养基和0.25%胰蛋白酶(兰州百灵生物,批号:20190409和20140425);胎牛血清(FBS)(兰州民海生物,批号:20141002);青霉素、链霉素、棕榈酸(纯度 >98%)均购自大连美仑生物技术有限公司。
1.2 主要仪器
CO2培养箱(型号为3111)、酶标仪(型号为MK3),均购自赛默飞世尔科技(中国)有限公司;细胞计数仪(型号为IC1000),购自Countstar公司;倒置生物显微镜(型号为CKX-41),购自Olympus公司。
2 方法
2.1 复苏前体脂肪细胞
从液氮罐中取出冻存的小尾寒羊前体脂肪细胞,按照常规方法复苏细胞,显微镜下观察待细胞基本贴壁后,换新鲜完全培养基,降低DMSO对细胞的损伤,细胞汇合致密单层后续试验。
2.2 PA对前体脂肪细胞增殖的影响
待前体脂肪细胞汇合致密单层后,用0.25%胰蛋白酶消化细胞,显微镜下观察,待细胞变成透亮的圆形时,加入10 ml完全培养基终止消化,吹打制细胞悬液,取样计数。以1×104个/ml的密度接种于96孔细胞培养板,放置37℃,5% CO2饱和湿度培养箱中培养,24 h后弃掉原培养液,在培养液中分别添加浓度为100、150、200、250、300和350 µmol/L的PA,空白对照组只添加等量的完全培养基,而阴性对照组添加终浓度为 0.01%无水乙醇,培养1、3、5、7和9 d后,用MTT法[5]检测各孔的吸光度值。
2.3 数据统计分析
采用Graphpad prism 8软件进行统计分析。
3 结果
3.1 复苏培养
前体脂肪细胞复苏活率为93%,4 h后贴壁(图1A),待细胞基本贴壁后,换新的完全培养基,细胞成长梭型,细胞增殖加快,72 h后细胞汇合成单层致密(图1B)。
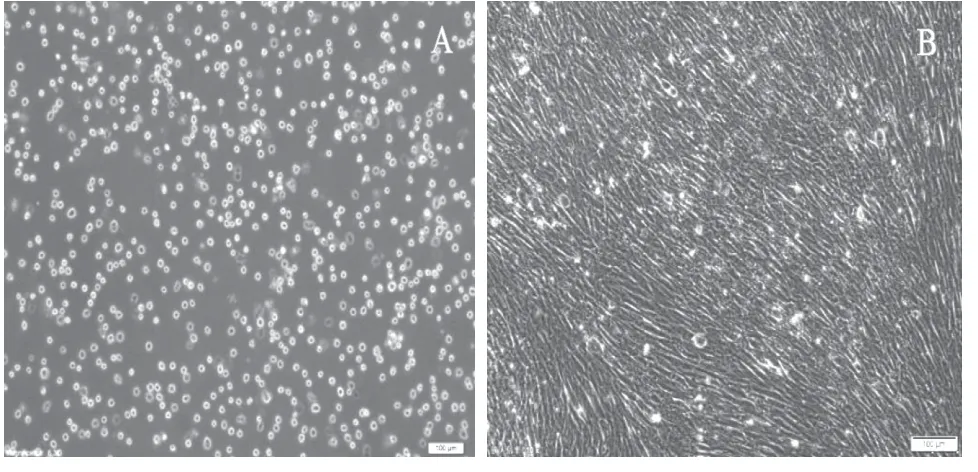
图1 小尾寒羊前体脂肪细胞形态

图2 PA对小尾寒羊前体脂肪细胞增殖的影响
3.2 PA对前体脂肪细胞增殖的影响
由图2可知,PA作用于前体脂肪细胞1 d后,浓度为150 µmol/L可促进细胞增殖,且与对照组相比差异极显著。作用时间延长至3~9 d后,浓度为100 µmol/L和150 µmol/L均可促进细胞增殖;浓度在200~350 µmol/L均抑制细胞增殖,且各组之间抑制作用差异极显著。
4 讨论
PA的生物学特性和药理学活性较广泛,有研究表明PA与代谢综合征、心血管疾病、神经退行性疾病、炎症等具有相关性[6-7];周瑶瑶[8]等研究表明随着PA浓度的升高抑制Hela细胞增殖更明显;周光[8]等研究表明0.2 mmol/L PA作用于肝细胞24 h细胞活力降低约50%。该试验用100、150、200、250、300和350 µmol/L的PA培养绵羊前体脂肪细胞,结果作用1 d后,浓度为150 µmol/L促进细胞增殖;作用时间延长至3~9 d时,100 µmol/L和150 µmol/L均可促进细胞增殖,200~350 µmol/L反而抑制细胞增殖。

