姜黄素和万古霉素对大鼠肾小管上皮细胞乳酸脱氢酶释放百分率及丙二醛的影响
罗洁,徐芬,丁岚
(江西医学高等专科学校检验教研室,江西 上饶33400)
万古霉素自上市以来,已成为耐甲氧西林金黄色葡萄球菌(MRSA)的首选治疗药物[1],但与此同时,中毒性肾损伤的副作用也日益成为临床医师在使用万古霉素时有所顾虑的重要原因,从而限制其临床应用[2]。近年来的研究表明,氧化应激机制为万古霉素所致肾毒性的主要机制[3]。姜黄素(Curcumin)是提取自姜黄、郁金、莪术等植物块茎中的一种天然活性成分,具有抗氧化、抗炎、抗肿瘤、抗纤维化等多种药理作用,其中抗氧化作用的主要机制被认为与清除自由基、增强抗氧化酶活性有关,因此被当作一种天然的抗氧剂[4]。目前尚无有关研究针对姜黄素是否对万古霉素所致肾损伤具有保护作用进行探讨。笔者就此进行了初步的研究,并对可能机制进行探讨,现报告如下。
1 材料和方法
1.1 工作液配制 参考相关文献报道[5],本研究所涉及万古霉素和姜黄素工作液浓度分别设定为30 μg/ml和25μmol/L。其中万古霉素工作液的配制:将万古霉素(美国Sigma公司)粉末用10ml 0.9%的生理盐水溶解,配制成浓度为6 mg/ml的万古霉素母液,再取1ml的万古霉素母液,加入149ml的0.9%生理盐水稀释200倍配制成浓度为30 μg/ml的万古霉素工作液。姜黄素工作液的配制:将姜黄素粉末(美国Sigma公司)25 mg溶于0.5 ml的二甲基亚砜(DMSO)中,待其完全溶解后加入无水乙醇至5 ml,配制成浓度为5 mg/ml的储存液,再取276.30 μl的姜黄素母液,用灭菌三蒸水稀释成150 ml的25 μmol/L姜黄素工作液。
1.2 细胞培养与分组 将健康的雄性SD大鼠(180~240g)麻醉后处死并于无菌操作下取其肾组织,去除包膜,分离并剪碎其肾皮质,过筛网得肾小管节段,0.25%胰蛋白酶消化,离心获得单个肾小管上皮细胞,在37℃、5%CO2的细胞培养箱中用含10%胎牛血清的DMEM培养基进行常规培养2~3 d,之后再用0.25%胰蛋白酶消化传代,倒置相差显微镜下观察并证实处于对数生长期的肾小管上皮细胞,见图1所示,将其按照4×105个/ml接种3 ml于培养瓶内,当达到80%的融合后弃培养基,经磷酸盐缓冲液洗2次,再用无血清DMEM培养基同步静止24 h后分别给予空白对照、姜黄素+万古霉素、姜黄素和万古霉素4种含不同药物的工作液组,设定为空白对照组、姜黄素+万古霉素试验组、姜黄素试验组和万古霉素试验组,各组均含3瓶细胞。
1.3 乳酸脱氢酶(Lactate dehydrogenase,LDH)释放百分率测定 实验4h后的各组细胞培养上清液转移到另一96孔板,每孔加入20 μl的细胞裂解液,经37℃裂解45min后再各孔均加入180 μl的磷酸盐缓冲液,充分混匀。将上清液与裂解液均3500 r/min 离心 10min, 每孔均取 50 μl样品与 50 μl的LDH底物混合,室温避光孵育30 min后加入终止反应液50 μl,经紫外可见分光光度计测定其490 nm处的吸光度(OD)值。LDH释放百分率(%)=上清液LDH释放量/(上清液LDH释放量+裂解液LDH 释放量)×100%[6]。
1.4 丙二醛(Malonaldehyde,MDA)含量测定 针对各组再设立不同的培养时间 (0 h、6 h、12 h、24 h、30 h、36 h、48 h) 对细胞培养上清液的 MDA 含量进行考察,严格按照MDA检测试剂盒的说明书(南京建成科技有限公司)测定MDA含量。
1.5 统计学方法 采用SPSS 20.0统计学软件进行分析,计量资料以均数±标准差(x±s)表示,组间计量资料比较采用t检验,P<0.05为差异有统计学意义。

图1 培养3d见大量肾小管上皮细胞生长
2 结果
2.1 LDH释放百分率变化 细胞培养基中,LDH释放百分率为万古霉素试验组>姜黄素+万古霉素试验组>姜黄素试验组,差异均有统计学意义(P<0.05),与空白对照组相比,万古霉素试验组和姜黄素+万古霉素试验组的LDH释放百分率均有增加(ΔLDH释放百分率=试验组LDH释放百分率+空白对照组LDH释放百分率>0),且万古霉素试验组ΔLDH释放百分率大于姜黄素+万古霉素试验组ΔLDH释放百分率,见表1。
2.2 MDA含量变化 细胞培养上清液MDA含量在姜黄素+万古霉素试验组和万古霉素试验组中的含量均随着时间延长而增高,而姜黄素试验组和空白对照组中的MDA含量与0h相比无显著变化(P>0.05),从24 h开始,在相同时间里,万古霉素试验组中的MDA含量增高与姜黄素+万古霉素试验组相比更显著,差异均有统计学意义(P<0.05)。见表2。
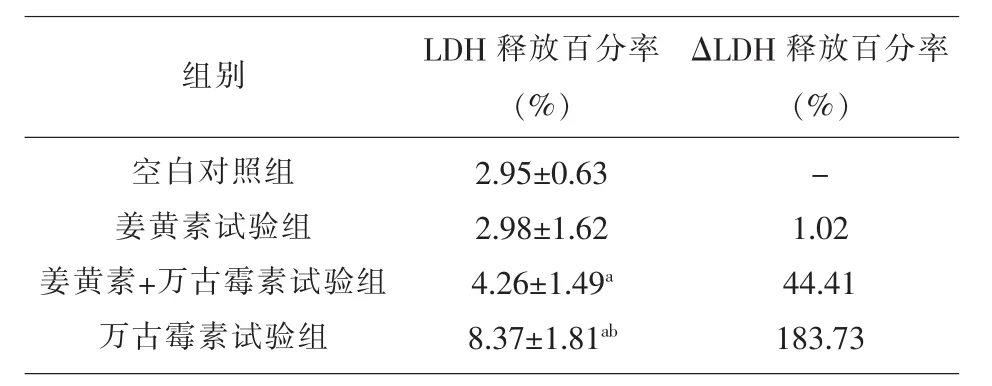
表1 细胞培养基中各组大鼠肾小管上皮细胞的LDH释放百分率及其变化(x±s,n=3)

表2 各组细胞培养上清液中MDA含量(μmol/L)变化比较(x±s,n=3)
3 讨论
本研究采用肾小管上皮细胞对外源性物质的肾脏毒性作用进行研究,通常可通过测定肾小管上皮细胞胞内酶LDH的释放量并与空白对照组比较来反应肾小管内皮细胞损伤程度,其在细胞膜受损时可释放到细胞外,当ΔLDH释放百分率(试验组LDH释放百分率-空白对照组LDH释放百分率)≤20%,表明存在细胞轻度损伤,当ΔLDH释放百分率为20~50%时则为细胞中度损伤,而当ΔLDH释放百分率≥50%时,则表明存在细胞重度损伤[7]。本研究结果表明,万古霉素对大鼠肾小管上皮细胞可能具有肾毒性,而姜黄素对万古霉素所致肾损伤具有改善作用,由表1可知,25 μmol/L的姜黄素可减少约 49.10%(即(8.37~4.26/8.37)×100%)的万古霉素所致肾小管内皮细胞损伤程度。
有关万古霉素所致肾毒性的具体机制目前尚不十分明确,动物研究表明,万古霉素的肾毒性可能与其损害肾小球从而导致近端肾小管发生缺血坏死有关,其机制主要是万古霉素导致近曲小管上皮细胞活性氧自由基的大量产生并随后发生氧化应激反应所致[8,9],另外有研究表明[10],万古霉素可导致近曲小管上皮细胞的氧耗量增加和线粒体功能改变以及肾组织中抗氧化酶(如过氧化氢酶、超氧化物歧化酶等)基因表达下降。MDA作为细胞脂质过氧化反应的终产物,其含量多少可反映脂质过氧化的程度[11],本研究进一步通过测定细胞MDA含量变化,对姜黄素改善万古霉素所致肾损伤的可能机制进行探讨,结果表明,随着万古霉素作用时间延长,大鼠肾小管上皮细胞的脂质过氧化程度越严重,而姜黄素可能具有抗氧化作用,其对该脂质过氧化程度具有缓解作用,其机制可能与姜黄素能够抑制脂过氧化反应,维持过氧化氢酶、超氧化物歧化酶等抗氧化酶的活性有关[12]。
综上可知,本结果表明姜黄素对万古霉素所致细胞肾损伤可能具有改善作用,并从氧化应激反应角度对其可能机制进行了探讨。但本研究尚存在一定局限性,首先,有研究表明,姜黄素虽可保护生物膜免受氧化应激损伤,但高剂量的姜黄素有时却表现为促氧化作用,使其效应能从抗氧化促氧化之间相互转换[13,14],因此本研究尚未进一步对不同剂量特别是高剂量姜黄素作用下,万古霉素致肾小管上皮细胞的肾损伤程度变化进行探讨。此外,本研究尚未对调控氧化应激上游的具体分子机制进行探讨,袁嫣等[15]的研究表明,急性铀染毒诱导了大鼠肾组织的氧化应激损伤并致急性肾毒性,而Nrf2通路损伤可能参与介导铀诱导的大鼠急性肾毒性,因此,Nrf2通路损伤可能与万古霉素所致肾毒性有关。而王道周等[16]的研究表明,姜黄素可能通过激活Nrf2/ARE信号通路,降低糖尿病肾病大鼠氧化应激、发挥肾脏保护作用。因此,关于Nrf2信号通路对氧化应激应答能力降低是否与万古霉素所致肾毒性具有相关性,且姜黄素对万古霉素所致肾损伤的保护作用是否与其参与Nrf2/ARE信号通路的激活作用有关,尚需进一步的研究证实。

