F型肉毒毒素单克隆抗体的制备与鉴定
许永亮,王佳星,李响,孙志杰,于海威,刘栋琦,张惟材,熊向华
1.辽宁大学 生命科学学院,辽宁 沈阳 1100361;2.军事医学研究院 生物工程研究所,北京 100071;3.沈阳师范大学 生命科学学院,辽宁 沈阳 110034;4.哈尔滨商业大学,黑龙江 哈尔滨 150076
肉毒毒素(botulinum neurotoxin,BoNT)是由肉毒梭菌芽孢杆菌(Clostridium botulinum)产生的,是目前已知毒性最强的细菌毒素[1]。BoNT 分为 A~G 共 7 个血清型[2],其中已知能够引起人类中毒的有 A、B、E 和 F 型[3]。各型毒素均由一条重链和一条轻链通过二硫键连接而成[4]。重链C 端能与特定受体结合[5],同时也是理想的保护性抗原;重链N 端主要在毒素内化过程中起作用[6]。轻链是肉毒毒素的毒性部分,是依赖Zn2+的肽链内切酶,在重链的辅助下进入细胞并特异性地裂解突触相关膜蛋白,阻断神经递质乙酰胆碱的释放,从而造成肌肉松弛型麻痹[7]。
目前尚无有效的小分子化学药物能治疗BoNT 中毒[8],临床上使用的马源血清可能存在病毒污染、过敏反应、生产周期长、生产成本高等限制因素。单克隆抗体作为一种治疗性的蛋白质分子,已广泛用于治疗一系列危及生命的疾病[9],目前已经有40 多种单克隆抗体药物被美国、日本和欧盟批准使用[10],当前治疗肉毒毒素的惟一有效手段就是中和抗体[11]。另外,在不同血清型BoNT 的防治工作中,最广泛使用的福尔马林灭活的五价疫苗只能针对A~E 型,不能针对F 型[12]。本研究以 F 型 BoNT(BoNT/F)重链 C 端(BoNT/FHc)为抗原免疫小鼠,通过杂交瘤技术筛选抗BoNT/F 抗体,成功筛选到一株高亲和力的鼠源单克隆抗体。
1 材料与方法
1.1 材料
雌性SPF 级BALB/c 小鼠(北京维通利华公司);Sp2/0 细胞(本实验室保存);大肠杆菌感受态细胞DH5α(北京擎科生物技术有限公司);HRP 标记的羊抗鼠IgG 二抗、DNA 胶回收试剂盒(Thermo 公司);抗体亚型鉴定试剂盒(北京博奥龙免疫技术公司);HiFi DNA 聚合酶(全式金生物技术有限公司);ΜLtrapure RNA Kit 超纯RNA提取试剂盒、HiFiScript gDNA Removal cDNA Synthesis Kit(北京康为世纪生物科技有限公司);弗氏完全佐剂、弗氏不完全佐剂、聚乙二醇PEG1500、TMB 显 色 液(Sigma 公 司);DMEM、HAT、HT 培养基(Gibco 公司);Hitrp Protein G HP色谱柱(GE 公司)。
1.2 小鼠免疫
取5 只BALB/c 小鼠,首次免疫时将弗氏完全佐剂与50 μg BoNT/FHc 等量混合,充分乳化后小鼠背部皮下多点注射;第21 d 进行第2 次免疫,将弗氏不完全佐剂与50 μg BoNT/FHc 等量混合并充分乳化,小鼠背部皮下多点注射;第42 d 进行第 3 次免疫,用 50 μg 抗原与 PBS 等量混合,每只小鼠腹腔注射[13];第56 d 进行小鼠尾静脉取血,4℃静置1 h,4℃、3000 r/min 离心10 min后取血清,间接ELISA 测定其效价;取尾血效价最高的小鼠腹腔注射抗原200 μg 强化免疫,并于3 d 后进行细胞融合。
1.3 细胞融合
小鼠强化免疫3 d 后断颈处死,75%乙醇消毒,无菌环境下摘取其脾脏并置于筛网内,用注射器内芯轻轻碾碎后收集脾脏细胞并活细胞计数;取生长状态良好的Sp2/0 细胞与脾脏细胞按1∶5~1∶10 的比例混合于 50 mL 离心管内,1000 r/min 离心8 min,弃上清,轻弹离心管底部使细胞松散;置37℃水浴中,在1 min 内缓慢加入1 mL PEG1500,边加边轻轻摇动离心管,静置90 s 后在第1 min 内缓慢加入1 mL DMEM,第2 min 内缓慢加入2 mL DMEM,以此类推共补加30 mL DMEM,800 r/min 离 心 6 min 后 弃 上 清 ;用 40 mL HAT 培养基将细胞重悬,加入铺有饲养细胞的96 孔细胞板内,每孔100 μL,转移至37℃、5%的CO2培养箱中培养。
1.4 阳性细胞筛选及克隆化
待细胞培养生长至细胞96 孔板底面积的1/3~1/2 时,显微镜下观察并计算细胞融合率,间接ELISA 测定融合细胞阳性率。阳性细胞经传代和扩大培养后,利用有限稀释法对其进行克隆化。
1.5 抗体制备
选取 8~10 周龄雌性 BALB/c 小鼠,每只小鼠腹腔注射0.5 mL 弗氏不完全佐剂;7 d 后腹腔接种能稳定分泌抗体的杂交瘤细胞0.5×106~1×106/只,同时注射同样数量的小鼠骨髓瘤细胞Sp2/0作为阴性对照;10 d 后收集腹水,SDS-PAGE 鉴定腹水中抗体的表达。
1.6 抗体纯化
将收集的腹水8000 r/min 离心10 min,小心去除油脂和血细胞沉淀,将腹水与Protein G 株结合缓冲液等比例混合,用Protein G 柱进行亲和层析纯化,SDS-PAGE 后采用Gel-pro32 软件分析纯化抗体的纯度,Lowrry 蛋白浓度测定试剂盒测定纯化抗体蛋白浓度。
1.7 抗体亲和力测定
采用非竞争ELISA 测定抗体的亲和力常数。测 定 4 个 浓 度 的 抗 原 BoNT/FHc(5、2.5、1.25、0.625 μg/mL)与梯度稀释为12 个浓度的抗体(500、250、125、62.5、……、0.244 μg/mL)的结合反应曲线,按文献报道的公式计算抗体亲和力[14]。
1.8 抗体亚型鉴定
采用抗体亚型鉴定试剂盒,以BoNT/FHc 为抗原包板,杂交瘤细胞培养上清为一抗,分别以HRP 标记的抗 IgG1、IgG2a、IgG2b、IgG3、IgM 以及κ、λ链抗体为二抗,利用间接ELISA 测定抗体轻重链亚型。
1.9 抗体可变区基因调取与氨基酸序列分析
采用RNA 提取试剂盒提取杂交瘤的RNA,采用逆转录试剂盒获得cDNA,利用通用引物扩增杂交瘤细胞株对应的抗体轻重链基因可变区,琼脂糖凝胶电泳后回收目的片段,与pMD-18T 载体在连接后转化大肠杆菌DH5α感受态细胞,涂LB(含氨苄青霉素)平板,37℃温箱培养过夜,次日从平板上挑取单克隆至LB(含氨苄青霉素)液体培养基中培养后测序,测序结果经IgBLAST 比对分析抗体轻重链可变区核苷酸序列,再经Vbase软件分析抗体轻重链可变区氨基酸序列。
2 结果
2.1 免疫小鼠尾血效价测定
BALB/c 小鼠经 BoNT/FHc 抗原 3 次免疫后,取尾血测效价,结果如图1,5 只小鼠尾血效价均达到1∶16 000。其中2 号小鼠尾血效价最高(1∶32 000),因此选用2 号鼠进行后续细胞融合。
2.2 细胞融合与稳定细胞株筛选
取2 号小鼠脾细胞与Sp2/0 骨髓瘤细胞进行细胞融合,2 周后镜检计算细胞融合率为74.48%(表1)。ELISA 筛选阳性细胞株,得到33 株阳性细胞,计算细胞阳性率为11.54%(表1)。33 株阳性细胞株经传代和扩大培养后,ELISA 再次筛选,有12 株保持阳性,这12 株阳性细胞再经过2 次亚克隆,最终得到7 株能稳定分泌单克隆抗体的阳性细胞株。选取其中细胞培养上清效价最高的1F4 杂交瘤细胞进行后续抗体制备实验。
2.3 抗体制备

图1 小鼠尾血效价测定
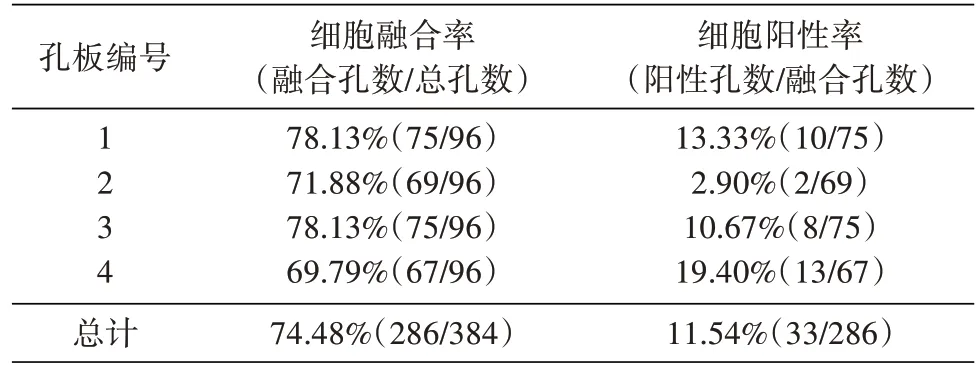
表1 杂交瘤细胞融合率和阳性率
在小鼠腹腔注射1F4 阳性杂交瘤细胞,2 周后抽取小鼠腹水并检测腹水中1F4 抗体的表达情况。SDS-PAGE 结果(图2A)表明,与 Sp2/0 细胞腹水(阴性对照)相比,1F4 杂交瘤细胞腹水在相对分子质量 50×103和 25×103处有特异性表达条带,与抗体重链和轻链分子大小相符。
2.4 抗体纯化
小鼠腹水经Protein G 柱亲和层析纯化后,SDS-PAGE 结果(图2B)显示 10 和 5 μL 均无其他杂带,Gel-pro32 软件分析表明纯化的1F4 抗体纯度大于95%。用Lowrry 蛋白浓度测定试剂盒测定纯化后的1F4 抗体浓度为2 mg/mL。纯化的1F4抗体按1 mg/瓶分装后冻干,-20℃低温保存。
2.5 抗体亲和力测定
通过间接ELISA 建立4 个浓度的BoNT/FHc 抗原与12 个浓度的1F4 抗体的结合反应曲线(图3),按文献报道的公式[14]计算,1F4 抗体与 BoNT/FHc 抗原的亲和力常数为1.08×10-8mol/L,达到纳摩尔每升的水平,表明抗体与抗原有很强的结合能力。
2.6 抗体亚型鉴定
采用抗体分型试剂盒,取阳性杂交瘤细胞株1F4 培养上清进行ELISA 测定,结果表明1F4 抗体重链为IgG1 型,轻链为κ型,均为最常见的亚型(图4)。
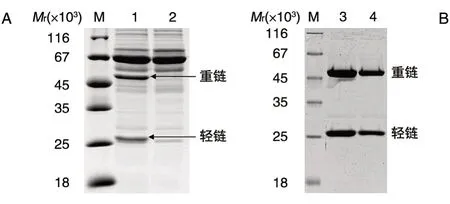
图2 SDS-PAGE 检测小鼠腹水中的抗体表达(A)和1F4 抗体纯度(B)

图3 间接ELISA 测定1F4 抗体-BoNT/FHc 抗原的亲和力常数
2.7 抗体可变区基因调取与氨基酸序列分析
提取1F4 细胞总RNA,经逆转录后通过特异性引物扩增出抗体轻重链可变区,琼脂糖电泳结果显示扩增目的片段均为420 bp 左右,与预期的抗体轻重链可变区大小相符(图5)。扩增的目的片段连入T 载体后测序,测序结果经IgBLAST 比对分析后提取出抗体轻重链可变区的核苷酸序列,再经Vbase 软件分析抗体轻重链可变区基因同源性与氨基酸序列。抗体可变区由FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4 组成,Vbase 软件分析了各框架区(FR)和互补决定区(CDR)长度(氨基酸残基数量);而且抗体CDR3 是与抗原结合最重要的区域,其氨基酸序列在3 个CDR 中多样性最显著,所以重点分析了CDR3 的氨基酸序列。结果见表2,抗体轻链可变区基因与小鼠IGκV3-12*01 序列的同源性为98.2%,轻链可变区蛋白的 4 个 FR(FR1、FR2、FR3、FR4)长度分别为26、17、36、10 个氨基酸残基,夹在 4 个 FR 之间的3 个 CDR(CDR、CDR2、CDR3)长度分别为 6、3、9个氨基酸残基,其中CDR3 氨基酸序列为QQHYSTPWT;抗体重链可变区基因与小鼠IGHV1-5*01 序列的同源性为96.9%,重链可变区蛋白的 4 个 FR(FR1、FR2、FR3、FR4)长度分别为25、17、38、11 个氨基酸残基,3 个 CDR(CDR1、CDR2、CDR3)长度分别为 8、8、12 个氨基酸残基,其中CDR3 氨基酸序列为TRHGYFPSWFAY。

图4 间接ELISA 鉴定1F4 抗体亚型

图5 琼脂糖凝胶电泳鉴定1F4 抗体可变区基因

表2 1F4 抗体轻重链可变区基因同源性与氨基酸序列分析
3 讨论
杂交瘤技术自问世以来在医学和生命科学研究中得到了广泛应用[15]。小鼠骨髓瘤细胞能在体内外无限增殖和分泌无抗体活性的免疫球蛋白,而免疫小鼠脾细胞具有产生抗体的能力,但不能无限增殖,通过融合剂聚乙二醇等将这2 种细胞融合成杂交瘤细胞,可以产生能够永生、快速增殖并能稳定分泌单克隆抗体的细胞株。这种由单克隆细胞繁殖后分泌的抗体具有特异性强、纯度高、可大规模工厂化生产等优点,所以本研究我们选用了杂交瘤技术来筛选BoNT/F 的单克隆抗体。
我们用BoNT/FHc 免疫BALB/c 小鼠,小鼠尾血效价均高于1∶16 000,为杂交瘤细胞融合提供了良好的免疫细胞。通过细胞融合和克隆化,最终筛选到7 株能够稳定分泌单克隆抗体的阳性细胞株,选取其中的1F4 通过小鼠腹水制备抗体,纯化的1F4 抗体与BoNT/FHc 抗原的亲和力常数达到纳摩尔每升水平。以上结果进一步说明杂交瘤技术是筛选高亲和力单克隆抗体的有效手段,并为BoNT/F 检测和中和抗体研发奠定了基础。

