抗流感病毒单克隆抗体CR6261在糖基工程酵母中的表达及分析
李响,石萍萍,王甜甜,刘波,吴军
1.辽宁大学 生命科学学院,辽宁 沈阳 110036;2.军事医学研究院 生物工程研究所,北京 100071;3.安徽大学 物质科学与信息技术研究院,安徽 合肥 230000
历史上,流感多次在世界各地大规模流行,给人类带来了深重灾难。全球范围内,流感病毒每年导致 300 万~500 万例严重疾病和 29 万~65 万例死亡[1]。当循环菌株与疫苗菌株匹配时,目前的流感疫苗可提供实质性的全体免疫力,然而预测和实际菌株不匹配时,疫苗效力就会下降。重要的是,菌株特异性免疫疫苗生产过程繁琐,比如美国2009 年暴发的流感疫情在实现疫苗配置、批量生产和分发时已经结束[2]。一些流感病毒的亚型,如H5N1、H7N7 和H9N2 可以以低频率从动物传播到人类,是下一次流感流行的潜在因素[3],为了避免下次流感带来的灾难,研发一种可以对抗多种流感病毒亚型的抗体是一个可选择的短期预防和治疗方案。CR6261、F16 等通用型抗流感病毒抗体的发现,为抗病毒药物的研发带来了新的曙光。CR6261 从季节性流感疫苗接种者的噬菌体库分离,该抗体对 H1、H2、H5、H6、H8 和H9 等流感病毒血凝素(HA)亚型显示出广泛的体外中和活性,可作为新型抗流感病毒药物[4]。
目前抗体的生产主要依赖哺乳动物表达系统,其生产的糖蛋白类药物与人体来源相同或相似,但该表达系统生产成本高,生产周期长,影响了抗体类药物的应用和推广。酵母表达系统具有生长速度快、便于操作、易大规模培养等优点,但酵母本身的糖基化修饰区别于哺乳动物糖基化修饰[5],因此本研究团队对酵母的N-糖基化修饰和O-糖基化修饰进行了定向改造,使其具有类似于哺乳细胞复杂型糖基修饰能力。改造后的酵母名为糖基工程酵母[6],本研究团队已经多次在糖基工程酵母中表达重组单克隆抗体[7]。研究显示,CR6261 之所以具有广谱活性,是因为其抗体结合部位为HA 的茎部HA2 区域,与头部HA1区域相比较为保守,不易发生变异。大部分抗茎抗体需要抗体依赖的细胞介导的细胞毒性作用(ADCC)参与体内保护,抗茎抗体CR6261 也需要通过ADCC 在体内进行保护[8],抗体去除岩藻糖化后能引发更高的ADCC 活性[9],而酵母本身表达的抗体不具有岩藻糖化修饰,酵母表达的CR6261抗体与动物细胞表达的抗体相比可能会在体内具有更高的保护活性,这些结果提示酵母在生产抗茎抗体CR6261 方面具有一定的优势[10]。
1 材料与方法
1.1 材料
糖基工程酵母36-2ΔPA 感受态细胞由本实验室保存;大肠杆菌DH5α感受态细胞购自北京全式金科技有限公司;质粒pPICZα-A 购自Invit⁃rogen 公司;限制性内切酶、T4DNA 连接酶、蛋白分子量marker 购自NEB 公司;DNA 回收试剂盒购自北京天根科技有限公司;羊抗人IgG(FC)-HRP购自Abcom 公司;测序和引物合成均由上海生工生物工程技术服务有限公司完成。
1.2 CR6261单克隆抗体全基因合成
从GenBank 获得CR6261 抗体基因的氨基酸序列,按毕赤酵母偏好性密码子进行全基因合成,根据基因序列分别设计轻重链的引物,PCR分别获得轻重链基因的片段(PCR 反应条件:95℃预变性5 min;95℃变性30 s,55℃退火30 s、72℃延伸 2 min,30 个循环;72℃延伸 10 min)。产物片段经DNA 回收试剂盒回收。
1.3 表达载体的构建及鉴定
1.3.1 重链克隆表达载体pPICZα-H 的构建 将pPICZα-A 空载体及重链H 片段分别用BstbⅠ/NotⅠ双酶切,T4DNA 连接酶16℃连接过夜,转化大肠杆菌DH5α感受态,转化产物涂LLB-Zeocin 平板,37℃培养过夜,PCR 筛选阳性克隆,对阳性克隆进行测序,并提取pPICZα-H 质粒。
1.3.2 轻链克隆表达载体pPICZα-L 的构建 将pPICZα-A 空载体及轻链L 片段分别用BstbⅠ/NotⅠ双酶切,T4DNA 连接酶16℃连接过夜,转化大肠杆菌DH5α感受态,转化产物涂LLB-Zeocin 平板,37℃培养过夜,PCR 筛选阳性克隆,对阳性克隆进行测序,并提取pPICZα-L 质粒。
1.3.3 轻重链表达载体pPICZα-CR6261-H-L 的构建 将克隆载体pPICZα-H 用BamHⅠ酶切1 h后加入CIP 酶去磷酸化(图1A),将克隆载体pPICZα-L 用BglⅡ/BamHⅠ双酶切(图1B),胶回收2 个片段并用T4DNA 连接酶连接过夜,转化大肠杆菌并回收质粒,获得同时含有CR6261 轻重链的表达载体pPICZα-CR6261-H-L(图1C)。
1.4 线性化质粒并电转糖基工程酵母
提取质粒 pPICZα-CR6261-H-L,经BamHⅠ酶切线性化,用DNA 片段回收试剂盒回收并水洗;回收的线性化质粒通过电击方式转入100 μL糖基工程酵母36-2ΔPA 感受态细胞,加入900 μL 1 mol/L 山梨醇重悬,25℃摇床培养2 h,将转化产物涂 YPD 平板(Zeocin 浓度为 100 μg/mL),3 d 后挑取单克隆。
1.5 试管培养单克隆酵母菌株
将YPD-Zeocin 平板上长出的单克隆接种到3 mL YPD-Zeocin 液体培养基中,25℃摇床培养3 d,此时菌密度达到最大,取100 μL 接种到3 mL BMGY 培养基中,25℃摇床培养24 h,每只试管加入30 μL 甲醇诱导,每隔24 h 补1%甲醇(每次皆为 30 μL),诱导 72 h 后,12 000 r/min 离心5 min,收集上清。
1.6 Western印迹筛选阳性克隆
样 品经 SDS-PAGE 分离,用 TRANS-BLOT 半干转移膜仪将蛋白转移到PVDF 膜上(恒压19 V,1 h),将PVDF 膜置于装满5%牛奶封闭液(100 mL PBST 中加入5 g 脱脂奶粉)的培养皿中,摇床轻摇2 h,将PVDF 膜取出,转入羊抗人IgG-HRP 的 PBST 中 ,摇床轻摇 2 h,取出 PVDF膜,PBST 洗 5 次,每次 5 min,曝光。
1.7 摇瓶上清抗体的纯化
1.7.1 Protein A 纯化 将培养上清pH 值调至7.0,用Protein A 亲和柱进行纯化。层析柱先用水冲洗5 倍柱体积除去柱内酒精,再用B 缓冲液0.1 mol/L 柠檬酸溶液(pH3.0)冲洗5 个柱体积,接着用 A 缓冲液(100 mmol/L PB7.0)平衡,均以 5 mL/min 的流速上样。上样结束后,先用5 倍体积的A 缓冲液洗柱,再用B 缓冲液洗脱,1 mol/L Tris-base 将洗脱液 pH 值调到 7.0。
1.7.2 Superdex200 纯化 层析柱用水冲洗3 倍柱体积,再用0.5 mol/L NaOH 冲洗3 倍柱体积,缓冲液(1 mol/L PB7.2+150 mmol/L NaCl)冲洗 3 个柱体积,待电导稳定后样品从上样环处进样,开始纯化,收取12 min 洗脱峰。
1.8 纯化蛋白的SDS-PAGE鉴定
纯化的样品经SDS-PAGE(恒压160 V,1 h),考马斯亮蓝染色。
1.9 酵母表达抗体活性的测定

图1 pPICZα-CR6261-H-L 表达载体的构建
用间接ELISA 方法检测CR6261 抗体的活性,抗原为本实验室表达并纯化的血凝素HA5、HA7、HA3 以及购买的商品化三价流感病毒裂解苗。将HA5、HA7、HA3、裂解苗分别用抗原包被液进行 1/10 稀释,各取 200 μL 样品加入 96 孔酶联板第一排,其他排各加入100 μL 包被液,排枪吸取第一排100 μL 液体加到下一行中,倍比稀释;37℃包被1 h,加入PBST 清洗1 次,每孔加入5%牛奶封闭液;37℃孵育 1 h,PBST 清洗 5 次;每孔各加入纯化后的CR6261 抗体(用5%牛奶进行1/500 稀释,且加入200 μL 酵母裂解液);37℃温育1 h,用 PBST 洗 5 次;37℃温育 1 h,用 PBST 水洗 5次;每孔各加入100 μL 羊抗人IgG-HRP(用5%牛奶进行1/5000 稀释,且加入200 μL 酵母裂解液);37℃温育 1 h,用PBST 洗5 次;每孔各加 100 μL 显色液,显色 5~10 min;每孔加入 50 μL 终止液终止显色;酶标仪读数,计算抗体滴度。
2 结果
2.1 质粒的鉴定
CR6261 单克隆抗体的轻重链基因片段PCR产物经1%琼脂糖凝胶电泳分离,与预期的目的片段长度一致。PCR 产物回收后与pPICZα载体连接并测序,结果正确。重组质粒pPICZα-CR6261-H-L 经BamH Ⅰ酶切后条带大小接近8000 bp,核酸电泳结果鉴定正确(图2)。
2.2 CR6261单克隆抗体在糖基工程酵母中的表达
将构建的表达载体电转入糖基工程酵母36-2ΔPA,从YPD-Zeocin 平板上随机挑取8 个菌落进行甲醇诱导表达筛选,对表达上清进行还原SDSPAGE、Western 印迹分析,结果如图3。Western 印迹显示2~8 号CR6261 单克隆均有重链蛋白表达,轻链蛋白未显示出明显条带;9 号阳性对照与其对应的SDS-PAGE 中9 号轻重链蛋白浓度相比,IgG 轻链只显示出轻微条带,可能原因是购买的商业化IgG 抗体对轻链灵敏度不高,因此CR6261抗体未显示出轻链条带。选取3 号接种培养。
2.3 CR6261蛋白的纯化
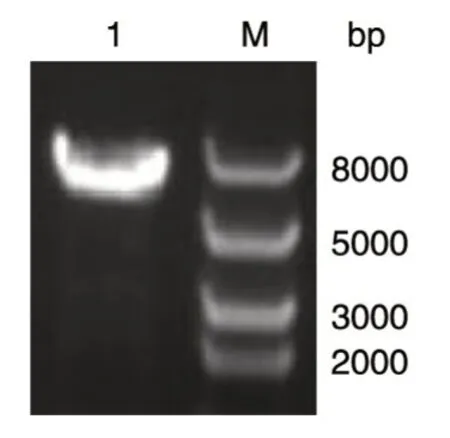
图2 重组质粒pPICZα-CR6261-H-L 的BamHⅠ酶切电泳图
1 L BMGY 液体培养基培养的菌液上清经Protein A 纯化,洗脱样品进行还原SDS-PAGE 分析,如图4A 所示,Protein A 纯化后的样品存在大量降解条带。用Superdex200 对样品进一步纯化,并对洗脱样品进行还原SDS-PAGE 分析,结果如图4B,色谱图紫外吸收峰为单一吸收峰,说明洗脱样品分子大小相近,从蛋白条带位置来看,CR6261 抗体的轻重链均有表达且分子大小与阳性IgG 轻重链大小一致。经2 步纯化后获得了纯度较高的抗体蛋白。
2.4 CR6261抗体活性分析

图3 阳性克隆的筛选

图4 纯化蛋白的还原SDS-PAGE 与纯化图谱
ELISA 分析纯化蛋白的活性(图5),纵坐标抗体滴度表示CR6261 抗体与抗原结合的能力,纯化后的抗体与本实验室纯化的流感病毒血凝素HA7、HA5 有结合活性,其抗体滴度分别为1∶80与 1∶160,与 HA5 的结合活性最高,与 HA3 则无结合活性,这与文献报道的CR6261 抗体结合活性相符合。由此可知酵母生产的CR6261 抗体可以与2 种流感病毒血凝素结合,非单一性结合符合其广谱性质。此抗体与商业化三价裂解苗亦有结合能力,其抗体滴度为1∶640,由于裂解疫苗为混合物,抗体滴度只能作为结合活性的参考。

图5 抗体滴度测定
3 讨论
本研究首次在糖基工程毕赤酵母中表达单克隆抗体CR6261,经过Protein A 亲和层析和spu⁃erdex200 凝胶过滤柱2 步分离纯化获得抗体蛋白,并且轻链和重链能够在酵母中自发通过二硫键装配成正确的结构。糖基工程酵母表达的CR6261 抗体与血凝素HA7 和HA5 有结合活性,与HA3 则无结合活性。文献报道的人单克隆抗体 CR6261 可以与 HA5、HA1、HA9、HA7 蛋白结合,也能与 H1N1、N5N1 灭活病毒结合,与 HA3 无结合活性,此次结果与文献报道相符,说明糖基工程酵母表达的CR6261 抗体具有与人单克隆CR6261 抗体相似的活性。此广谱抗体在病毒早期治疗中具有重要的临床意义,对于防治不同类型的甲型流感以及以后可能出现的甲型流感变异病毒都具有重要意义。
酵母系统近年来已经表达了许多外源蛋白,并且取得了满意的结果,但由于酵母中存在过度糖基化等问题,国内外在毕赤酵母中表达全抗体的报道较少。本实验进一步表明全抗体蛋白可在糖基工程酵母中表达,并且初步证实了其生物活性。
酵母表达上清中的抗体可利用Protein A 亲和层析初步纯化,凝胶过滤层析进行精细纯化。SDS-PAGE 结果显示,在纯化的蛋白中,除了轻重链,还有降解的蛋白。在后续工作中,我们将尝试通过优化菌种与培养条件等方法改善蛋白降解情况。

