电针干预佐剂性关节炎大鼠踝关节滑膜细胞凋亡的 MMP-3、MMP-9分子调节机制
朱俊,陈雨舟,陈云飞,李连波,周殷,苏程果,周海燕,赵阳
(1.成都中医药大学针灸推拿学院/第三附属医院,成都 610075;2.上海中医药大学附属岳阳中西医结合医院,上海 200437)
类风湿关节炎(Rheumatoid arthritis, RA)是以外周关节滑膜炎症为特征的免疫性疾病,在我国的发病人数约有400多万人[1-2]。关节滑膜炎症产生的炎症细胞因子诱导滑膜细胞过度增殖,并产生血管翳侵蚀软骨表面,造成骨和软骨的破坏,导致 RA患者病情进一步恶化。基质金属蛋白酶-3(Matrix metalloproteinase-3, MMP-3)和基质金属蛋白酶-9(Matrix metalloproteinase-9, MMP-9)属于基质金属蛋白酶超家族,促进滑膜细胞异常增殖,在 RA病情进展中起着关键作用[3-5]。
课题组研究证实,电针配合常规药物治疗RA患者有较好的临床疗效;电针干预可以显著控制关节炎大鼠模型的病情进展,减轻炎症的程度[6-7]。本次研究是在既往研究的基础上,以佐剂性关节炎大鼠(Adjuvant arthritis, AA)模型为研究对象,观察电针干预对关节炎大鼠的关节炎症和滑膜细胞凋亡的影响情况,以及滑膜局部 MMP-3、MMP-9的 mRNA和蛋白表达水平,深入探讨电针干预RA关节炎症的分子机制,为临床上电针治疗RA提供新的实验证据。
1 材料与方法
1.1 材料
1.1.1 动物及伦理
SPF级雄性SD大鼠32只(成都达硕动物有限责任公司提供),6周龄,饲养于成都中医药大学针灸推拿学院/第三附属医院实验中心动物房。适应性饲养 1周,大鼠可以自由饮水、饮食、活动。标准光照周期(12 h光照/12 h黑暗),室内温度为(24±2)℃,湿度(65±10)%。
本实验研究通过成都中医药大学实验动物伦理委员会批准(伦理编号2018-05),动物实验根据3Rs原则以及NIH动物护理和指南进行。
1.1.2 试剂
弗氏完全佐剂(批号F-5881),美国Sigma公司;一抗(MMP-3,批号ab52915;MMP-9,批号ab38898),Abcam公司;Tunnel试剂盒(批号11684817910),Roche公司。
1.1.3 设备
电针治疗仪(苏州医疗用品厂,型号 SDZ-Ⅱ),超声细胞粉碎机(宁波新芝生物,型号 JY92-Ⅱn),台式高速冷冻离心机(Heal Force,型号 Neofuge 15R),全自动研磨仪(赛维尔生物,型号 KH-Ⅲ),荧光定量 PCR扩增仪(美国 Bio-Rad,型号 CFX96),Trans-Blot®Turbo™ Transfer System(美国 Bio-Rad),光学显微镜(日本Olympus公司,型号BX51)。
1.2 分组及造模
32只SD大鼠被随机分为生理盐水组、模型组、电针干预组和假电针干预组,每组 8只。参考 Zhu J等[7],生理盐水组大鼠用0.1 mL生理盐水模拟造模,其余各组大鼠的双侧足垫内分别用0.1 mL弗氏完全佐剂(complete Freund's adjuvant CFA)注射进行造模。
关节炎模型的评价[8],分为0~4分,0分为大鼠踝关节无肿胀,无颜色改变;1分为大鼠踝关节皮肤鲜红色且轻度肿胀;2分为大鼠踝关节出现明显的红肿,但未出现足趾变形;3分为大鼠踝关节至足趾部位严重红肿,足趾无跖曲;4分为大鼠踝关节至足趾部位严重红肿,足趾跖曲,且不能负重。评分≥3分即为造模成功。
1.3 电针治疗方式
参考Zhu J等[7]文献,造模后3 d开始,电针干预组大鼠固定后,取双侧足三里穴(ST36,后肢膝关节后外侧,腓骨小头下约5 mm处)和悬钟穴(GB39,后肢外踝尖上10 mm处),局部消毒处理,用0.25 mm×25 mm毫针针刺,足三里穴针刺深度为7 mm,悬钟穴约3 mm;接电针仪正、负电极,刺激参数为电压3 V,连续波,频率2 Hz,15 min,针刺强度以针身微微跳动而大鼠处于安静状态为宜。每2天1次,共计8次。
假电针干预组大鼠在足三里、悬钟穴旁5 mm处予以0.25 mm×25 mm毫针轻轻透皮但不刺入肌肉内,刺激强度与电针干预组相同。生理盐水组和模型组大鼠予以自制大鼠固定器固定,不予其他干预。
1.4 观察指标和方法
1.4.1 标本收集
在实验第18天,所有大鼠禁食24 h后被麻醉脱臼处死,取左侧踝关节做HE染色观察和Tunnel观察,右侧踝关节滑膜组织做RT-PCR和Western blot检测。
1.4.2 踝关节病理形态学
踝关节滑膜组织予以脱钙、脱水,石蜡包埋,4 μm连续切片,苏木精-伊红(hematoxylin-eosin, HE)染色,封片,光镜下(×200)观察踝关节的病理形态学改变。
1.4.3 滑膜细胞凋亡观察
滑膜细胞凋亡采用Tunnel法进行检测,4 μm石蜡切片脱蜡至水,修复,破膜,取Tunnel试剂盒内适量试剂1(TdT)和试剂2(dUTP)按1:9混合,加到对应组织,DAPI复染细胞核,抗荧光淬灭封片剂封片,切片于(×200)荧光显微镜下观察并采集图像。DAPI染出来的细胞核在紫外的激发下为蓝色,阳性凋亡细胞核为绿色。
1.4.4 滑膜MMP-3、MMP-9基因表达
采用RT-PCR检测滑膜MMP-3、MMP-9的mRNA表达水平。踝关节滑膜组织制备匀浆,加入200 μL氯仿提取总RNA,RNA沉淀后,加入适量DEPC处理水完全溶解后得到总RNA,采用核酸定量仪对RNA的纯度及降解情况进行测定。根据反转录反应体系进行反转录,后进行荧光定量PCR反应体系测定RNA表达情况。反应条件为预变性温度 95℃,时间 2 min,循环 1次;变性温度95℃,时间10 s;退火温度Tm,30 s,循环40次,延伸温度95℃,时间10 s;60℃,1 min,95℃,15 s。检测结果取三孔的平均值。基因序列见表1。
1.4.5 滑膜MMP-3、MMP-9蛋白表达
采用Western Blot检测滑膜MMP-3、MMP-9蛋白表达水平。滑膜组织样品制备,BCA蛋白定量检测,10 μL移液器上样,90 V恒压凝胶电泳;取出PVDF膜,与一抗(MMP-3,1:200;MMP-9,1:200)杂交,ECL显影,胶片扫描,Image J软件分析其灰度值。

表1 MMP-3、MMP-9、GAPDH基因序列
1.5 统计学方法
采用SPSS15.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差表示,方差齐性者采用单因素方差分析,组间两两比较采用LSD检验。检验水准为α=0.05。
2 结果
2.1 大鼠踝关节病理形态情况
如图1所示,生理盐水组大鼠踝关节滑膜组织细胞呈单层排列,无炎性细胞浸润和滑膜细胞增生。模型组和假电针干预组大鼠踝关节滑膜细胞呈过度增殖状态,炎性细胞显著增多。电针干预组大鼠踝关节滑膜组织中滑膜细胞增生程度显著低于模型组和假电针干预组,且炎性细胞数较少。
2.2 大鼠踝关节滑膜细胞凋亡情况
如图2所示,绿色显影即代表凋亡细胞数量,蓝色显影代表正常细胞数量。生理盐水组大鼠踝关节滑膜细胞仅存在少量的阳性凋亡细胞,模型组大鼠踝关节滑膜阳性凋亡细胞数量显著多于生理盐水组,假电针干预组的阳性细胞数量与模型组相比无明显差异,电针干预组大鼠的阳性细胞大量表达,高于其余各组。
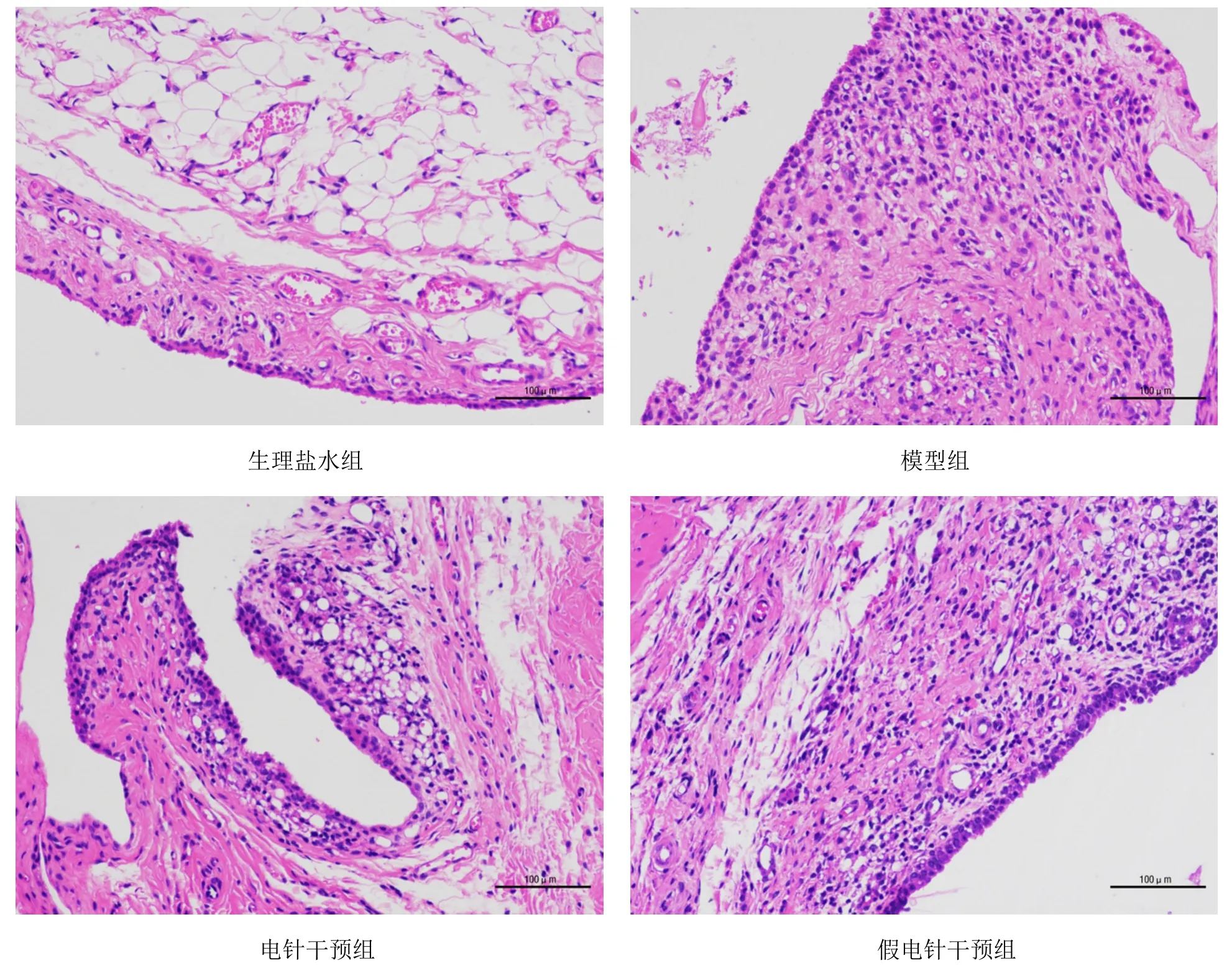
图1 各组大鼠踝关节滑膜组织病理形态情况(光学显微镜,×200)
2.3 各组大鼠踝关节滑膜组织 MMP-3、MMP-9 mRNA表达
统计结果显示,MMP-3、MMP-9 mRNA表达在不同组别之间存在显著性差异(P=0.001,P=0.001)。如图 3A所示,MMP-3在模型组中的表达为43.78±23.61,显著高于其在生理盐水组的表达 1.70±0.82(P=0.008);MMP-3在电针干预组中的表达为12.65±6.55,显著低于其在模型组的表达情况(P=0.036);MMP-3在假电针干预组中的表达为 28.72±15.17,与模型组比较差异无统计学意义(P=0.586),MMP-3在电针干预组的表达显著低于假电针干预组的表达水平(P=0.034)。
如图3B所示MMP-9在模型组中的表达为120.76±55.73,显著高于生理盐水组的 1.64±1.01(P=0.003);MMP-9在电针干预组中的表达为 8.78±3.67,显著低于其在模型组的表达水平(P=0.004);MMP-9在假电针干预组中的表达为 73.49±30.10,与模型组比较差异无统计学意义(P=0.283)。MMP-9在电针干预组的表达显著低于假电针干预组的表达(P=0.002)。
2.4 各组大鼠踝关节滑膜组织MMP-3、MMP-9蛋白表达
统计结果显示,MMP-3、MMP-9蛋白表达在不同组别之间存在显著性差异(P=0.001,P=0.001)。如图 4A所示,MMP-3在模型组中的表达为0.88±0.30,显著高于其在生理盐水组的表达 0.24±0.15(P=0.001);MMP-3在电针干预组中的表达为 0.49±0.28,显著低于其在模型组的表达水平(P=0.012);MMP-3在假电针干预组中的表达为 0.79±0.37,与模型组比较差异无统计学意义(P=0.549)。MMP-3在电针干预组中的表达显著低于其在假电针干预组的表达水平(P=0.048)。
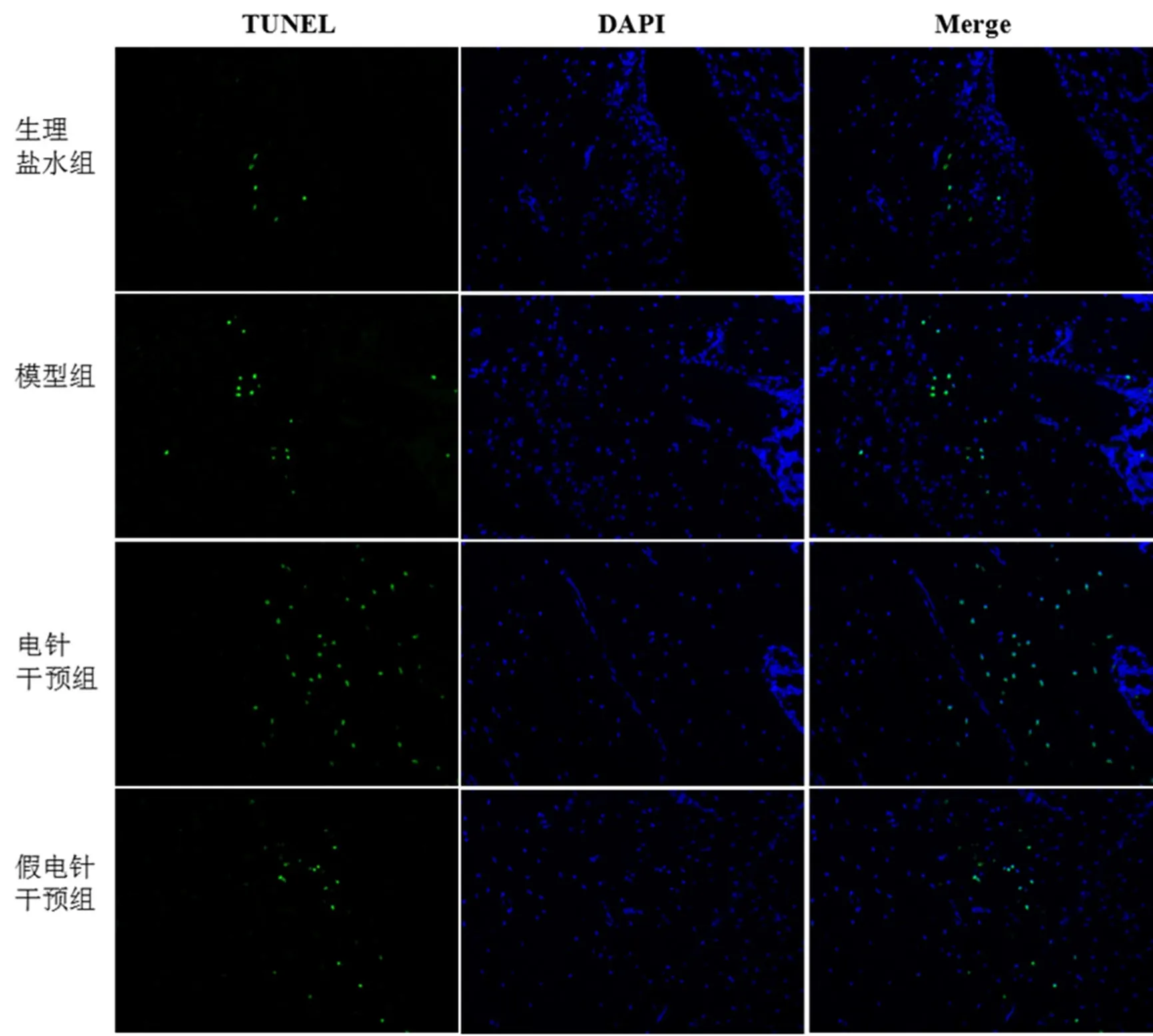
图2 各组大鼠踝关节滑膜细胞凋亡情况(荧光显微镜,×200)
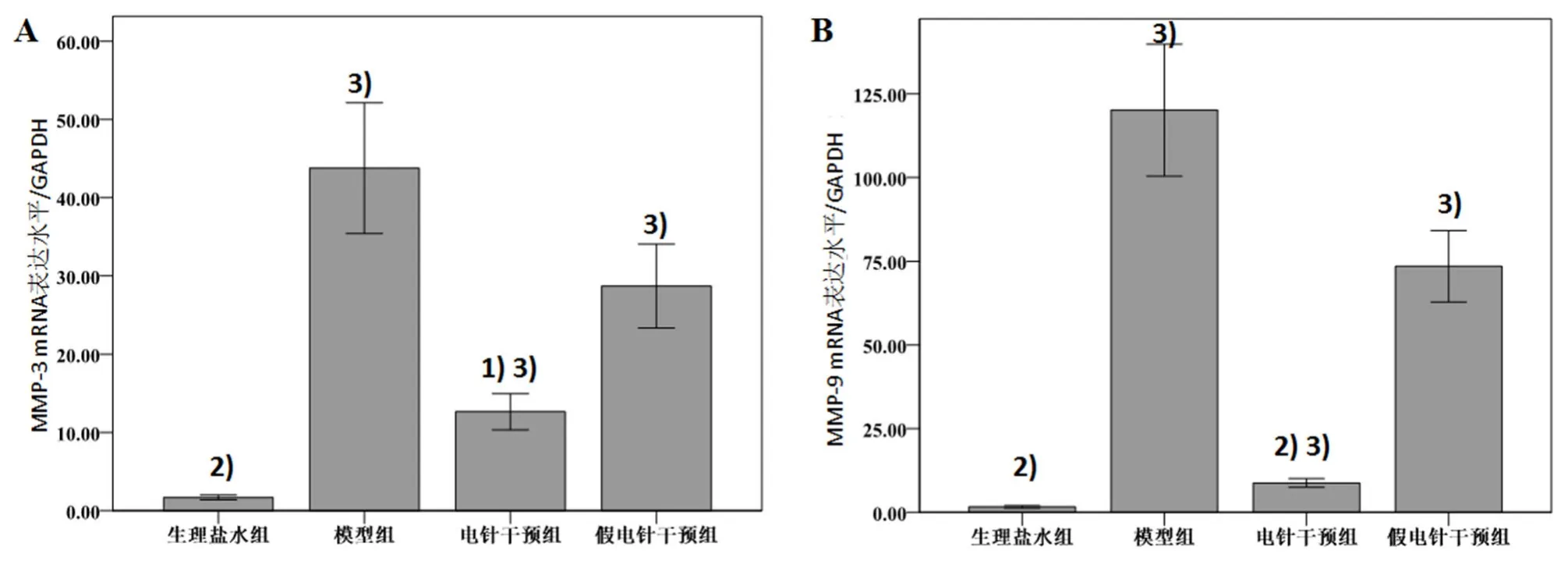
图3 各组大鼠踝关节滑膜组织MMP-3、MMP-9 mRNA表达(,n=8)
如图4B所示,MMP-9在模型组中的表达为0.93±0.29,显著高于其在生理盐水组的表达 0.27±0.19(P=0.001);MMP-9在电针干预组中的表达为 0.48±0.17,显著低于其在模型组的表达水平(P=0.001);MMP-9在假电针干预组中的表达为 0.83±0.34,与模型组比较差异无统计学意义(P=0.449)。MMP-9在电针干预组中的表达显著低于其在假电针干预组的表达水平(P=0.010)。Western blot检测各组大鼠 MMP-3、MMP-9的表达情况见图5。

图4 各组大鼠踝关节滑膜组织MMP-3、MMP-9蛋白表达(,n=8)
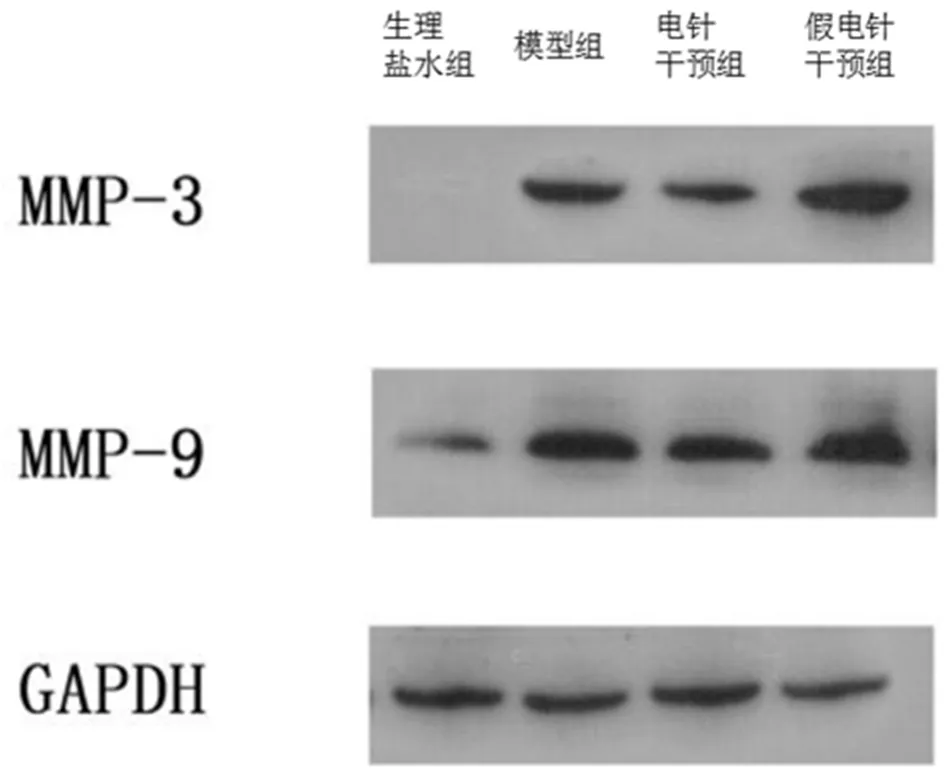
图5 Western BIot检测各组大鼠MMP-3、MMP-9的表达情况
3 讨论
类风湿关节炎属于中医学“痹证”范畴,其病机多为本虚标实。临床研究证实,电针治疗可以显著抑制RA患者的关节疼痛、肿胀等情况,改善患者的生活质量,控制病情进展[9-10]。电针能有效降低RA患者外周血和关节滑液中炎性细胞因子IL-1、IL-6、TNF-α、VEGF的表达水平,提高抑炎性细胞因子IL-4、IL-10的表达水平,改善RA患者的免疫平衡状态[11-12]。
动物实验也证实电针干预可以显著抑制关节炎大鼠模型的炎症进展[13]。电针能够上调RA大鼠下丘脑和脊髓腺苷 A1受体的表达,实现其镇痛效应;电针可能上调滑膜β-END和 MOR、KOR、DOR表达水平,实现对RA大鼠的疼痛干预效应[14-16]。在系统免疫方面,电针足三里、悬钟穴可以显著改善RA动物模型的系统性炎症,降低CD4+IL-17+Th17细胞在脾脏中的表达数量,增加Foxp3+Treg细胞的表达数量,改善机体内的免疫平衡状态,减轻外周炎性细胞因子的表达水平[13]。在关节炎症局部,电针足三里、悬钟穴可以显著抑制滑膜局部炎症细胞浸润[17]。这些研究从干预系统性炎症、局部炎症和镇痛角度进行阐释,而对异常增殖的滑膜细胞本身的关注较少。本次研究是在此基础之上,进一步探讨电针干预对关节炎异常增殖的滑膜细胞的影响情况。
异常增殖的滑膜细胞是 RA关节炎症和血管翳形成的核心环节[18]。低氧导致滑膜细胞处于缺氧状态,进而导致滑膜组织内出现异常的新生血管,将炎性细胞因子IL-1、IL-6、TNF-α等带入滑膜组织内,导致滑膜细胞出现炎性反应而过度增殖,导致RA病情进一步加重。因而促进异常增殖的滑膜细胞凋亡是控制 RA病情进展的关键所在。笔者前期研究证实电针可以抑制关节炎大鼠的滑膜新生血管的标志物CD34的表达,减少新生血管形成,减轻关节炎症的发生[7]。Tunnel显示电针干预组的免疫荧光数高于模型组和假电针干预组,HE染色显示,电针干预组大鼠的关节炎症显著轻于模型组。提示电针可以显著促进增殖的滑膜细胞凋亡,进而抑制了模型大鼠的关节炎症发生,这与我们的前期研究结果相吻合。
MMP-3和MMP-9在RA发病过程中起着关键的作用,可以促进滑膜细胞的异常增殖和软骨的破坏[19]。MMP-3和MMP-9在RA患者外周血中均被检测出高表达水平,且与RA病情的严重程度呈正相关性,甚至导致关节软骨出现破坏[20]。MMP-3和MMP-9的表达与滑膜细胞增殖呈现出密切的相关性,控制MMP-3和MMP-9在滑膜局部的表达可以有效地促进滑膜细胞的凋亡[21-23]。本次实验研究证实,电针干预可以显著地降低 MMP-3和MMP-9的基因和蛋白表达水平。在其他类型的疾病动物模型中,电针干预对MMP-3和MMP-9的表达也显示出类似的趋势[24-26]。这些研究情况与本实验研究结果一致。
假电针干预是目前针刺研究中的热点问题。临床研究显示,电针经穴相对于在非经非穴处进行电针干预,可以更加有效地改善RA患者的生活质量[9];而相同方式的临床研究显示,电针可以更有效地改善老年便秘患者的症状[27]。在动物实验中,相比于非经穴处电针干预,电针特定穴位预处理能更加有效地提高败血症模型小鼠的存活率[28]。本研究选用在大鼠足三里、悬钟穴旁开进行经皮电刺激,结果与前期的文献报道一致,电针干预对AA大鼠MMP-3和MMP-9的抑制作用显著优于假电针干预组。显示出电针干预的有效性。
综上所述,电针干预可以显著促进AA大鼠的滑膜细胞凋亡,其作用机制可能通过降低 MMP-3和 MMP-9的表达实现。然而本次研究没有用阻断剂阻断来验证电针的干预效应,对细胞凋亡的数量未进行半定量分析,这些是本次实验不足的地方。在进一步的研究中,笔者将继续围绕滑膜细胞凋亡的相关分子机制进行分析,为电针临床治疗RA提供更加有力可靠的实验依据。

