常压室温等离子体诱变选育核黄素高产突变株
祝金山,吴烨飞,陆建卫
(浙江钱江生物化学股份有限公司,浙江 嘉兴 314400)
核黄素(Riboflavin)又名维生素B2,化学名称7,8-二甲基-10-(D-1-核糖基)异咯嗪,结构式为C17H20N4O6[1]。核黄素是一种人和动物必需的水溶性维生素,研究表明核黄素的缺乏会导致急慢性肠胃炎、溃疡等消化道病变[2],甚至会增加患某些癌症的风险,如食道癌、宫颈癌等[3-4]。另外,核黄素对一些神经系统疾病(如帕金森症、偏头痛、多发性硬化等)具有抑制作用[5]。微生物发酵法是目前唯一被核黄素工业化生产采用的方法,常用的生产菌有棉囊阿舒氏酵母和枯草芽孢杆菌两种。国内核黄素生产厂家广济制药有限公司利用一株枯草芽孢杆菌作为生产菌,发酵周期70 h,终产物中核黄素质量浓度达到26.5 g/L,是现有报道的工业化生产核黄素的最高水平[6-7]。目前国内外对于核黄素生产菌的研究主要集中于基因工程菌的构建,常规诱变育种方法鲜有报道,但大部分构建的工程菌需要使用抗生素基因,导致核黄素工业化生产中易产生抗生素滥用问题,严重影响核黄素在医药、食品、饲料等领域的使用安全[8]。
常压室温等离子体(Atmospheric and room temperature plasma, ARTP)诱变技术具有独特的SOS修复机制,对微生物细胞壁/膜的结构及通透性作用明显,是一种高效、清洁的诱变技术[9-10],广泛应用于微生物诱变育种[11-12]。笔者采用常压室温等离子体对本公司保藏的核黄素生产菌进行诱变处理,以期获得稳定、高产的核黄素生产菌。
1 材料与方法
1.1 材料与仪器
1.1.1 出发菌株
枯草芽孢杆菌(BacillusSubtilis)QJVB-1,浙江钱江生物化学股份有限公司保藏菌种。
1.1.2 培养基
斜面/分离平板培养基:葡萄糖18 g/L,蛋白胨3 g/L,酵母粉2 g/L,琼脂粉15 g/L,pH 6.7~6.9。
种子培养基:葡萄糖20 g/L,玉米浆干粉6 g/L,尿素2 g/L,pH 6.5~6.7。
摇瓶发酵培养基:蔗糖30 g/L,菜籽油10 g/L,黄豆粉10 g/L,玉米浆干粉10 g/L,NaCl 2.5 g/L,pH 6.5~6.7。
5 L罐培养基:基础配方同摇瓶发酵培养基。
补料培养基:质量分数为50%的葡萄糖。
1.1.3 仪 器
SGD-4全自动还原糖测定仪,山东省生物传感器重点实验室;紫外分光光度计,上海仪电分析仪器有限公司。ARTP-Ⅱ诱变育种仪,无锡源清天木生物科技有限公司。
1.2 方 法
1.2.1 选育流程
原始菌株→种子液→稀释→ARTP诱变→平板初筛→摇瓶复筛。
1.2.2 筛选方法
1) 初筛:将种子液用生理盐水稀释108倍并涂布于分离平板,涂布后的分离平板置于32 ℃条件下遮光培养2~3 d,挑选菌落直径大,颜色深,菌苔较厚的单菌落作为复筛出发菌株。
2) 复筛:摇瓶发酵复筛。
3) 遗传稳定性筛选:根据复筛结果挑选出较优菌株,经过5 次连续传代,挑取核黄素生产能力高、遗传性状稳定的菌株。
1.2.3 ARTP诱变方法
将种子液OD600值调节至0.8左右,均匀涂布于载片表面,干燥后待用。诱变仪工作条件:注入气体为氦气,电源功率200 W,气流量10 L/min,照射距离2 mm,样品量10 μL。处理时间依次为0,20,40,60,80,100,120,140,160,180,200,220,240 s。将处理后的载片置于装有1 mL生理盐水的EP管以溶出菌体,再取0.1 mL涂布至分离平板,培养后观察并记录菌落数,采用平板菌落计数法计算致死率,并计算正突变率,即


1.2.4 发酵实验
种子培养:挑取活化的单菌落接入装有50 mL种子培养基的250 mL三角瓶中,200 r/min、37 ℃培养20 h。
摇瓶发酵:按5%的接种量将培养好的种子液接入装有100 mL发酵培养基的500 mL三角瓶中,200 r/min、37 ℃培养84 h,定时取样测定葡萄糖质量浓度、核黄素质量浓度、生物量等数据。
5 L罐发酵:接种量5%,起始装液量50%。控制通气量1 m3/min,溶氧40%~60%,pH 6.4~6.6,37 ℃培养84 h,发酵过程中通过补料控制还原糖质量分数为0.8%~1.0%。定时取样测定葡萄糖质量浓度、核黄素质量浓度、生物量等数据。
1.2.5 相关测定方法
1) 还原糖测定
取1 mL发酵液于1.5 mL EP管,10 000 r/min离心3 min,取上清液,使用SGD-4全自动还原糖测定仪测定还原糖[13]。
2) 生物量测定
采用平板菌落计数法测定发酵液中的生物量。
3) 核黄素含量测定
取发酵液1 mL于100 mL烧杯,加入2 mL冰醋酸和20 mL水,加热煮沸5 min,加适量水,冷却后移入250 mL容量瓶并定容。摇匀后过滤,取滤液用分光光度计于444 nm条件下比色测定,根据标准曲线计算核黄素含量。
4) 核黄素标准曲线的制作
准确称取100 mg核黄素标准品于100 mL烧杯,加入5 mL冰醋酸和20 mL水,缓慢加热使之完全溶解,用水稀释至5,10,15,20,25 mg/L,波长444 nm下测定吸光值。以核黄素质量浓度为横坐标,吸光值为纵坐标,线性回归后求得核黄素标准曲线。
2 结果与分析
2.1 核黄素标准曲线
对核黄素标准曲线进行回归,得到标准溶液的核黄素质量浓度x与吸光度y之间的线性回归方程为
y=0.031x+0.009
相关系数R2=0.998 4,说明在5~25 mg/L范围内线性关系良好,核黄素标准曲线见图1。
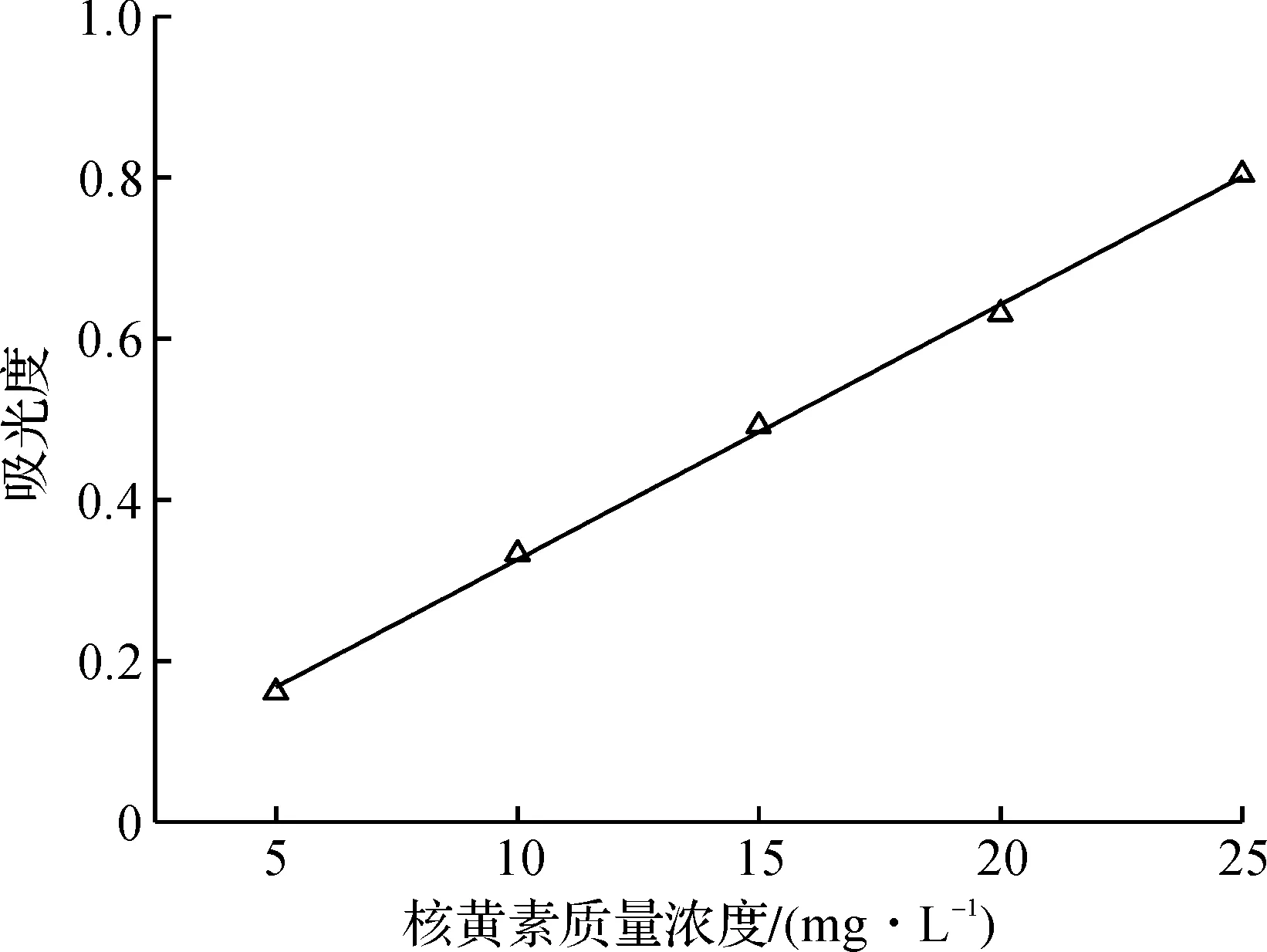
图1 核黄素标准曲线Fig.1 The standard curve of riboflavin by spectrophotometry
2.2 ARTP诱变时间对致死率及正突变率的影响
按1.2.3方法对QJVB-1菌株进行诱变,计算致死率及正突变率,获得致死率及正突变率曲线,结果如图2所示。
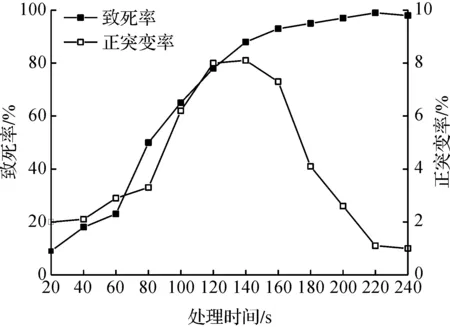
图2 ARTP处理时间与致死率及正突变率的关系Fig.2 The relationship between ARTP treatment time and the lethal rate/ positive mutation rate
由图2可知:在实验条件下,随着诱变时间延长,菌体致死率明显增加,当诱变时间超过160 s,致死率上升至90%以上。在20~140 s处理时间范围内,正突变率从2%升至最高值8.1%,处理时间大于140 s后正突变率逐渐下降。为提高获得高产菌株概率,确定140 s为最佳诱变时间,此时致死率和正突变率分别为88.1%和8.1%。
2.3 筛选核黄素高产突变株
菌落形态与核黄素产量存在相关性:颜色深、直径大、菌苔厚的菌落对应的突变株,其核黄素合成能力强[14-15]。通过观察菌落形态,从20 个分离平板共计677 个菌落中初筛出100 个单菌落,摇瓶复筛后挑选出4 株发酵水平较出发菌株提高15%以上的菌株,其摇瓶发酵水平如图3所示。
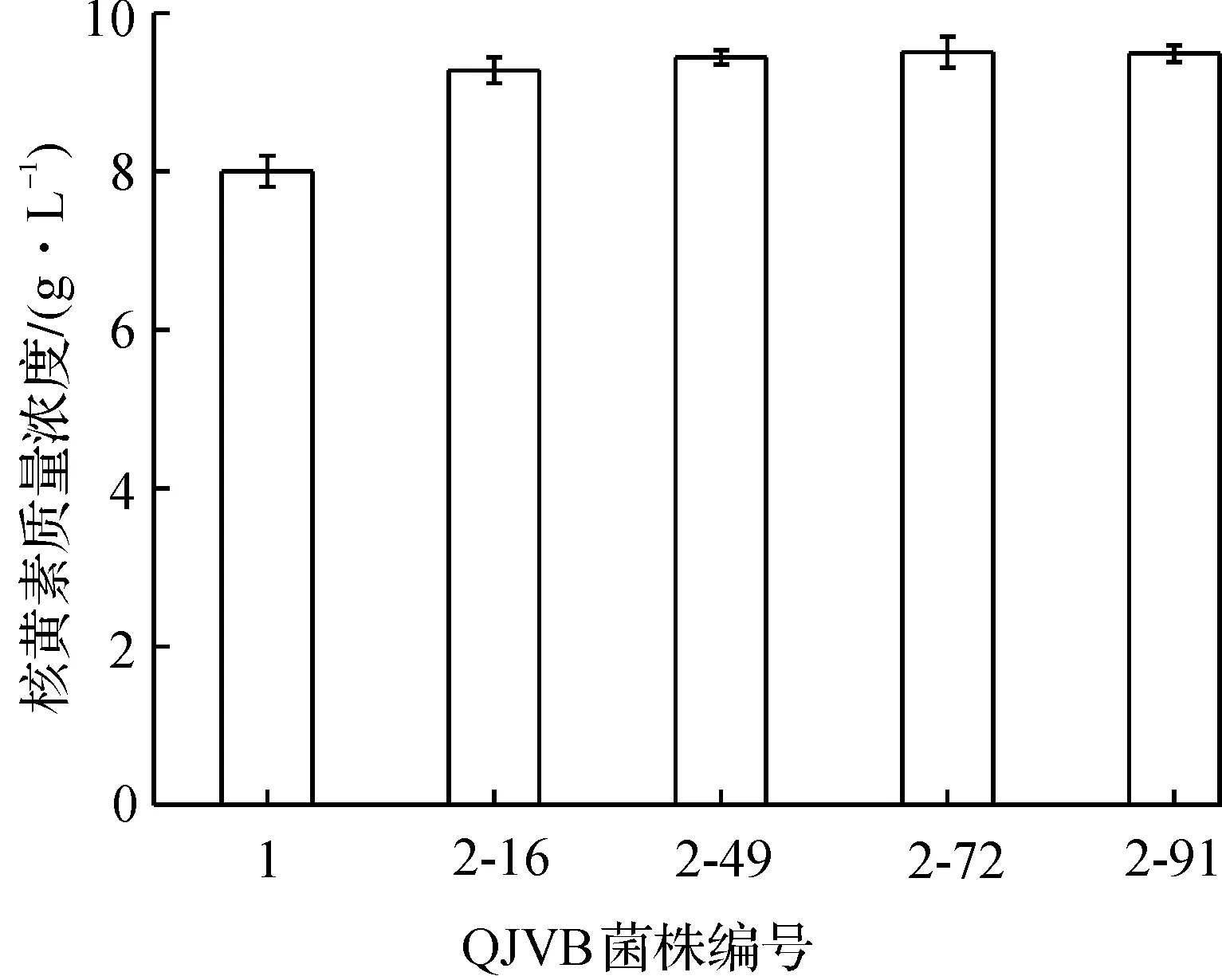
图3 诱变菌株与出发菌株的核黄素产量比较Fig.3 The comparison of the mutant strains and the parent strain on riboflavin production
2.4 遗传稳定性分析
遗传稳定性是工业菌株的必备特性之一。实验对复筛得到的4 株突变株进行5 次连续传代,测定每次传代后的核黄素摇瓶发酵水平,以此考察突变株的遗传稳定性,结果如表1所示。
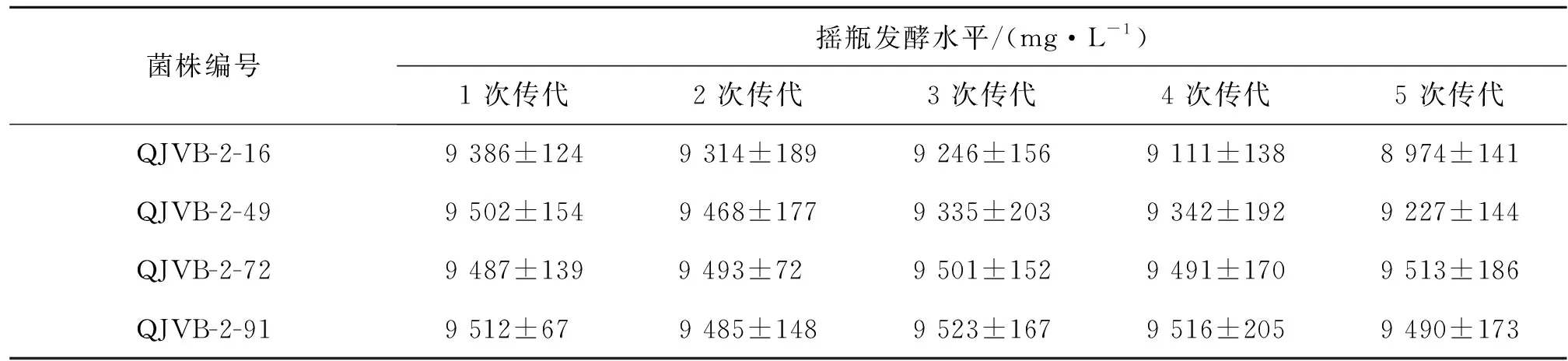
表1 诱变菌株的遗传稳定性Table 1 The genetic stability of mutant strains
由表1可知:随着传代次数增加,突变株QJVB-2-16与QJVB-2-49的发酵终产物中核黄素质量浓度逐渐降低,遗传稳定性差;突变株QJVB-2-72与QJVB-2-91随着传代次数增加,发酵液中核黄素质量浓度未下降,具有良好的遗传稳定性。
2.5 突变菌株与出发菌株的发酵曲线
根据2.4结果,挑选诱变株QJVB-2-72与QJVB-2-91进行摇瓶发酵,测定核黄素累积,比较3 株菌的发酵曲线,结果如图4所示。
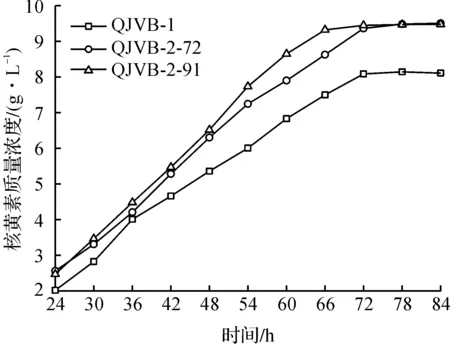
图4 突变菌株与出发菌株的核黄 素累积曲线Fig.4 The riboflavin accumulation profile of the mutant and parent strains
由图4可知:与出发菌株相比,突变株QJVB-2-72与QJVB-2-91均表现出更强的核黄素合成能力,发酵72 h核黄素质量浓度分别达到9 361 mg/L和9 447 mg/L,较出发菌株分别提高15.6%和16.8%。其中突变株QJVB-2-91发酵66 h即达到最大浓度,发酵周期缩短6 h。进一步比较突变株QJVB-2-91和出发菌株QJVB-1生物量及糖耗曲线,结果如图5所示。
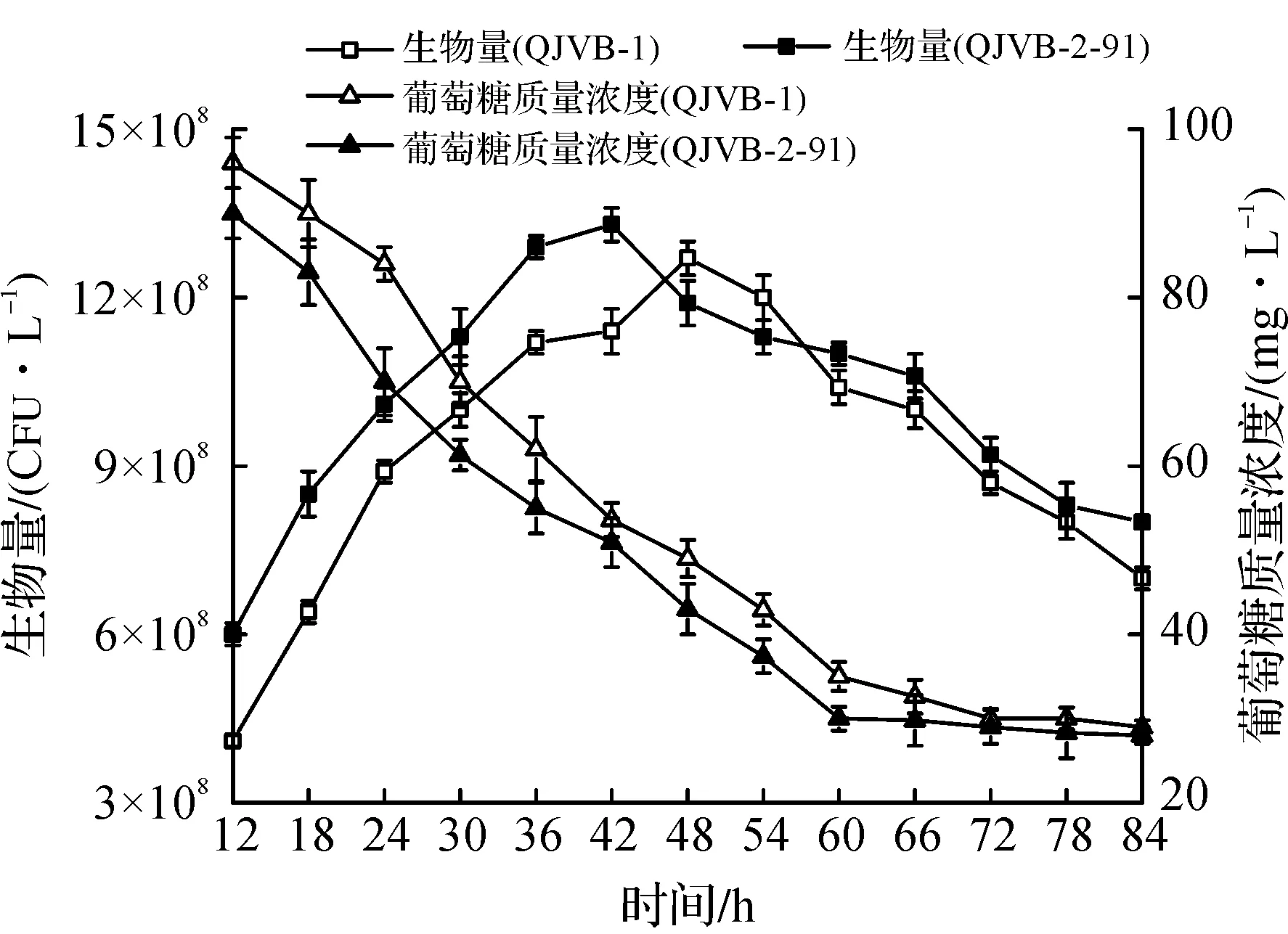
图5 突变株和出发菌株摇瓶发酵的生物量及糖耗比较Fig.5 The comparison of the biomass and sugar consumption between the mutant strains and the parent strain in flask fermentation
由图5可知:与出发菌株相比,突变株QJVB-2-91在60 h前表现出更强的糖耗能力,生物量迅速增加,42 h达到最大生物量,较出发菌株提早6 h。60 h后,突变株糖耗能力逐渐降低,与图4体现的发酵周期缩短、更强的核黄素合成能力相吻合。
2.6 突变株QJVB-2-91在5 L罐上的发酵曲线
利用5 L罐发酵比较突变株QJVB-2-91与出发菌株的发酵曲线,结果如图6所示。
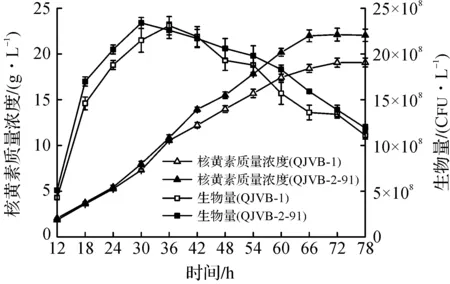
图6 5 L罐中的核黄素发酵过程曲线Fig.6 The riboflavin fermentation profile in fermenter(5 L)
由图6可知:突变株QJVB-2-91与出发菌株在5 L罐发酵过程中体现出的差异与摇瓶发酵相似。出发菌株的核黄素合成能力在整体过程中比较平稳,发酵液中核黄素浓度在72 h出现最高点,产量19 060 mg/L;突变株QJVB-2-91的核黄素累积速度较快,发酵66 h达到最高值,产量22 001 mg/L,较出发菌株提高15.4%。分析生物量可知:两菌的最大生物量基本相同,但突变株生长速度更快,在发酵36 h时达到最高值,比出发菌株提早6 h,且细胞死亡速度比出发菌株缓慢。
3 结 论
对核黄素生产菌QJVB-1进行了ARTP诱变,通过初筛和复筛,得到QJVB-2-91突变株,其核黄素生产能力提高至9 447 mg/L,较出发菌株的8 087 mg/L提高16.8%,且发酵周期缩短6 h。该突变株经过5次连续传代,遗传性状稳定。通过5 L罐发酵验证了突变株QJVB-2-91核黄素合成能力:发酵66 h核黄素累积质量浓度达到22 001 mg/L,较出发菌株最高累积质量浓度19 060 mg/L(72 h)提高15.4%,发酵周期缩短6 h。研究对核黄素生产成本的降低和产能的提高具有一定的意义。

