不同短链脂肪酸对高山被孢霉生物合成ARA的影响
李悦明,徐洪清,徐建春,逄瑞莲,徐炳政
(1.青岛琅琊台集团股份有限公司,山东 青岛 266400;2.青岛西海岸新区农业农村局,山东 青岛 266400;3.青岛西海岸新区市场监督管理局,山东 青岛 266400)
花生四烯酸(Arachidonic acid,简称ARA),属于ω-6系列的多不饱和脂肪酸,在体内发挥多种生物功能,它不仅作为一种极其重要的结构脂类广泛存在于哺乳动物的细胞膜上,而且是人体前列腺素、血栓素和白三烯等活性物质合成的前体物质。因其功能的多样性,ARA已在保健食品、化妆品和医药等领域得到广泛应用[1]。长期以来,ARA的主要来源是动物肝脏、鱼油和猪肾上腺等动物组织,但动物组织中ARA含量低且来源有限,不能满足市场的需要。微生物法生产ARA具有发酵周期短、不受季节和来源限制等特点,受到国内外学者的广泛关注[2]。目前,高山被孢霉已经成为工业化发酵生产ARA的最佳菌株,然而,产量低和成本高仍然是利用高山被孢霉大规模生产ARA的瓶颈。因此提高ARA在培养过程中的生产效率,成为本领域的研究热点[3,5]。
直链或支链羧酸,包括短链脂肪酸(SCFA,Short-chain fatty acid)如乙酸、丙酸、丁酸等,可以提供酰基辅酶A作为脂肪酸合成的起始单元[4],而用于脂肪酸生物合成的还原力——NADPH的产生则主要取决于苹果酸酶(ME,Malic enzyme)[7]。研究表明SCFA可以被某些海藻利用[6-8]。笔者研究了包括乙酸、丙酸、丁酸、异丁酸(2-甲基丙酸)、戊酸和异戊酸(3-甲基丁酸)在内的6种不同SCFAs对高山被孢霉中油脂积累和脂肪酸生物合成的影响。发酵过程中,将6种SCFAs分别加入不同实验组的培养基中,尝试提供各种酰基CoA底物,通过检测各组实验不同阶段细胞生长速率差异、脂肪酸组成和ME活性的变化研究高山被孢霉中ARA生物合成的代谢调控机理。
1 材料与方法
1.1 菌株与培养条件
实验菌株为高山被孢霉LYT22(MortierellaalpinaLYT22),此菌株由野生型菌株高山被孢霉M32222菌株诱变而来,由笔者公司自行保存。
PDA培养基1 L:土豆200 g,葡萄糖20 g,琼脂20 g(用于平板保存)。
种子培养基1 L:葡萄糖30 g,酵母提取物6 g,KH2PO43 g,NaNO32.8 g,MgSO4·7H2O 0.5 g。
发酵培养基1 L:葡萄糖80 g,酵母提取物11 g,蛋白胨10 g,柠檬酸三钠盐2 g,KH2PO43.8 g,NaNO33.5 g,MgSO4·7H2O 0.5 g。
乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、三氯甲烷:分析纯,购于青岛精科仪器试剂有限公司。
种子在25 ℃,200 r/min条件下培养3 d,然后按V(种子量)∶V(发酵量)=1∶10接种量接到发酵培养基中,培养7 d。分批补料发酵实验是在5 L Biostat®B发酵罐中进行,配有pH、温度、搅拌和溶解氧质量浓度(DO)传感器。初始装填3 L发酵培养基,在固定的4.5 L/min气流速率下自动调节搅拌速度为200~500 r/min,使DO保持在20%以上。利用m(葡萄糖)∶V(补料液)=3 g∶10 L的葡萄糖溶液作为补料培养基流加至培养基中,将葡萄糖质量浓度维持在10~15 g/L,在排气口增加水冷系统,以减少蒸发。
在此发酵条件下,培养基的pH逐渐升高,因此将乙酸、丙酸、异丁酸、丁酸、异戊酸或戊酸中的一种短链脂肪酸作为pH调节剂培养基,将pH控制在6.5,在对照组中添加3 mol/L HCl,保持pH值为6.5。由于某些SCFA(例如丁酸和戊酸)具有强烈的刺激性气味,因此所有实验均在通风室内进行,并且排出尾气先经5 mol/L NaOH溶液吸收,然后再经过填充满活性炭的柱子吸附后,排放到环境。
1.2 生物量测定
实验中生物量以干细胞质量(DCW)表示。将细胞悬浮液的样品(30 mL)在7 000g和4 ℃条件下离心10 min,用0.2 mol/L磷酸盐缓冲溶液洗涤2次,将细胞沉淀,在-50 ℃条件下冷冻干燥至恒重。
1.3 脂质提取与脂肪酸分析
使用改良的Bligh-Dyer算法计算总脂质含量[9]。室温下,将干燥的细胞提取到10 mL氯仿甲醇混合液(V(氯仿)∶V(甲醇)=2∶1)中,用无水Na2SO4干燥脂质提取物,通过蒸发除去溶剂,称重计算总脂质。将提取的脂质约10 mg溶解在1 mL氯仿中,加入3 mL硫酸-甲醇溶液(V(硫酸)∶V(甲醇)=2∶100),85 ℃下孵育150 min,获得脂肪酸甲酯(FAME)。脂肪酸甲酯(FAME)用正己烷萃取,采用气相色谱法(GC)测定。使用HP-INNOWAX(30 m×0.25 mm×0.25 μm)毛细管柱分离FAME。柱箱初始温度设置为100 ℃,持续1 min,然后以15 ℃/min的速度升至250 ℃,保持5 min。分流比为V(进样)∶V(分流)=1∶19,用氮气作载气,使用氢火焰离子检测器(FID)进行检验,进样口和火焰离子化口的温度为260 ℃,进样量为1 μL。
1.4 细胞裂解液制备
为了制备用于酶活测定的细胞提取物,将收获的菌体以7 000g离心,先用4 ℃的蒸馏水洗涤沉淀物,然后用洗涤缓冲液(400 mmol/L Tris-HCl缓冲液,pH 7.4,m(甘油)∶V(水)=20 g∶100 L,1 mmol/L 二硫赤藓糖醇(DTT))洗涤并悬浮。在60 MPa下通过细胞破碎仪(Constant systems)将细胞裂解,裂解液在4 ℃下10 000g离心10 min,将上清液立即用于测定ME活性。使用Bradford方法以牛血清白蛋白(BSA)为标准测定蛋白质浓度。
1.5 NADP+依赖的苹果酸酶酶活分析
在60 MPa下通过细胞破碎仪(Constant Systems)将细胞裂解,将裂解液在4 ℃下10 000g离心10 min,将上清液立即用于测定ME活性。使用Bradford方法以牛血清白蛋白(BSA)为标准测定蛋白质浓度。通过分光光度法监测25 ℃下NADPH的形成速率进行苹果酸酶的活性[10]测定。反应在包含50 mmol/L Tris-HCl(pH 7.4)、0.5 mmol/L NADP+、20 mmol/L L-苹果酸盐和10 mmol/L MgCl2的1.0 mL反应体系中进行。酶活性(U)的单位定义为每分钟NADPH的增加量,以OD340增加0.001/min表示。比活性定义为U/mg蛋白。
1.6 葡萄糖浓度分析
每4 h从发酵罐中取出25 mL样品,通过配备有葡萄糖氧化酶电极的生物传感器(SBA-40E,山东省科学院生物研究所)对残留的葡萄糖进行分析。
2 结果分析
2.1 短链脂肪酸对被孢霉细胞生长和脂质积累的影响
在发酵过程中,各实验组以pH调控的方式分别加入乙酸354 mL、丙酸261 mL、异丁酸124 mL、丁酸153 mL、异戊酸85 mL或戊酸89 mL,对照组以盐酸调控pH。发酵结束时,发酵液中没有或只有少量的短链脂肪酸检测到,表明本研究中所有测试的短链脂肪酸均可被高山被孢霉充分利用。发酵结束后的生物量、总葡萄糖消耗量、总酸消耗量和碳转化率如表1所示。
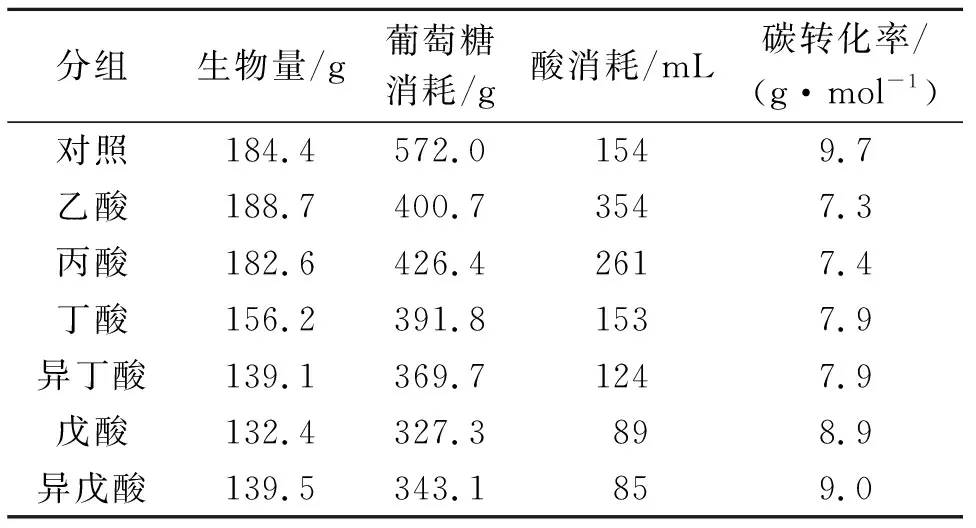
表1 短链脂肪酸对生物量、葡萄糖消耗、酸消耗和 碳转化率的影响(总体积为3.5 L)
注:碳的总摩尔数是葡萄糖消耗中的碳摩尔数与酸消耗中的碳摩尔数之和。
添加短链脂肪酸时,总葡萄糖消耗量相应减少,同时,每mol碳到生物质的转化率也因添加短链脂肪酸的不同而发生变化:加入乙酸和丙酸时,细胞内油脂含量增加使碳转化率从9.7 g/mol降低到约7.3 g/mol,加入丁酸、戊酸后,被孢霉油脂积累受到抑制,碳转化率逐渐恢复至9.0 g/mol。
向发酵体系中流加入各种短链脂肪酸时,乙酸和丙酸不影响被孢霉的正常生长,总生物量分别达到53.9 g/L和52.2 g/L,与对照组相仿。但随着碳链长度的增加,短链脂肪酸的毒性逐渐增加,被孢霉的生长逐步受到影响,生物量减少,向培养基中加入戊酸时,被孢霉生物量只有37.8 g/L,仅为对照组的75.6%,如图1(a)所示;短链脂肪酸也对高山被孢霉脂质的蓄积产生了显著的影响,如图1(b)所示。发酵3 d后,对照组、乙酸组和丙酸组细胞进入脂质快速蓄积时期,其他实验组的脂质蓄积受到了抑制,蓄积速率显著低于前三者。发酵结束时,乙酸组和丙酸组的脂质质量分别为细胞干质量的46.8%和40.8%,高于对照组的37.4%,这是由于体系中的乙酸和丙酸不仅可以作为被孢霉生长的碳源,也可以直接为细胞中脂肪酸合成提供底物,从而促进细胞脂质的积累[11-12];丁酸和戊酸组的脂质含量显著降低,其中戊酸处理组中脂质质量分数仅为25.5%。实验结果表明:随着短链脂肪酸中碳链的增长,被孢霉细胞脂质的积累受到明显抑制并急剧减少。
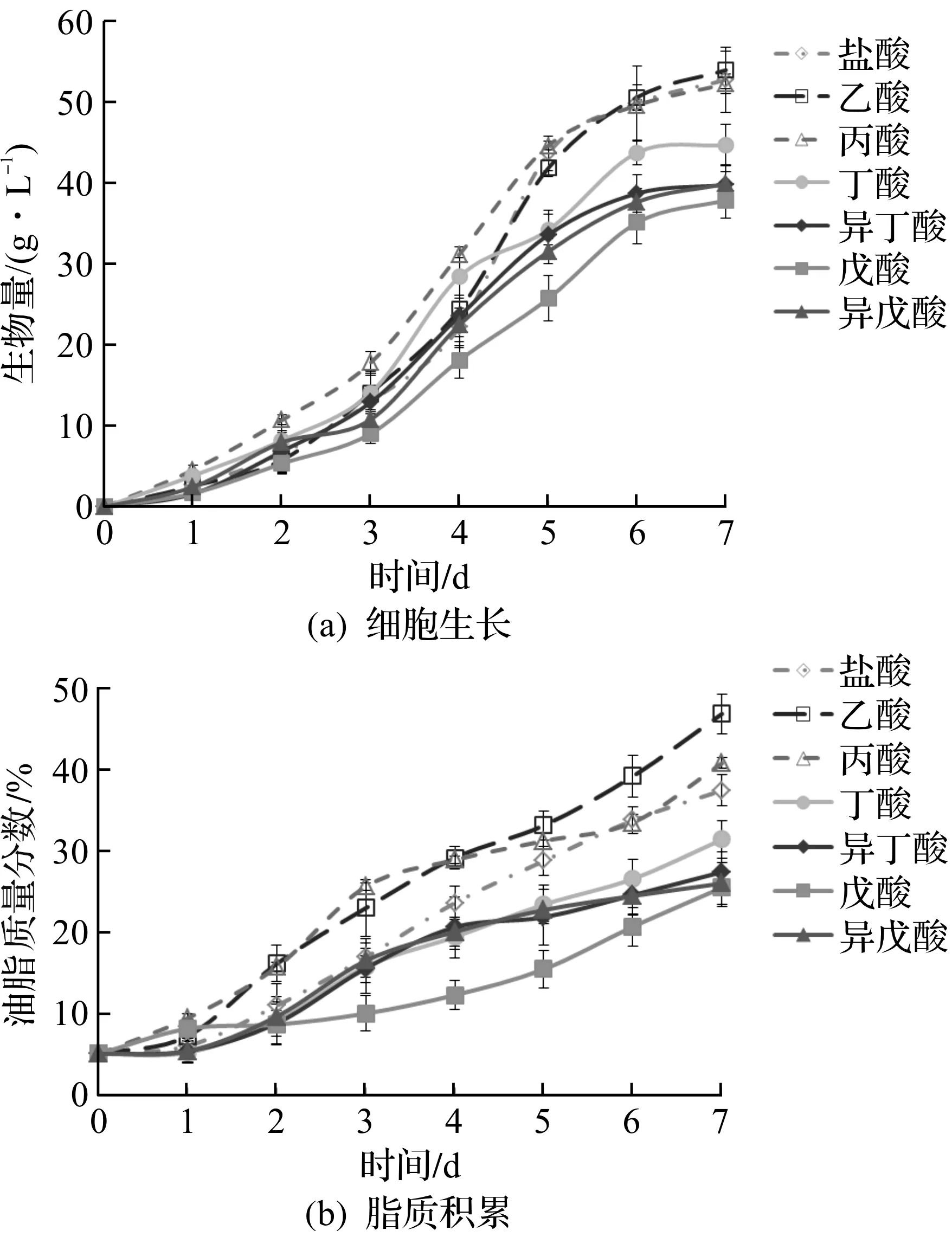
图1 短链脂肪酸对高山被孢霉发酵过程中细胞生长 和脂质积累的影响Fig.1 Effects of short chain fatty acids on cell growth and lipid accumulation during fermentation of Mortierella alpina
已有研究结果证实苹果酸酶是脂质生物合成中为脂肪酸合酶提供NADPH的关键酶,其他NADPH产生酶,例如NADP+依赖性异柠檬酸脱氢酶、葡萄糖6-磷酸脱氢酶和6-磷酸葡糖酸脱氢酶仅对脂质积累过程中NADPH的供应起轻微作用[13-14]。为了表征本研究中NADPH的生成,笔者检测了所有实验组中苹果酸酶的活性,结果如图2所示。
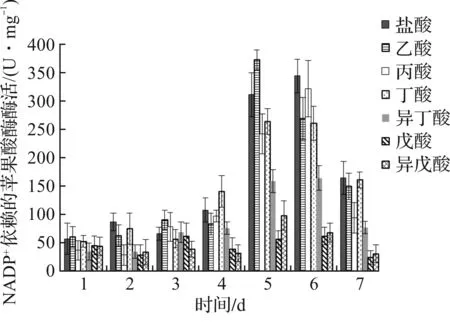
图2 短链脂肪酸对被孢霉中苹果酸酶活性的影响Fig.2 The effect of short chain fatty acids on the activity of malic acid enzyme in Mortierella sp.
由图2可知:除了戊酸和异戊酸处理组外,其他组中的苹果酸酶活性均具有相似的变化趋势,在早期脂质积累阶段(发酵前3 d),脂质积累很慢,所有ME活性均低于110 U/mg;随后,在脂质快速合成阶段(4~6 d),ME活性迅速增加到250 U/mg以上,促使细胞中大量脂质积聚;在整个发酵过程中,戊酸处理组的ME活性均低于70 U/mg,表明NADPH供应不足,最终导致脂质在细胞中的积累很少。
2.2 短链脂肪酸对被孢霉脂肪酸组成的影响
添加短链脂肪酸使高山被孢霉的脂肪酸组成产生了显著变化。发酵过程中高山被孢霉脂肪酸的主要变化如图3所示,发酵结束时各组菌株的脂肪酸组成如表2所示。
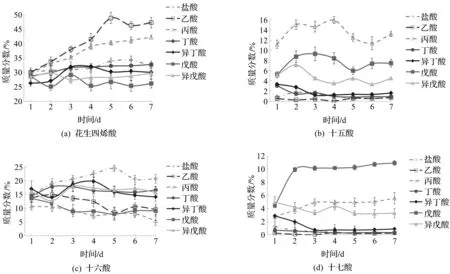
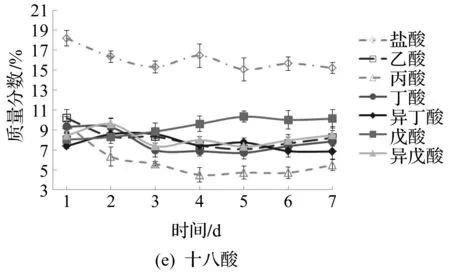
图3 发酵过程中被孢霉脂肪酸组成的主要变化Fig.3 Major changes in fatty acid composition of Mortierella during fermentation
表2 发酵结束后各实验组高山被孢霉的脂肪酸组成
Table 2 Fatty acid composition ofMortierellaalpinain each experimental group after fermentation
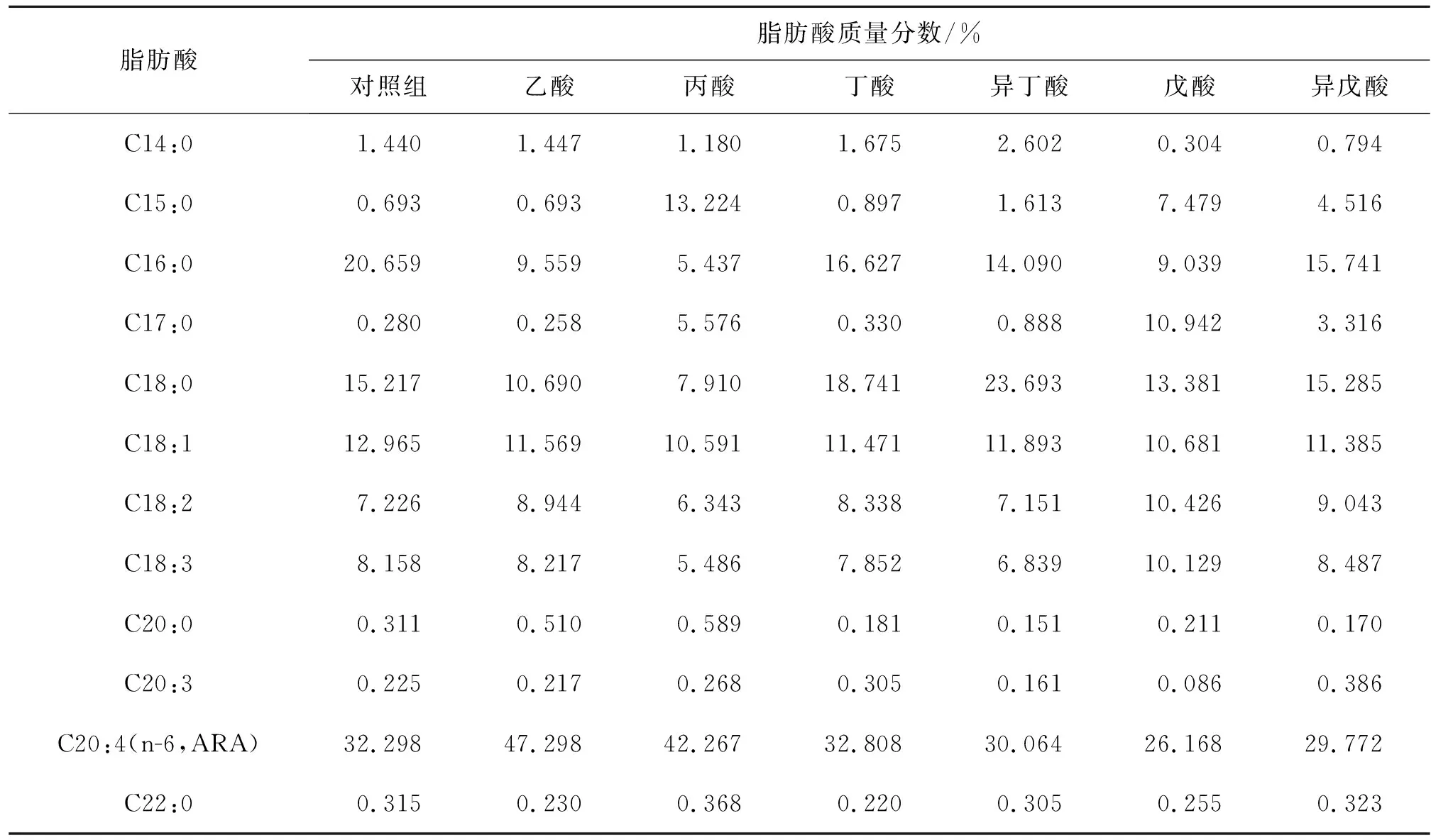
脂肪酸脂肪酸质量分数/%对照组乙酸丙酸丁酸异丁酸戊酸异戊酸C14:01.4401.4471.1801.6752.6020.3040.794C15:00.6930.69313.2240.8971.6137.4794.516C16:020.6599.5595.43716.62714.0909.03915.741C17:00.2800.2585.5760.3300.88810.9423.316C18:015.21710.6907.91018.74123.69313.38115.285C18:112.96511.56910.59111.47111.89310.68111.385C18:27.2268.9446.3438.3387.15110.4269.043C18:38.1588.2175.4867.8526.83910.1298.487C20:00.3110.5100.5890.1810.1510.2110.170C20:30.2250.2170.2680.3050.1610.0860.386C20:4(n-6,ARA)32.29847.29842.26732.80830.06426.16829.772C22:00.3150.2300.3680.2200.3050.2550.323
由图3可知:当添加的脂肪酸碳链长度较短时(如乙酸、丙酸),细胞中可用于脂肪酸合成的还原力NADPH大量增加,促使脂肪酸合成向末端进行,细胞中花生四烯酸(ARA)质量分数显著上升,分别达到总脂肪酸质量的47.3%和42.2%。
当将奇碳链脂肪酸(丙酸、戊酸)加入培养基中时,脂肪酸组成发生了巨大变化。补充丙酸后,细胞脂肪酸中奇数链脂肪酸(十五酸、C15:0、十七酸、C17:0)的质量分数急剧增加,尤其是十五碳酸,可以达到总脂肪酸质量的13%以上。此现象可能是由于被孢霉细胞将丙酸转化为丙酰辅酶A并随后被脂肪酸合酶利用所致[15-16]。在戊酸处理组中,十七酸的质量分数也显著高于其他组,达到10%左右。
此外,笔者还检测了戊酸处理对被孢霉脂质积累影响过程的冲击可逆性。实验在发酵3 d时停止添加戊酸,改用流加HCl控制pH,结果如图4(a,b)所示。
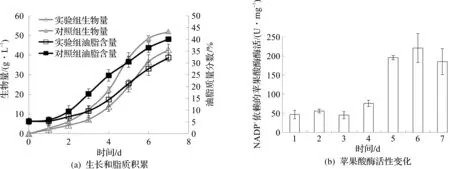
图4 戊酸对被孢霉发酵过程中脂质积累和苹果酶活性的可逆影响Fig.4 Reversible effects of valeric acid on lipid accumulation and malic enzyme activity during fermentation of Mortierella
由图4可知:消除戊酸压力后,ME活性迅速增加至220.94 U/mg,4 d时被孢霉脂质质量分数仅为14.42%,到发酵结束时脂质质量分数提升32%,说明去除戊酸胁迫后,被孢霉细胞活性得以恢复,ME活性的增加迅速增强了脂质蓄积。
3 结 论
乙酸和丙酸不影响被孢霉的生长和脂质积累,添加乙酸时生物量和油脂质量分数最高分别可达到53.9 g/L和46.8%。随着碳链长度的增加,短链脂肪酸的毒性逐渐增加,被孢霉的生长逐步受到影响,导致油脂积累减少;酶活分析结果证实苹果酸酶的活性与细胞中脂质的积累量呈正相关关系,当把奇碳链脂肪酸(丙酸、戊酸)加入培养基中时,细胞中奇数链脂肪酸(十五酸和十七酸)质量分数显著提升,最高可以达到总脂肪酸质量的10%以上;此外,研究还证明了山被孢霉的影响是可逆的,移除胁迫后细胞生长可以恢复。

