过表达热激蛋白提高酿酒酵母的耐高温高乙醇性能
陈胜杰,高 翔,袁戎宇
(广东怡和科洁科技有限公司,广东 佛山 528000)
酵母作为最常见的单核真菌,在人类历史上起到了举足轻重的作用。在很早以前,人们就懂得利用酵母酿果酒、发酵面包等[1]。近年来,随着人们生活水平的不断提高,啤酒饮料的消费热度居高不下,其中的发酵菌主力就是酿酒酵母[2]。为了满足大众的需求和口味,科研工作者们一直致力于研发更高效稳定的工程菌,例如能耐高温、耐高乙醇的酿酒酵母就是科学家一直努力的方向[3]。笔者致力于通过分子生物学基因改造手段,对出发菌株有目的地加强热休克蛋白的表达,通过整合质粒过表达的形式,对sym1和hsp104两个基因过表达,观察改造菌的高温高乙醇的生物学性状,并通过代谢流量分析等手段,评判其改造效果,为以后的研究提供参考。
sym1来自酿酒酵母S288C(S.cerevisiaeS288C),是编码酿酒酵母热休克蛋白的关键基因,在热休克期间,sym1基因具有耐高温和耐乙醇的抗性,其功能和压力诱导的酵母MPV17功能相似[4]。hsp104基因来自马克思克鲁维酵母DMKU3-1042,也是编码热休克蛋白的关键基因,能够在高温(37~45 ℃)高乙醇胁迫下发挥作用,抑制细胞裂解死亡,提高细胞存活率[5]。Sales等[6]利用缺失突变体实验已经证实了Hsp104p可以直接影响酿酒酵母的乙醇耐性;Sanchez等[5]测试了hsp104突变体的乙醇耐受性与亲本菌株的差别,研究结果证明热诱导后,亲本菌株可耐受20%的乙醇质量分数,而突变株则不能承受该乙醇质量分数。
1 材料与方法
1.1 材 料
试剂盒:均购自北京博迈德科技发展公司;质粒:酵母过表达质粒-YCplac33,遗传标记为Ampr,URA3,购自金唯智生物科技有限公司;出发菌株:酿酒酵母S.cerevisiaeYH,来自笔者公司菌种保藏库。引物见表1。
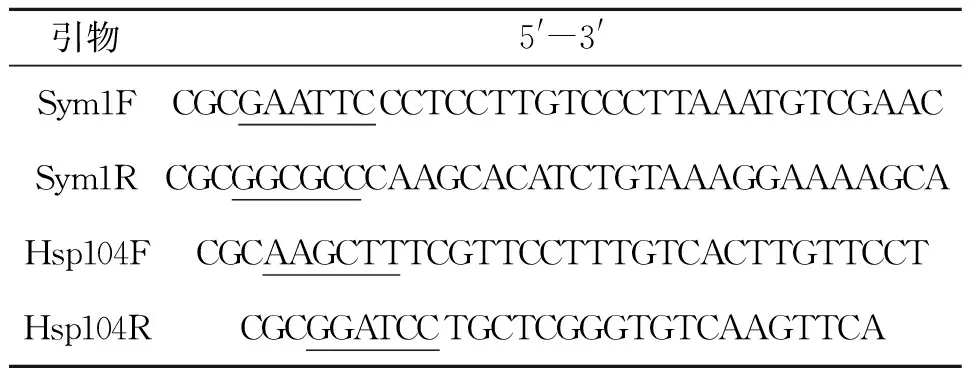
表1 引物设计列表Table 1 Primer design list
注:带下划线的斜体部分碱基序列为对应的酶切位点序列。
实验设备:电击转化仪,德国eppendorf公司;MiniSpin高速离心机,德国eppendorf公司;电泳仪(DYY-6C),北京六一仪器厂;数码凝胶图像处理系统,上海天能凝胶成像系统公司;PCR仪,德国eppendorf公司。
1.2 方 法
1.2.1 菌株S.cerevisiaeYH+的构建
1) 构建过表达质粒YCplac33-sym1
根据酵母染色体上基因Sym1上下游序列进行引物设计。以S.cerevisiaeS288C染色体DNA为模板,分别以Sym1F和Sym1R两对引物作为下游引物。按照体系添加到扩增管中进行PCR扩增,所得的PCR产物长度为979 bp(为保证片段的完整性,实际片段长594 bp,对其上下游均延长200 bp设计引物),PCR扩增体系见表2。PCR扩增程序如下:95 ℃预变性5 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸2 min;重复第2~4步骤,循环25次;72 ℃延伸10 min;-20 ℃保藏。

表2 PCR扩增体系Table 2 PCR amplification system
用EcoRⅠ和KasⅠ分别对克隆基因Sym1的PCR产物和质粒YCplac33载体进行双酶切消化,然后分别将目的基因片段进行回收纯化,将外源PCR产物和质粒载体按适当比例进行连接,然后挑选转化子进行双酶切验证得到正确的克隆[7]。双酶切连接sym1体系见表3。

表3 双酶切连接sym1体系Table 3 Double enzyme cleavage linkage system of gene sym1
2) 过表达质粒YCplac33-sym1-hsp104
根据马克思克鲁维酵母DMKU3-1042(KluyveromycesmarxianusDMKU3-1042,记作K.marmianusD3)染色体上基因hsp104的上下游序列进行引物设计。以K.marmianusD3染色体DNA为模板,分别以Hsp104F和Hsp104R作为基因的扩增引物,按照PCR体系添加到扩增管中进行PCR扩增。所得的PCR产物长度为2 933 bp(为保证片段的完整性,实际片段长2 727 bp,对其上下游均延长200 bp设计引物)。然后双酶切连接hsp104基因,对应的双酶切位点是Hind Ⅲ、BamHⅠ。采用与sym1类似的办法,将hsp104基因连接到质粒YCplac33载体上,具体的酶切体系见表4。构建得到过表达质粒YCplac33-sym1-hsp104(记作:Y Cplac33-SH)。

表4 双酶切连接hsp104体系Table 4 Double Enzyme cleavage linkage system of gene hsp104
3) 构建含表达质粒YCplac33-SH的菌株S.cerevisiaeYH+。
将构建成功的质粒YCplac33-SH,电转化入S.cerevisiaeYH的感受态细胞中,然后挑选转化子进行PCR验证,得到正确的阳性转化子。斜面富集培养后,用无菌水冲刷,并与体积分数为30%的无菌甘油溶液1∶1混合于保菌管中,-20 ℃保藏备用[8],改造菌株记作S.cerevisiaeYH+。
1.2.2 高温高乙醇胁迫验证实验
将改造菌置于不同温度和不同乙醇质量分数梯度胁迫下进行测试[9]。其中,温度梯度实验在10%乙醇质量分数下进行,乙醇质量分数梯度实验在32 ℃下进行。最后选取适当的温度条件(接近50%存活率),进行乙醇质量分数梯度存活率实验。
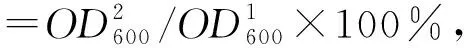
1.2.3 利用代谢网路分析验证改造菌的代谢通路变化
代谢通量分析主要采用化学计量网络分析提供可平衡及可计算的代谢反应,确定细胞内各代谢物的通量分布。笔者以Nissen等[10]代谢模型为标准,参考曹利民[4]拟稳态方程组,S×r=0。其中S为化学计量系数矩阵,r是37个变量的向量,在拟稳态下该模型有27个化合物处于平衡态,所以该模型的自由度为10。通过测定工程菌株和出发菌株分批发酵过程中相关实验数据,计算在对数生长期14~15 h各菌株达到的最大比生长速率,计算并比较改造菌和出发菌株在发酵前后的通量分布差异,用来考察基因修饰策略是否正确。
2 实验结果
2.1 菌株S.cerevisiae YH+构建过程中的相关电泳图及生长曲线
S.cerevisiaeYH+菌株阳性转化子双酶切验证PCR电泳图如图1所示。其中,图(a)为过表达质粒YCplac33-sym1的EcoR Ⅰ、KasⅠ双酶切电泳图(1 140 bp和5 442 bp,质粒大小6 582 bp);图(b)为过表达+质粒Y Cplac33-SH的Hind Ⅲ、BamH Ⅰ双酶切电泳图(2 963 bp和6 552 bp,质粒大小9 515 bp)。
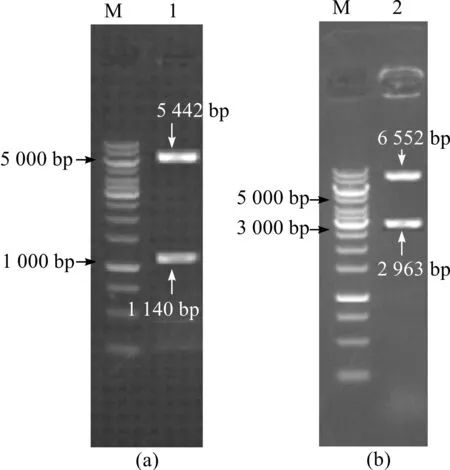
M—marker;1—双酶切后线性质粒和sym1基因;2—双酶切后线性质粒和hsp104基因。图1 S.cerevisiae YH+菌株阳性转化子双酶切验证PCR电泳图Fig.1 PCR electrophoresis strip of S.cerevisiae YH+positive transmutator double enzyme digestion
从双酶切PCR电泳条带可以看出:质粒Y Cplac33-SH已成功转入菌株S.cerevisiaeYH体内,得到改造菌S.cerevisiaeYH+。
测定改造菌株S.cerevisiaeYH+的生长曲线:于37 ℃,200 r/min,250 mL摇瓶装液量30 mL培养,每4 h取样一次,共培养36 h,测其OD600值,并绘制生长曲线,结果如图2所示。
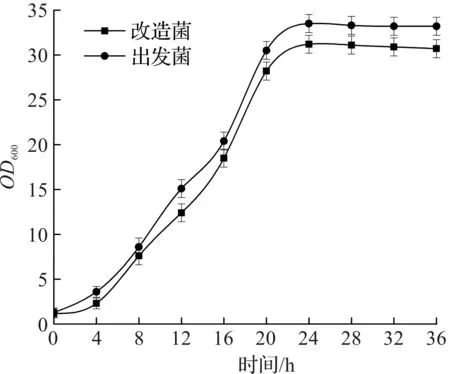
图2 改造菌与出发菌的生长曲线对比Fig.2 Comparison of growth curve of modified bacteria and original bacteria
由图2可知:改造菌的生长趋势与出发菌大致相同,菌株生长的对数期在8~20 h,OD600最高值为31.7,较出发菌(33.6)有轻微下降,分析原因,可能是质粒导入后,增加了菌株的生长压力[11]。
2.2 菌株S.cerevisiae YH+的高温高乙醇胁迫实验
为了检验改造菌的耐高温高乙醇能力,在不同发酵温度梯度和发酵液中不同的乙醇质量分数梯度条件下,对改造菌进行冲击测试,考察菌细胞存活率。其中,温度梯度实验在10%乙醇质量分数条件下进行,乙醇质量分数梯度实验在32 ℃下进行。最后在接近50%存活率的温度下,进行乙醇质量分数梯度存活率实验。具体的压力胁迫梯度见表6,具体结果如图3,4所示。
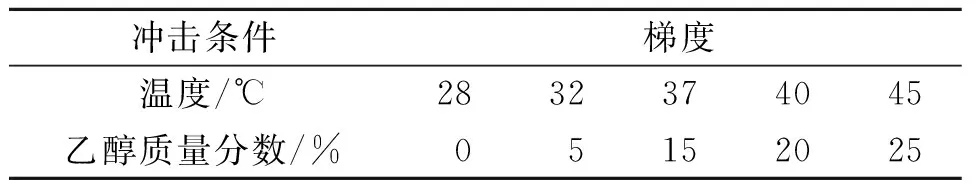
表6 胁迫条件梯度表Table 6 Pressure stress ladder
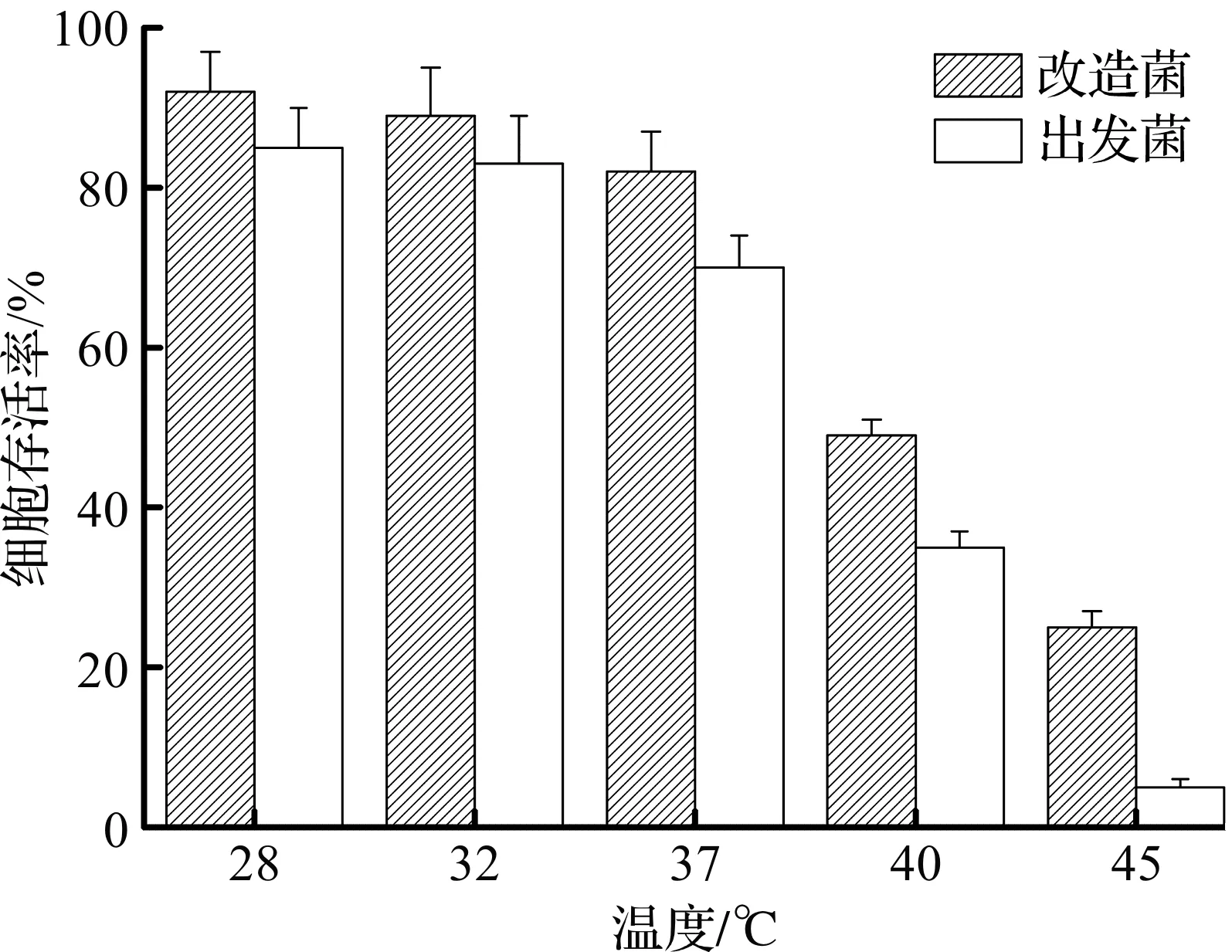
图3 10%乙醇质量分数下,不同温度对菌株存活率的影响Fig.3 Influences of different temperature on the survival rate of strains under 10% ethanol
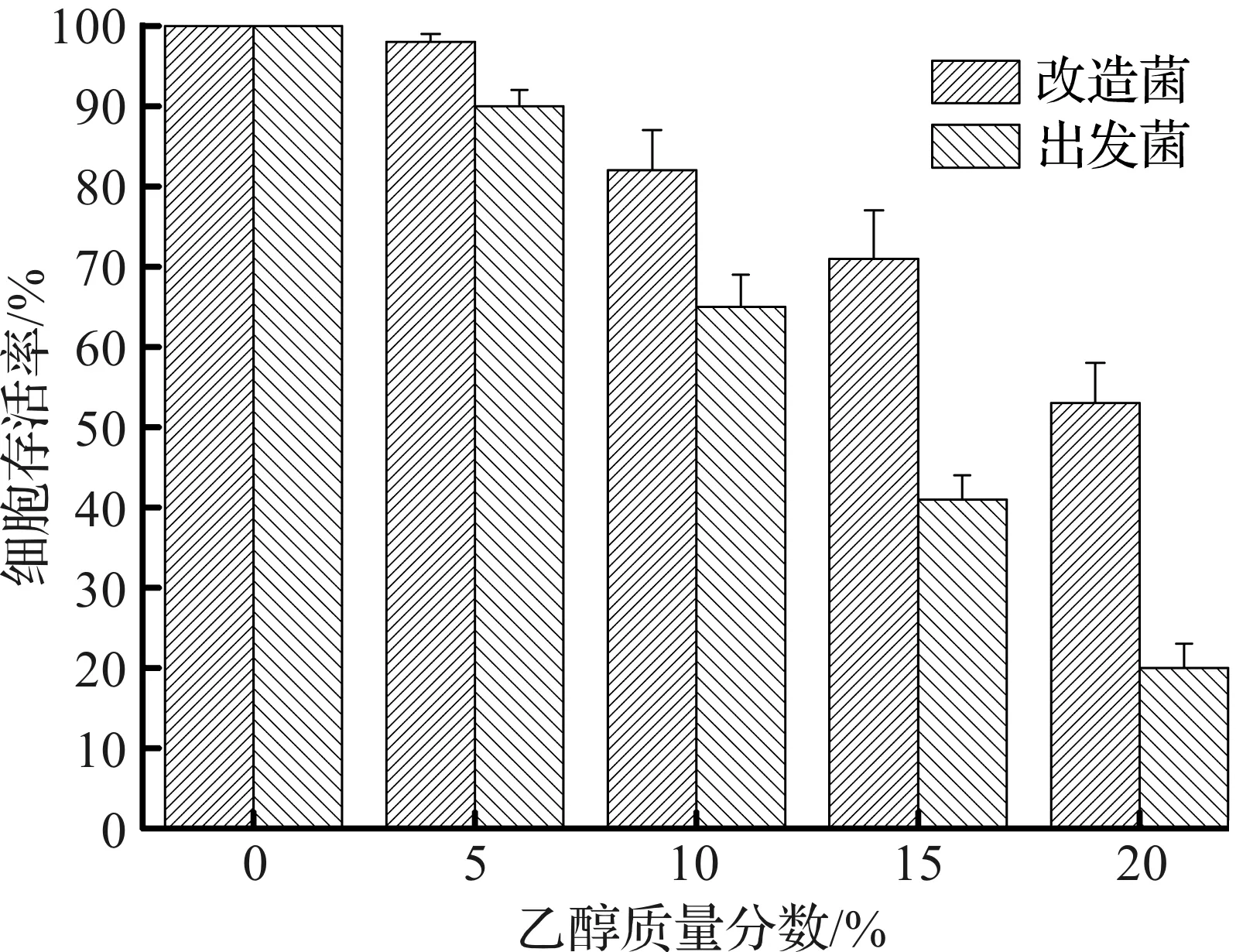
图4 32 ℃下不同乙醇质量分数对菌株存活率的影响Fig.4 Influences of different ethanol concentrations on the survival rate of strains under 32 ℃
由图3可知:在10%乙醇质量分数下培养10 h,改造菌在常温28,32 ℃时,菌株存活率比出发菌略高,分别为92.7%和89.1%,比出发菌分别高出7.2%和5.9%,但相差不明显。而在温度进一步升高后,即40 ℃和45 ℃时,改造菌的抗高温能力得到了较好的体现,其细胞存活率相比出发菌优势愈发明显,具体表现为在40 ℃时,改造菌的细胞存活率为51.3%,明显高于出发菌的36.7%,这一情况在45 ℃时更加明显,但由于改造菌本身的存活率也只有31.2%左右,故笔者在10%乙醇质量分数条件下,选择较理想的高温为40 ℃。
由图4可知:当在32 ℃下培养10 h,小于10%的发酵液乙醇质量分数对菌体的存活率影响较小,改造菌的存活率在0%和5%乙醇质量分数时分别为99.5%和96.7%,与出发菌差别不大(同条件下为99.2%和91.5%),但当进一步提升乙醇质量分数后,其影响较大。尤其在20%乙醇质量分数时,改造菌的菌体存活率降低最多,为53.2%,但相比出发菌(24.8%)仍有很大的提高。
为了进一步研究改造菌在高温高乙醇下的耐受能力,笔者选择在40 ℃(存活率高于50%)培养温度下,依次改变乙醇质量分数,观察菌株的生长性状和菌体存活率,结果如图5所示。
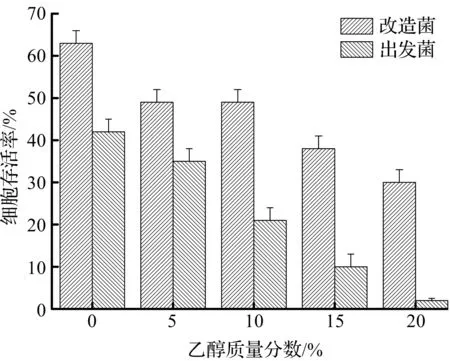
图5 40 ℃下不同乙醇质量分数 对菌株存活率的影响Fig.5 Influences of different ethanol concentrations on the survival rate of strains under 40 ℃
由图5可知:40 ℃下培养时,即使在0%的乙醇质量分数下,改造菌和出发菌的存活率均有较大的下降,分别为62.8%和43.1%,可见温度对菌体的生理影响较为显著。当温度联合乙醇压力共同作用菌体时,其破坏影响更为显著,在20%乙醇质量分数下,这一对比最为明显,改造菌和出发菌的菌体存活率分别为31.2%和2.1%,可以看出出发菌在高温高乙醇的连续冲击下,菌株存活率仅为2.1%,接近于0;而改造菌虽然已有较大的菌株死亡,但其菌株存活率仍维持在30%以上,其抗高温高压性能提升幅度明显。
2.3 菌株S.cerevisiae YH+的代谢流量分析

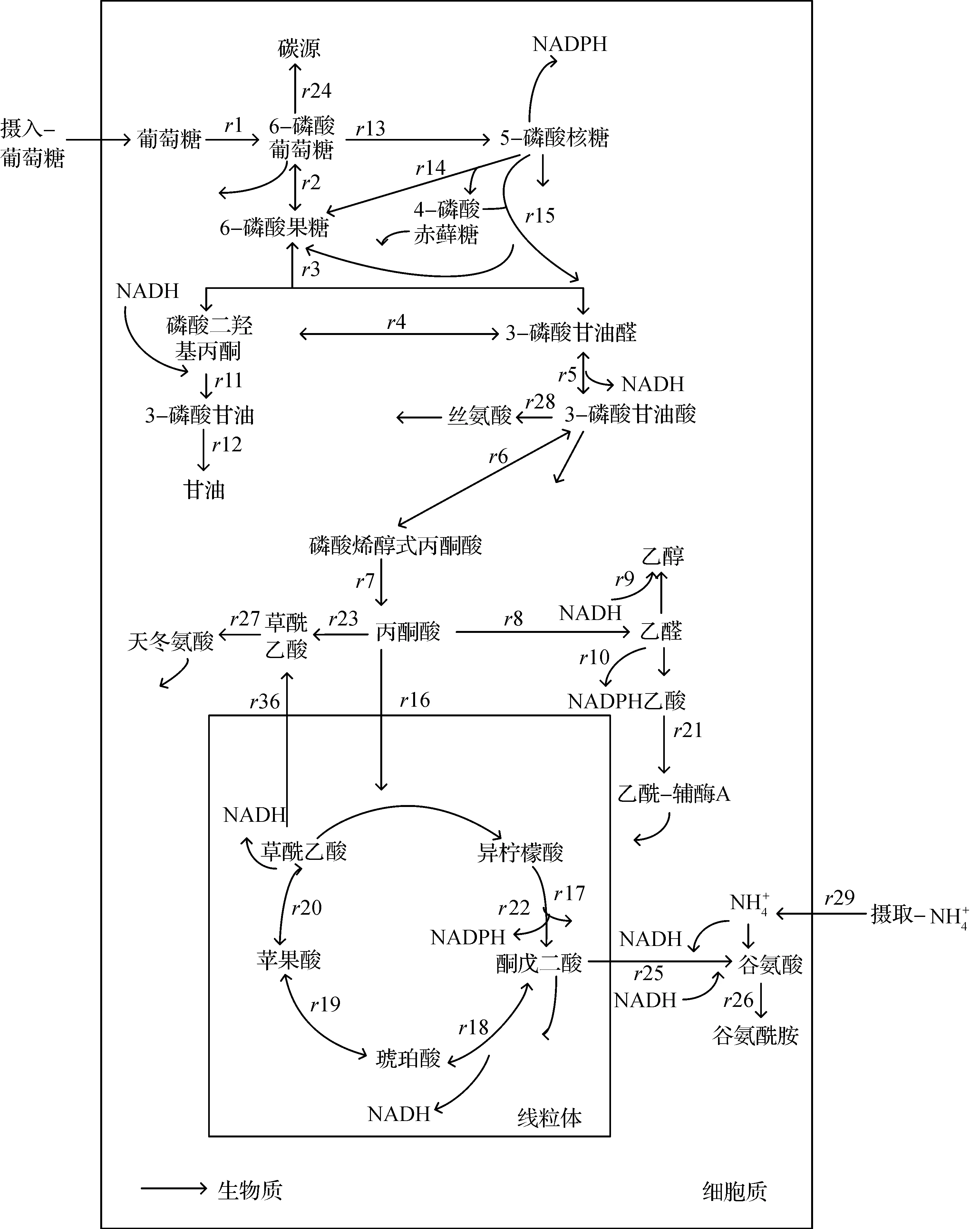
图6 酿酒酵母代谢网络图Fig.6 The map of metabolic network of S.cerevisiae
通过代谢通量数据分析,得到出发菌和改造菌的代谢流分布数据表,结果如表7所示。
由表7可知:在14~15 h内,改造菌株S.cerevisiaeYH+及对照菌株糖酵解途径的通量r2均显著大于磷酸戊糖途径的通量r13,说明糖酵解依然是葡萄糖中心碳代谢的主要途径;过表达基因sym1(类mpv17蛋白基因)和hsp104两个热休克家族蛋白关键基因,能强化r7、r8和r9的代谢流,并减少r10和r16代谢流,从而使碳代谢流向合成乙醇方向增加,增加合成乙醇的通量。
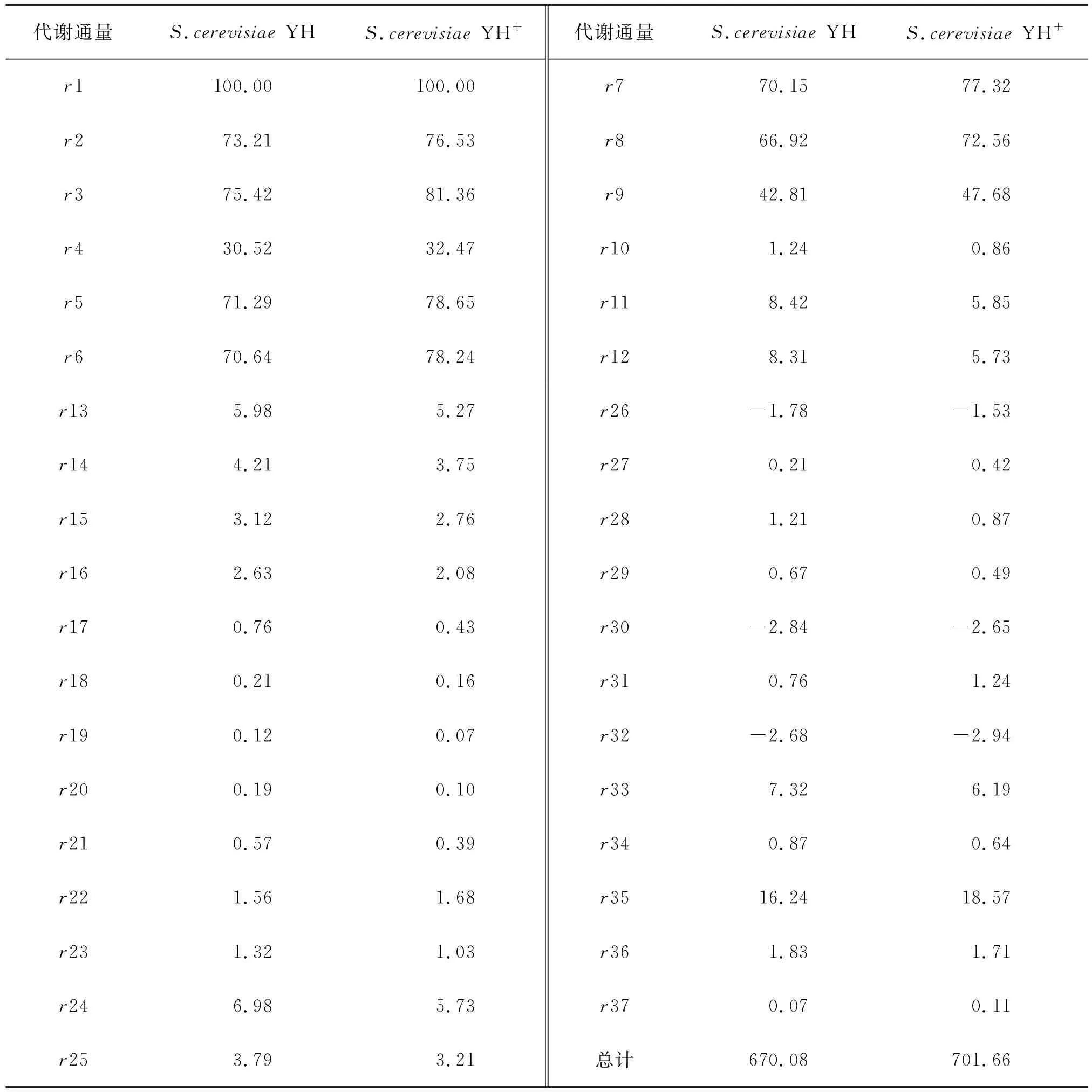
表7 改造菌与出发菌的代谢通量数据Table 7 Metabolic flux of modified bacteria and original bacteria
3 讨 论
过表达基因sym1和hsp104,均为热休克家族蛋白的关键基因,其单独缺失均可增加细胞膜的通透性,并提高触发高温防御机制的敏感度[12-13]。研究表明:乙醇还会损伤细胞内的线粒体,从而诱导细胞内的活性氧的产生,导致细胞产生氧化损伤,过表达热激蛋白关键基因,可有效提高菌体的抗氧化能力,从而提高菌体的抗高质量分数乙醇毒害能力,使细胞存活率在高温高乙醇环境下保持理想水平[14-16];改造菌可能在增加乙醇合成通量的过程中,为了维持菌体内部的代谢稳态,触发了耐乙醇毒害因子(具体的物质需要后续通过实时的气质联用检测系统对其液态与气态发酵成分进行检测确定)的合成与反馈调节[17];据刘月芹[18]文献报道,耐高温高乙醇能力强的菌株,具有有较好的细胞壁完整性、较高的海藻糖积累量、较强的抗氧化性、乙醇耐受性和能量代谢等特点。
通过代谢流量分析,过表达基因sym1(类mpv17蛋白基因)和hsp104两个热休克家族蛋白关键基因,可以增加合成乙醇的关键途径r7,r8和r9的反应,并抑制消耗合成乙醇前提物Pyr(丙酮酸)和Aca(乙醛)的r10和r16的反应,从而增加乙醇的合成量。其中,r7为PEP(磷酸烯醇式丙酮酸)到Pyr(丙酮酸)途径,r8为Pyr(丙酮酸)到Aca(乙醛)途径,r9为Aca(乙醛)到Eth(乙醇)途径;r10为Aca(乙醛)到NADPH途径,r16为Pyr(丙酮酸)到乙酰辅酶A,进入三羧酸循环的途径。整体上刺激碳代谢流向合成乙醇方向增加,增加合成乙醇的通量。
4 结 论
采用分子生物学和代谢网络分析等手段,优化整合酿酒酵母的代谢网络,通过过表达关键基因sym1和hsp104,强化热休克蛋白的表达,使出发菌酿酒酵母的耐乙醇能力显著提升,最终使改造菌在乙醇质量分数20%,40 ℃发酵温度的条件下,能够保持接近35%的细胞存活率,在同等条件下,出发菌株的存活率仅为2.1%。本研究将为后续的耐乙醇酿酒酵母工程菌的开发提供参考价值,但是仍存在一些不足之处,比如未能将质粒过表达的形式转化为染色体基因组整合,这样会使改造菌性能更稳定,另外对基因sym1和hsp104的强化表达与增加改造菌抗高温高艺纯的能力之间的深层机理未做过多探究,这些都需要在后续的实验工作中着重探讨。

