茶黄素双没食子酸酯的功能活性研究进展
严佳丹,冯思敏
(浙江工业大学 食品科学与工程学院,浙江 杭州 310014)
茶黄素呈橙色或桔红色,具有苯骈卓酚酮结构,是茶叶中的儿茶素类化合物在发酵加工过程中在多酚氧化酶的氧化作用下,氧化聚合形成的抗氧化剂多酚化合物。随着发酵期的延长,它们的数量会不断减少,茶黄素水平与红茶品质呈正相关[1-2]。红茶中含有4个主要茶黄素:茶黄素(TF1)、茶黄素-3-没食子酸酯(TF2A)、茶黄素-3′-没食子酸酯(TF2B)和茶黄素双没食子酸酯(TF3)。此外还有许多茶黄素衍生物,包括茶黄素酸和茶碱[3-5]。虽然茶黄素仅占冲泡红茶固体干重的2%~6%[6-7],但其对茶的颜色[8]、口感[9]和茶膏形成程度有很大的贡献[10]。TF3含有2个没食子酸基团,没食子酸基团是某些物质具有生理活性的必要条件[11-13],这可能是TF3具有较其他茶黄素成分更强的生物活性的原因。
1 茶黄素的结构与性质
红茶中的黄酮类化合物中约30%为儿茶素,50%为茶红素,10%为茶黄素[14]。在内源多酚氧化酶和过氧化物酶的催化作用下,茶叶中的儿茶素极易与氧气反应被氧化成邻醌,邻醌会发生聚合反应,形成的中间产物联苯酚醌类具有不稳定性,极易进行自身歧化作用,一部分被还原形成黄烷醇,另一部分被氧化缩合形成茶黄素[15],产生4种主要茶黄素:茶黄素、茶黄素-3-没食子酸酯、茶黄-3′-没食子酸酯和茶黄素双没食子酸酯,它们的化学结构为
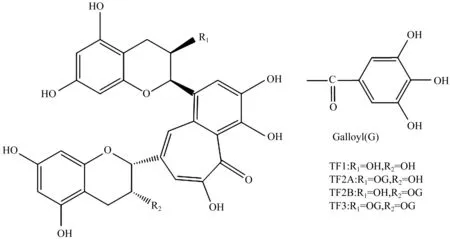
Collier[3]对茶黄素的红外光谱研究表明所有茶黄素的最大吸收峰都出现在380 nm和460 nm。茶黄素是橙黄色结晶状粉末,熔点237~240 ℃,易溶于热水、乙醇、丙酮、异丁基甲酮、正丁醇和醋酸乙酯[16]。茶黄素在碱性条件下不稳定,在酸性条件下稳定,在碱性条件下,茶黄素可促进茶萘醌的形成[17]。茶黄素双没食子酸酯(TF3)是由表儿茶素没食子酸酯(ECG)和(-)-表没食子儿茶素-3-没食子酸酯(EGCG)的多聚反应形成[18]。
2 体内代谢
2.1 体内吸收机制
茶黄素的血浆半衰期约为1~3 h,与儿茶素半衰期相似或略短[19]。健康人体体外粪便培养和进食研究获得的数据表明茶黄素及其没食子酸基衍生物在上消化道或下消化道中均未检测到吸收量[20]。事实上,口服茶黄素的生物利用度非常低。即使人类志愿者口服非常高剂量的茶黄素后(700 mg,相当于30杯红茶),血浆和尿液的峰值水平也仅仅分别为1.0 μg/L和4.2 μg/L[21]。Takeda等[22]通过液相色谱飞行时间质谱法检测到茶黄素在人类肠道细胞Caco-2细胞单层中没有显著的转运,因此可以考虑将茶黄素划分到不易吸收的多酚中。基于这些前人已有成果,笔者预计一杯茶中的茶黄素大部分仍保留在胃肠道的管腔中。
2.2 体内代谢机制
Chen等[23]用液相色谱-串联质谱法测定TF3在雌性C57BL/6J大鼠粪便中的代谢产物。结果发现TF3在大鼠体内可广泛代谢,主要的代谢产物有4种,分别是TF1、TF2A、TF2B和没食子酸,这些代谢产物最有可能是由肠道菌群产生的。葡萄糖醛酸化和硫酸化是TF3的次要生物酶形成途径。为了验证微生物群是红茶茶黄素代谢产物产生的必要条件,随后Chen等[24]做了另一个试验,用200 mg/kg的TF3灌胃特异性无病原体(SPF)小鼠和无菌(GF)小鼠,并确定TF1、TF2A、TF2B和没食子酸是SPF小鼠TF3的主要粪便代谢物。这些代谢物在TF3灌胃GF小鼠中不存在。利用从3名健康人类身上采集的粪便泥浆,在体外研究了TF3,TF2A和TF2B的微生物转化。研究结果表明:TF3被人类微生物群代谢为TF1、TF2A、TF2B、没食子酸和邻苯三酚。此外,TF2A和TF2B都被人体微生物代谢为TF1、没食子酸和邻苯三酚。
3 TF3的功能活性
3.1 抗氧化性
Shiraki等[25]报道茶黄素的没食子酸部分可能对它们有效的抗氧化活性至关重要;Jhoo等[17]提出了通过单电子氧化形成茶黄素和邻苯二酚醌的自由基氧化机理,表明茶黄素的苯并三酚酮部分在为优选的氧化位点提供抗氧化剂保护中起重要作用,由于存在共振形式,苯并三酚酮部分可能负责电子的提供;Jovanovic等[26]报道没食子酸酯化茶黄素比没有没食子酸酯化的茶黄素具有更低的超氧化物清除活性,提出没食子酸部分可以防止茶黄素中自由基和苯并对苯二酚酮部分之间的反应。
3.1.1 抑制自由基的产生
1,1-二苯基-2-三硝基苯肼(DPPH)是一种稳定的自由基,广泛应用于样品的抗氧化能力测定,羟基自由基会造成体内脂质过氧化而破坏细胞,因此样品对DPPH自由基和羟基自由基的清除能力可以反映样品的抗氧化能力[27]。Yang等[28]研究茶叶内活性物质后,发现TF3对羟基自由基和DPPH自由基的抑制作用最强,TF1抑制作用相对最弱,茶黄素在保护人胚肺成纤维细胞HPF-1细胞免受H2O2介导的损伤方面比EGCG更为有效。
3.1.2 抑制ROS的生成
H2O2通过产生活性氧ROS(如超氧和羟基自由基),诱导神经元凋亡。ROS氧化损伤在皮肤衰老、癌变和炎症过程中起着重要作用,并且它可以通过细胞氧化应激反应诱导细胞凋亡甚至导致其坏死。氧化应激是关键的机制和关键的调节剂生化变化涉及激活凋亡过程和发病机制的神经退行性疾病。Zhang等[29]研究发现TF3可以有效抑制由H2O2诱导的氧化应激导致的细胞内ROS的生成,是茶色素中抗氧化能力最强的成分,Chauhan等[30]研究发现用甲基汞处理后的细胞,可能导致ROS水平的增加,而高浓度的TF3可干扰ROS信号,从而减少甲基汞对细胞的影响。
3.2 抗肿瘤性
TF3抗肿瘤的作用机理见表1。

表1 TF3抗肿瘤的作用机理Table 1 Antitumor mechanisms of TF3
由表1可知:TF3可以通过抑制生长因子受体、抗肿瘤血管形成以及促进癌细胞凋亡等多种方式来治疗癌症。
3.2.1 抑制生长因子受体
表皮生长因子(EGF)和表皮生长因子受体(EGFR)家族的功能激活是多数人上皮癌的特征,EGFR是癌症治疗靶点的生长因子受体。EGFR通过自磷酸化触发一系列细胞内途径,可能导致癌细胞增殖、阻断凋亡、侵袭转移、肿瘤诱导的新生血管形成[31]。血小板衍生生长因子受体(PDGFR)及其配体在多种人类恶性肿瘤中发挥着重要作用[32]。Mizuno等[33]发现在小鼠皮肤表皮细胞JB6CL41细胞中,用TF3预处理细胞能诱导EGFR内化和下调,并且这种下调是由泛素化和蛋白酶体介导的,并不需要酪氨酸激酶的激活。
Liang等[34]在小鼠成纤维细胞NIH3T3细胞和人表皮样癌细胞A431细胞中,用TF3预处理细胞然后加入表皮生长因子(EGF)或血小板衍生生长因子(PDGF),结果证明TF3与EGF或PDGF共同处理细胞均能降低EGF或PDGF诱导的EGFR、PDGFR自磷酸化。TF3不仅对肿瘤细胞具有抗增殖作用,而且其分子机制可能阻断生长因子与其受体的结合,从而抑制有丝分裂信号转导。
3.2.2 抗肿瘤血管形成
VEGF是调控血管生成的生长因子,能促进血管内皮细胞的增殖、迁移,抑制其调亡。它的表达受HIF-1影响,HIF-1是一种转录因子,包含HIF-1α和HIF-1β两个亚基。高颖[35]研究证明了TF3在体内外均具有抑制卵巢癌细胞诱导的血管生成的能力。与EGCG相比,TF3的作用更强,这可能与TF3含有苯并酚酮核而EGCG没有有关。TF3抑制人卵巢癌细胞OVCAR-3细胞诱导的人脐静脉内皮细胞和鸡胚尿囊膜血管生成,通过下调HIF-1α和VEGF降低肿瘤血管生成。这些研究表明TF3可能是一种潜在的抗血管生成药物,可用于癌症治疗。
3.2.3 促进癌细胞凋亡
抑癌蛋白p53不仅介导细胞周期阻滞,而且可以诱导癌细胞凋亡,对有效抗肿瘤至关重要。p53通过转录依赖和非依赖机制诱导线粒体外膜通透性,从而触发细胞凋亡[36]。Caspase是一类能特异性切割靶蛋白天冬氨酸残基上的肽键的半胱氨酸蛋白酶,在细胞的调亡中起关键作用。谷胱甘肽,是细胞氧化还原状态的主要贡献者,它的主要功能是清除在正常的细胞呼吸过程中产生的自由基和过氧化物,避免脂质、蛋白质和核酸的氧化损伤。
Ding等[37]研究发现先将TF3在37 ℃培养箱中预孵育3 h,然后加入96孔板处理,对人结肠癌细胞HCT116细胞的抑制作用高于TF3,由此推测TF3的降解产物在抗肿瘤中起关键作用。预先处理的TF3主要通过增加p53和Caspase-3的表达诱导HCT116细胞凋亡。Schuck等[38]研究发现TF3对人口腔鳞癌细胞HSC-2细胞和正常成纤维细胞GN46细胞的生长具有浓度和时间依赖性抑制作用,并且癌细胞比成纤维细胞更敏感。在TF3作用4 h后,HSC-2细胞内谷胱甘肽水平降低,Caspase-3活性升高,由此导致人口腔鳞癌细胞HSC-2的凋亡。
3.3 抗菌性
Ohba等[39]研究发现茶黄素中的游离羟基是决定抗菌活性的重要基团,其作用机制有以下几个方面。
3.3.1 破坏生物膜的完整性
Wang等[40]发现TF3在体外对变形链球菌UA159具有抑制作用,通过抑制编码葡萄糖基转移酶(Gtfs)基因的表达来减少葡聚糖的形成,通过抑制细菌细胞自溶和影响分泌系统下调了变形链球菌,产生eDNA。葡聚糖和eDNA在生物膜中可以形成支架,成为细菌的保护屏障。此外,在亚杀菌浓度条件下的TF3通过降低糖酵解相关酶和维持胞质pH,抑制了变形链球菌生物膜的产酸,提高了耐酸性。
3.3.2 抑制基因复制
Mohammadi等[41]发现在高浓度的TF3和表没食子儿茶素没食子酸酯(EGCG)条件下,在一些细菌细胞中观察到浓缩的核仁,这些物质似乎降低了生物合成和代谢活性,从而导致细菌细胞死亡系统的诱导。在一些高浓度TF3处理的细胞中,细胞的荧光密度低于未处理的细胞,说明TF3降低了基因组DNA的复制。
3.3.3 降低细菌的耐药性
β-内酰胺酶(MBLs)是细菌产生的可水解β-内酰胺环抗生素的酶,它的分泌是β-内酰胺类抗生素重要的耐药机制。金属β-内酰胺酶是常见的革兰氏阳性和革兰氏阴性病原体产生的一些最著名的β-内酰胺酶,是细菌对β-内酰胺类抗生素耐药性上升的关键因素。Teng等[42]发现TF3与β-内酰胺类抗生素对耐甲氧西林金黄色葡萄球菌(StaphylococcusaureusBAA1717)的协同作用。BAA1717是一种典型的耐甲氧西林金黄色葡萄球菌菌株,能高效表达多种MBLs。用分子动力学模拟方法研究了TF3对MBLs的抑制作用,发现TF3与Gln242和Ser369的结合限制了MBLs的水解活性。在分子动力学模拟中,Gln242和Ser369是TFDG与β-内酰胺酶N1结合的重要残基。此外,TF3与β-内酰胺类抗生素联合应用对小鼠金黄色葡萄球菌肺炎模型有明显的保护作用。这些研究结果表明:TF3能有效地抑制MBLs的水解活性,增强β-内酰胺类抗生素对体内外病原菌的抗菌活性。
3.4 抑制破骨细胞生成
尽管确切的机制尚不清楚,但许多研究小组报道破骨细胞在种植体周围骨溶解(PIO)的发生发展中起着重要作用,因此,破骨细胞被认为是治疗溶骨性疾病的主要靶点。先前的研究已经揭示了细胞外调节蛋白激酶(ERK)信号通路在启动磨损碎片刺激的骨溶解和破骨细胞形成中的关键作用。有越来越多的证据表明来自钛(Ti)、聚甲基丙烯酸甲酯、聚乙烯和钴铬等材料的磨损碎片过度激活了植入部位的破骨细胞[43-44]。转录谱显示活化T细胞C1的核因子(NFATc1)是破骨细胞转录组的主要调节因子,促进骨吸收所需的许多基因的表达[45]。Hu等[46]研究表明TF3主要通过抑制ERK信号通路及其下游因子NFATc1来抑制破骨细胞的发生和破骨细胞相关基因的表达,证实了TF3对Ti颗粒诱导的小鼠颅骨骨溶解有保护作用,从而防止骨丢失。这些研究结果表明TF3对磨损碎片引起的PIO有治疗作用。
3.5 其他活性
胰腺脂肪酶是脂肪吸收的关键酶,因此,通过抑制脂肪酶来减少脂肪的吸收是抑制体重增加的有效方法。Kobayashi等[47]研究发现具有没食子酸部分的TF2A,TF2B和TFDG以剂量依赖的方式抑制胰腺脂肪酶的活性,并且在相同浓度下TF3比EGCG和ECG混合物可以更加有效地抑制胰腺脂肪酶的活性。
缝隙连接蛋白43(Cx43)是心肌细胞中最广泛表达的连接蛋白,腺苷酸活化蛋白激酶(AMPK)可以逆转高糖条件下新生大鼠心肌细胞NRCMs中Cx43的下调。Shen等[48]发现TF3是通过恢复部分AMPK活性实现了部分逆转高糖诱导的NRCMs细胞中Cx43表达和自噬的抑制。抑制自噬可能是通过保留高糖刺激的NRCMs细胞中Cx43的表达实现的,其机理是TF3在蛋白质水平上可以减轻对Cx43表达的抑制,改善缝隙连接功能。实验结果表明TF3可能是通过激活AMPK改善糖尿病和心肌病人的心肌细胞行为的候选药物。
类风湿关节炎(RA)是一种常见的慢性炎症性疾病,在世界范围内有大量的患者。类风湿关节炎的特征是滑膜增生、滑膜关节持续慢性炎症和各种活化免疫细胞浸润[49]。基质金属蛋白酶(MMPs)参与与骨和软骨相关的基质的变性。TF3是一种对炎症因子有抑制作用的多酚。Liu等[50]研究发现了TF3对RA的衰减作用,TF3可以明显降低胶原诱导性关节炎(CIA)小鼠关节炎评分和发病率,并能显著延迟关节炎的发生1周。组织学分析表明:TF3能减轻CIA小鼠滑膜炎症和软骨骨破坏,使滑膜增生、软骨破坏和骨侵蚀程度由载药组的重度减至轻度。其作用机理主要是通过抑制炎症细胞因子和MMPs的表达。
4 结 论
目前关于茶黄素和茶黄素双没食子酸酯的吸收和代谢的信息非常有限,因此应该对这些化合物的安全性、吸收和代谢进行更多的研究。茶黄素的口服生物利用度非常低,目前可以通过纳米包埋技术提高植物多酚的生物利用度,蛋白质纳米颗粒和壳聚糖是植物多酚中最常用的纳米载体,有大量证据表明它们可以改善酚类化合物在肠道的吸收,并且增强其生理活性。茶黄素双没食子酸酯作为多酚类物质的一种,目前已有少量研究证实了可以通过类似技术方法来提高生物利用度,还需要更多的研究来支持这一观点。此外,茶黄素双没食子酸酯在茶叶中含量低,提取成本高,仅仅通过在茶叶中提取来应用于药品和保健品是不现实的,采用现代科技手段如酶促氧化合成茶黄素双没食子酸酯,可以大大提高其产量和品质,具有重要意义。

