免疫抑制剂他克莫司研究进展
金美英,方晨捷,陈 燏,张 博,刘 平,柳志强
(1.杭州中美华东制药有限公司,浙江 杭州 310011;2.浙江工业大学 生物工程学院,浙江 杭州 310014)
当前,全世界范围内由于肝病、肾病等原因需要移植器官的患者数量逐年增加。中国每年需要器官移植的患者人数约有30万人。中国于2018年共完成器官移植手术20 201例,位居世界第二位,亚洲第一位。器官移植作为这些患者的重要治疗手段,越来越受到广泛重视[1]。早在20世纪70年代末,科学家们就发现一些真菌代谢产物具有很强的免疫抑制作用,且选择性较好。在发现他克莫司之前,临床上常用环孢素A(CsA)作为免疫抑制剂来治疗器官移植后的排斥反应。CsA也是一种CaN抑制剂,免疫抑制机制与他克莫司类似,但他克莫司的作用效果是CsA的100倍左右[2]。1993年,他克莫司胶囊在日本首次批准上市,商品名是“普乐可复”。随后其经FDA获准后,相继在多个国家上市使用。他克莫司自上市以来广泛用于肝、肾和骨髓移植的急慢性排斥治疗,已成为临床上肝、肾移植后治疗排斥反应的一线药物。国内的他克莫司市场基本上被Astellas公司的原研药“普乐可复”所占据,且原研药“普乐可复”较国内同类产品价格高出30%~50%左右。1 mg规格的他克莫司胶囊,原研药品销售价格在1 200元左右。
随着他克莫司合成基因簇的阐释和代谢途径的解析,通过基因工程和代谢工程手段提高其产量的研究逐年增加。笔者综述他克莫司药代动力学和药效学的研究近况,介绍其合成基因簇和代谢途径,并总结了近年来通过代谢工程手段提升菌株他克莫司产量的相关研究。
1 他克莫司的药代动力学和药效学研究
1.1 他克莫司的药代动力学研究
他克莫司主要经小肠吸收,且吸收个体差异性大,进食会影响其血药浓度,但其吸收不受胆汁影响。其体内半衰期为3.5~40.5 h,平均为8.7 h。他克莫司的体内血药浓度由许多因素所决定,如性别、年龄、种族、遗传差异和病理生理状态等。而遗传差异是导致个体之间血药浓度差距的主要影响因素。他克莫司在体内主要由肝脏代谢,其血药浓度与人体中相关代谢酶的活性高度相关。CYP3A酶是CYP450酶中重要的亚家族,作为药物代谢和口服药物首关效应的主要酶系存在。CYP3A酶包括4种同工酶:CYP3A4、CYP3A5、CYP3A7和CYP3A43。参与他克莫司代谢的主要是CYP3A4和CYP3A5,其酶活的增高会增加他克莫司非活性代谢物,从而降低血药浓度,反之亦然[3]。它们中CYP3A5的基因多态性与遗传差异高度相关,根据CYP3A5*3的表型不同,可将人群分为快代谢型(*1/*1,野生型)、中代谢型(*1/*3,杂合型)及慢代谢型(*3/*3,纯合突变型)[4]。根据文献报道,中国汉族人群中CYP3A5*3的突变率高达72.17%。他克莫司的药代动力学个体之间差异显著,相同剂量给药情况下个体之间的血药浓度也可能相差数倍。各国指南中基于CYP3A5基因型推荐使用的他克莫司起始剂量见表1[3],为临床上对他克莫司合理、安全地用药提供了参考。
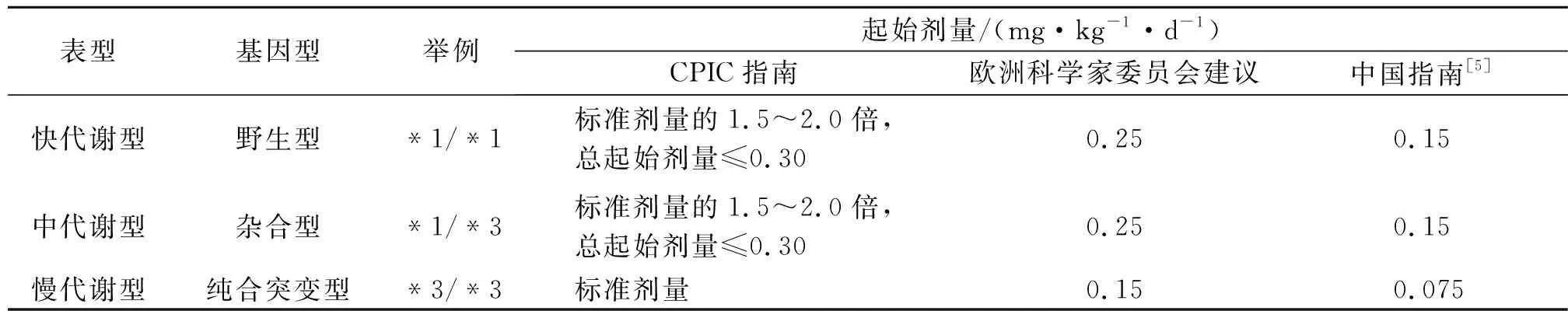
表1 基于CYP3A5基因型他克莫司用药起始剂量Table 1 Starting dose of tacrolimus based on CYP3A5 genotype
1.2 他克莫司的药效学研究
他克莫司治疗肾脏器官移植排斥反应疗效显著[6]。Cheung等[7]对76位肾移植患者长达8年的前瞻性研究表明:他克莫司治疗组活检证实的急性排斥反应发生率显著低于环孢素治疗组(分别为18.4%和42.1%,P=0.03);且他克莫司治疗组患者发生高胆固醇血症概率也显著更低(P=0.05)。Mizuiri等[8]对使用环孢素A和他克莫司治疗的63名肾移植患者进行肾活检显示,他克莫司(10~14 ng/mL,n=20)治疗组肾小管间质中CD68阳性细胞比环孢素治疗组(180~220 ng/mL,n=43)较少(分别为0.9±0.8和1.5±0.9,P<0.01),而肾小管间质中CD68阳性细胞较多的患者移植存活率较低(P<0.05),且肾间质中NF-kB(Nuclear factor-kappa B)与肾小管间质的CD68显著相关(P<0.01),环孢素治疗组患者中巨噬细胞数量较他克莫司治疗患者更多,肾小管间质巨噬细胞侵袭和NF-kB活化存在显着相关性,NF-kB活化又与排斥反应的发生明显相关。因此,在抵抗巨噬细胞入侵和预防及治疗排斥反应方面,他克莫司比环孢素疗效更好。此外,Hymes等[9]先使用环孢素A治疗肾移植儿童,连续3 d服用高剂量糖皮质激素(10 mg/kg)后,肾活检显示发生急性排斥反应,而将环孢素换为他克莫司后,移植早期(12周内)及晚期(12周后)急性排斥反应均得到控制,此研究表明对肾移植儿童服用高剂量糖皮质激素发生的急性排斥反应,他克莫司的免疫抑制效果较环孢素更优。白杨娟等[10]研究结果表明:在治疗肝移植患者中,环孢菌素A治疗组中CD4+T细胞和CD8+T细胞表面CD28、CD152分子表达均明显高于他克莫司治疗组(P<0.05),他克莫司可同时抑制T细胞正性共刺激分子白细胞表面分化抗原(CD28)和可诱导共刺激分子(ICOS)表达并促进T细胞负性调节分子相关抗原(CD152)表达,而环孢菌素A对T细胞免疫抑制作用主要是通过促进CD152分子的高表达介导,这从另一个方面解释了他克莫司药效比环孢素强的原因。
动物模型研究也证实他克莫司不仅可用作初级预防性治疗药物也可在临床器官移植的抗排斥治疗起到很好的免疫作用。小鼠心脏移植实验首次证实他克莫司为一种治疗慢性排斥反应有效的免疫抑制剂[4]。Jiang等[11]在心脏移植小鼠发生持续性排斥反应模型中,观察到每天3.2 mg/kg他克莫司治疗的受体大鼠相比于每天用10 mg/kg环孢菌素A治疗的受体大鼠,IL-10在他克莫司治疗的患者移植器官中被显著抑制,心脏组织中CD8 T细胞和NK细胞的表达也降低,小鼠平均存活时间明显延长(P<0.01)。研究结果表明:他克莫司能有效减轻持续性排斥反应,并且IL-10可能是他克莫司特异性细胞毒性介质,在调节的同种异体移植排斥反应起到至关重要的作用。
他克莫司治疗窗较窄,低浓度易发生移植排斥反应,高浓度会引起毒性反应,而严重不良反应将直接影响其临床应用。Khoury等[12]观察85名肾移植患者服用他克莫司后发现,23%患者获得糖尿病,13%患者出现过单次可逆性高血糖发作,其中只有4.7%患者明确需要使用胰岛素治疗,表明使用他克莫司引起糖尿病是较轻微的,可以通过饮食和口服降糖药容易地控制。
此外,他克莫司还引起高血压、高钾血症、增加肿瘤及感染的风险;他克莫司使用后中性粒细胞减少、急性造血功能停滞,常规剂量导致免疫抑制过度、牙龈增生、溶血性尿毒性综合征等,也会引起肝脏毒性,并引发癫痫、迟发性后部脑白质病变、视神经损害、失语症等不良反应,导致这些不良反应的确切机制尚需进一步研究。因此,临床上在使用他克莫司时需密切监测患者的血药浓度、血肌酐、尿量及肝功能等指标,重视他克莫司的给药时机、剂量调整等,从而减少不良反应的发生。
2 他克莫司的理化性质与免疫抑制机制
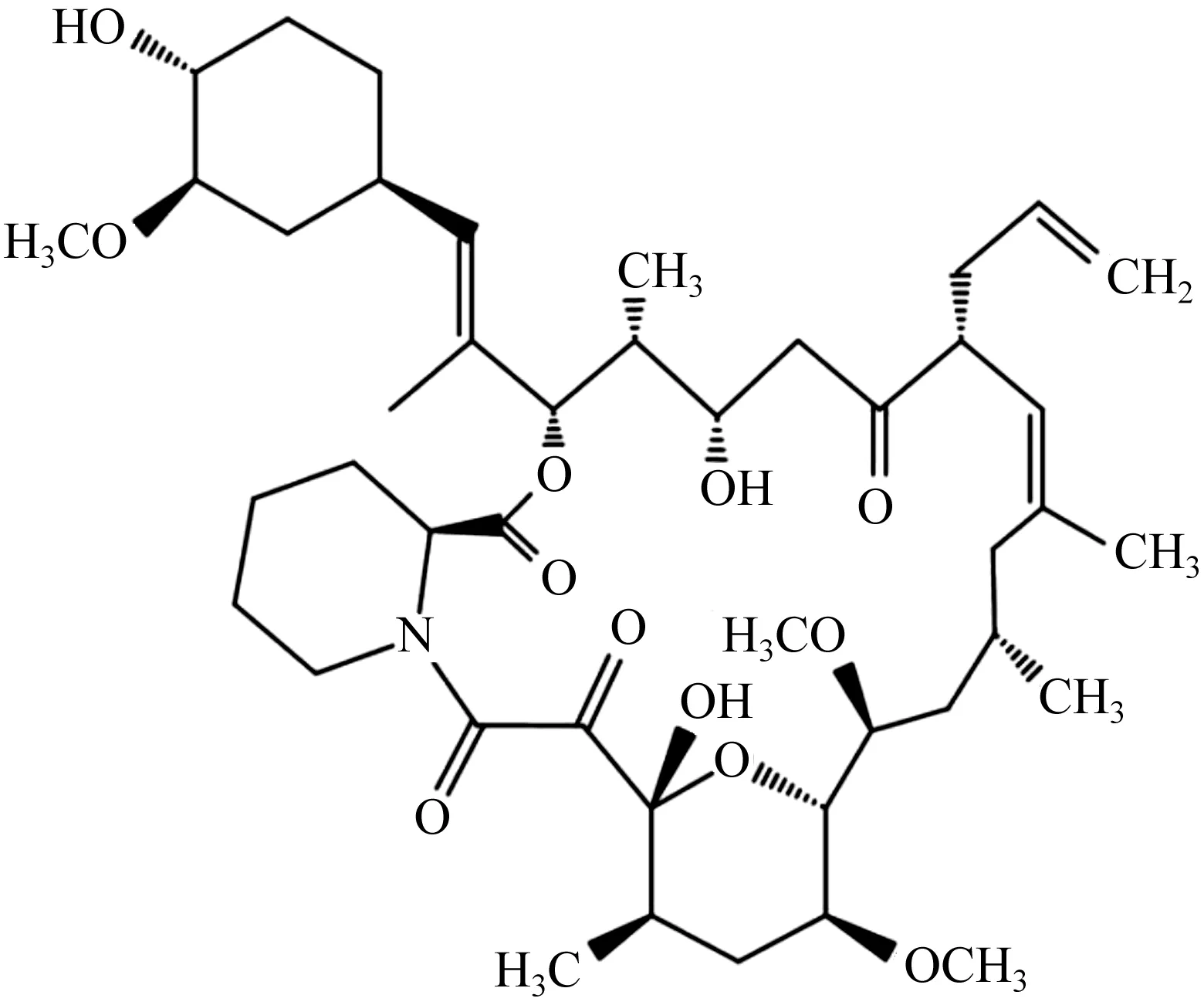
他克莫司是由链霉菌属(Streptomyces)发酵得到的产物。到目前为止,已报道超过15种产生他克莫司的菌种[13],包括Streptomycestsukubaensis9993,Streptomycestacrolimicus,Streptomycessp. ATCC 53770,Streptomycessp. MA6949,StreptomycesglaucescensMTCC 5115,StreptomycesclavuligerusCKD1119等。他克莫司是一种高效的23元大环内酯类新型免疫抑制剂,常温下为无色晶体,熔点为127~129 ℃,溶于甲醇、乙醇、丙酮、乙酸乙酯、氯仿或乙醚,难溶于己烷或石油醚,不溶于水,在不同贮存条件下稳定性都较高[14],分子式是C44H69NO12,相对分子质量为804.02[15],化学结构式为
他克莫司对于T淋巴细胞的增殖抑制显著,其中主要是作为钙调神经磷酸酶抑制剂发挥作用,并显示出与环孢菌素A非常相似的作用机制。具体机制是当他克莫司与其细胞溶质受体(主要是FKBP12-)相互作用时,钙调神经磷酸酶的钙调蛋白依赖性丝氨酸/苏氨酸磷酸酶活性受到抑制。在这种情况下,钙调神经磷酸酶不再能使转录因子(例如NFAT)去磷酸化,而去磷酸化的转录因子是控制T细胞增殖所必需的。这种机制在人类T淋巴细胞和酵母等真菌细胞中是保守的,因此他克莫司也具有抗真菌活性。该活性可用于通过对易感菌株如酿酒酵母TB23的生物测定来定性检测他克莫司[16]。
3 他克莫司的生物合成研究
1984年,日本藤泽公司研究所从日本筑波山土壤中分离出的筑波链霉菌发酵液中提取得到了他克莫司。但最初的他克莫司的发酵产量极低。不过通过对发酵条件的优化,产量可提高10倍以上。在此基础上进行了菌株的改良和发酵条件的进一步优化,生产能力提高了几十倍[14]。
国内一些研究是围绕发酵培养基条件优化和原始菌株诱变筛选展开的。邱观荣等[17]通过实验选择玉米淀粉及葡萄糖作为主碳源,选用黄豆粉和玉米浆为主氮源,且确定最佳碳氮源组合(质量分数)为2.0%葡萄糖,6.0%玉米淀粉,2.0%黄豆粉,0.5%玉米浆。最终得到适合的种子菌龄为48 h,培养基的初始pH为7.5,500 mL三角瓶较佳装液量为50 mL,摇瓶适宜转速为250 r/min,适宜发酵温度为27 ℃,最佳接种量为10%(质量分数),最佳发酵周期为7 d。优化组发酵液中的平均发酵水平最终达586 μg/mL,与对照组相比提高60%以上。顾骏等[18]先通过两水平因子设计方法找到培养基中重要的影响因子,然后确定其合适的浓度范围,再通过中心组合设计及响应面分析方法,最终确定培养基各成分最佳的浓度配比。经优化得到的最佳培养基为葡萄糖6.14 g/L,酵母粉1.52 g/L,黄豆饼粉5 g/L,花生饼粉12.28 g/L,玉米淀粉30 g/L,K2HPO45 g/L。相对于初始发酵培养基,他克莫司产量由60 μg/mL提升至90 μg/mL,提高了约55%。傅立峰等[19]通过研究不同发酵条件对他克莫司发酵的影响,获得了最适摇瓶发酵培养条件:种子培养基中以1.5 g/L葡萄糖为辅碳源,种子培养时间40 h,500 mL摇瓶适宜装液量为20 mL,适宜接种量为10%(质量分数);20吨发酵罐发酵培养过程中溶氧控制在20%以上,适宜发酵周期为7 d,在发酵第4天和第5天进行分批补料,最终发酵得到他克莫司的质量浓度为1 150 μg/mL。王会会等[20]采用具有低成本、操作方便等优点的常压室温等离子体(ARTP)技术[21]对他克莫司产生菌进行诱变处理。利用ARTP诱变20 s,获得初始突变菌,从初筛的127株菌株中得到4株高产的诱变菌株,其中FK18-1-56较出发菌株产量提高了162%,且连续传4代菌株产量稳定。王秀琴等[22]通过复合诱变方法筛选得到新菌株08-9-81较出发菌株的发酵水平提高73.6%。
Kosec等[23]开发了一种新的化学生物合成方法能够显著减少副产物子囊霉素(FK520)和双氢他克莫司(FK506D)的产生。在StreptomycestsukubaensisallR基因缺失突变株的发酵过程中外源添加烯丙基丙二酰-SNAC可观测到仅有FK506的生成,没有可检测量FK520及FK506D的产生。但其他克莫司(FK506)的产量显著低于野生型,经对照组对比分析结果可得烯丙基丙二酰-SNAC对野生型菌株具有一定毒性。此后还可通过菌株筛选和进料优化进一步提高FK506产量。
Xia等[24]通过代谢组学,利用主成分分析(PCA)和偏最小二乘法分析(PLS)两种分析方法分别分析了中心碳代谢途径(EMP、TCA和PPP)、莽草酸途径、氨基酸代谢途径和脂肪酸代谢途径中的23种主要代谢物;通过比较代谢分析确定了13种关
键代谢物与FK506的合成密切相关;通过分析不同时间不同浓度的补料与产量之间的关系最终确定了一个合理的补料策略。首先他们发现适量乳酸的添加能增加FK506的产量,在36 h添加终质量浓度为15 g/L的乳酸能使FK506产量从251 mg/L增加到281 mg/L;同时观察到外源添加丙酮酸会使菌体生长和产物生成均受到抑制;其原因可能是菌株不能有效利用外源营养物质以及有机酸的积累导致发酵液pH的降低。在96 h添加终质量浓度为1.5 g/L的琥珀酸钠能使FK506的产量提高28%达到321 mg/L。在72 h添加1.5 g/L莽草酸、0.1 g/L苯丙氨酸、酪氨酸与色氨酸能使产量最大提高达到41.8%。缬氨酸、脯氨酸、亮氨酸和苏氨酸的添加会使得细胞内各种CoA酯增加,从而显著刺激FK506的产生。在24 h加入10 g/L豆油会使FK506产量提高44%,表明脂肪酸和CoA酯前体的形成密切相关。Wang等[25]也观测到三酰甘油能削弱链霉菌中乙酰CoA到TCA的碳通量同时增强聚酮化合物的生成,他们将相关基因SCO6196置于二甲氨基二硫代甲酸铜(Cumate)诱导启动子控制下,构建了相关ddTAG策略,通过选择性控制TAG降解的时间和强度有效提高相关聚酮化合物产量。他们在放线菌素、杰多霉素B、土霉素以及阿维菌素B1a生产菌株中都成功应用了该策略使得相关产物产量得到了提升。
4 他克莫司的合成基因簇及组装机制研究
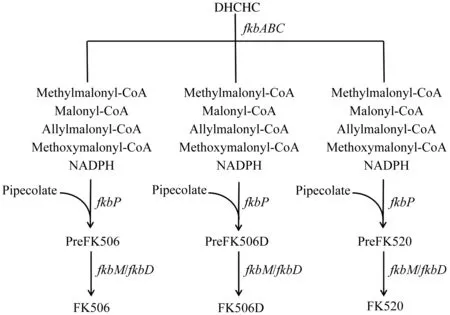
目前,他克莫司生物合成基因簇已被测序,且确定了获得的大多数基因在他克莫司合成中所起到的作用,见图1。其中tcsA、tcsB、tcsC和tcsD负责烯丙基丙二酰基-ACP的生物合成;fkbG、fkbH、fkbI、fkbJ和fkbK负责甲氧基丙二酰基-ACP的合成;fkbA、fkbB和fkbC负责延伸单元的连接与缩化;fkbL负责哌啶酸的生物合成;fkbD负责他克莫司C9的羟基化、氧化,产生β-羰基酰胺;fkbM负责C31的羟基甲基化;fkbP负责哌啶酸与内酯环连接[26]。
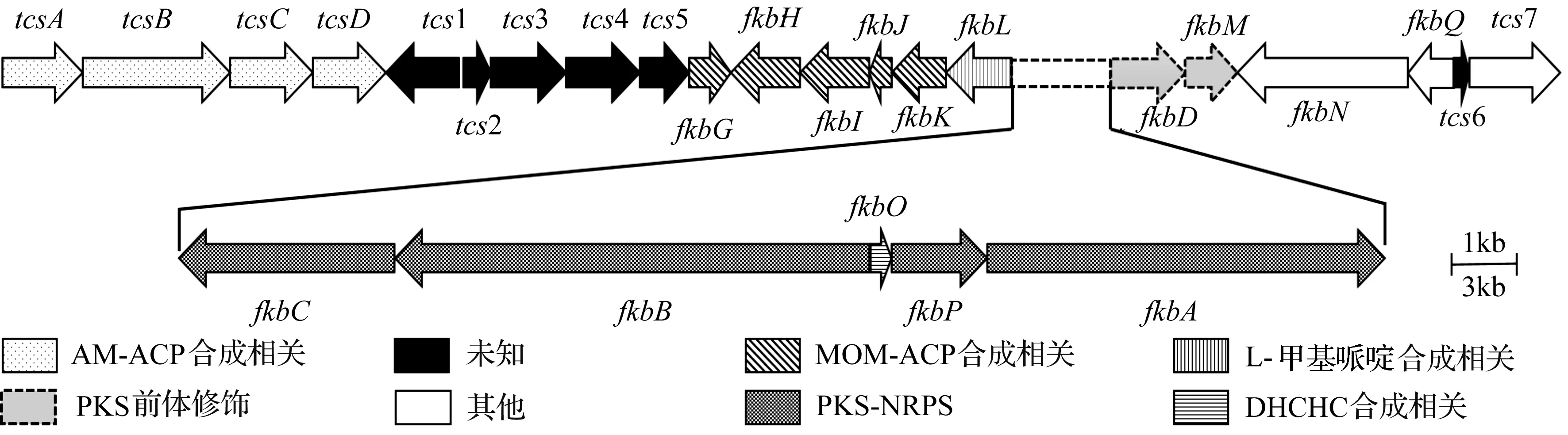
图1 他克莫司合成基因簇Fig.1 Biosynthetic gene clusters of tacrolimus
20世纪90年代默克公司首先研究了他克莫司生物合成途径。他克莫司是由fkb基因簇编码的杂合聚酮化合物Ⅰ合酶-非核糖体肽合酶(PKSI-NRPS)系统合成的聚酮化合物。他克莫司结构较为复杂,内酯环由5个甲基丙二酰、2个丙二酰、2个甲氧基丙二酰和1个烯丙基丙二酰延伸单元组成。他克莫司生物合成的第一步是通过FkbO将分支酸转化成(4R,5R)-4,5-二羟基环己-1-烯羧酸(简称DHCHC)。DHCHC作为随后形成碳骨架的起始单元,与他克莫司最终结构中的环己烷环相对应。聚酮合成酶FkbA,FkbB和FkbC以丙二酰辅酶A(2分子),甲基丙二酰辅酶A(5分子),甲氧基丙二酰基-ACP(2分子)和烯丙基丙二酰辅酶A(1分子)为扩展单元催化来自DHCHC的10个延伸步骤[16]。对于大环内酯的环化,FkbL从L-赖氨酸生成L-哌啶酸,然后由NRPS-FkbP将其并入碳骨架。最后C31处羟基的甲基化和C9处的氧化对他克莫司与FKBP-12的结合都很重要,是免疫抑制活性所必需的基团。甲基化是由S-腺苷甲基化依赖的O-甲基转移酶FkbM催化的,氧化是由细胞色素P450氧化还原酶FkbD催化的。而当C21位R官能团为甲基,即他克莫司合成过程中此位点上的烯丙基丙二酰辅酶A被乙基丙二酰辅酶A替换时生成产物为子囊霉素(FK520)。当C21位R官能团双键被加氢,则产物为双氢他克莫司(FK506D)[14]。
5 他克莫司代谢途径研究及代谢工程改造
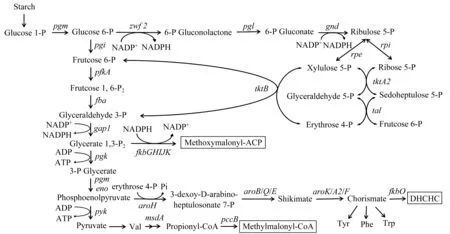
代谢工程技术是通过基因工程手段理性改造宿主细胞基因组,获得高产目标产物的菌株[27]。对合成他克莫司的原料来源进行分析:DHCHC来源于分支酸;扩展单元丙二酰辅酶A和烯丙基丙二酰辅酶A来源于乙酰辅酶A;甲基丙二酰辅酶A来源于缬氨酸形成的丙酰辅酶A和TCA中的琥珀酰辅酶A;甲氧基丙二酰基-ACP来源于糖酵解途径的1,3-二磷酸甘油酸;L-哌啶酸来源于L-赖氨酸。详细的代谢途径[24]如下。
糖酵解相关代谢途径为
三羧酸循环相关代谢途径为
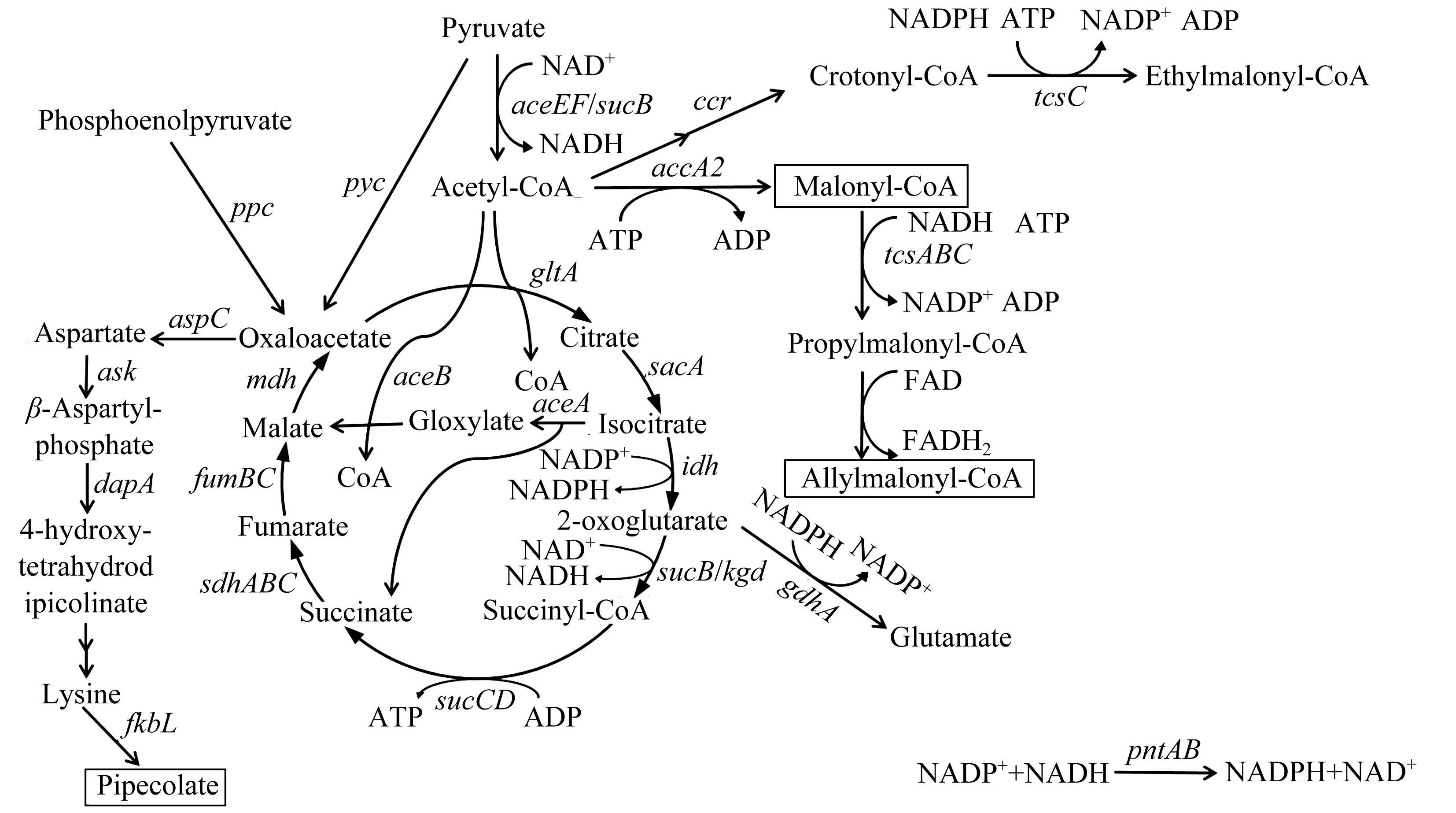
他克莫司组装相关代谢途径为
Chen等[28]对烯丙基丙二酰辅酶A和甲氧基丙二酰基-ACP相关合成基因分别进行过表达,他克莫司产量从原始菌株的46.9 mg/L分别提高到95.7,61.3 mg/L。Huang等[29]在S.tsukubaensisD852菌株中分别及不同组合过表达fkbO、fkbP、fkbL、fkbM和fkbD,发现这些基因的过表达对于他克莫司的产量都有不同程度的提升,最终构建了同时过表达5个基因的菌株HT-FKBOPLMD,其产量达到(353.2±8.5) mg/L,较起始菌株产量提高了约150%;Huang等[30]通过基因组规模代谢模型分析构建了一株gdhA缺失和dahp,accA2,zwf2过表达的菌株HT-ΔGDH-DAZ使FK506质量浓度增加至398.9 mg/L,而原始菌株D852产量为158.7 mg/L;Wang等[31]对代谢组学数据进行相关网络权重分析(WGCNA)以及使用基因组规模的代谢网络模型(GSMM)确定了两个新的改造位点aroC和dapA。接着对这两个基因进行过表达,同时增强分支酸和赖氨酸生物合成的菌株HT-aroC/dapA能够产生128.19 mg/L他克莫司,比对照(78.26 mg/L)高了1.64倍。Wang等[32]通过构建一种GS-DFBA模型揭示了遗传操作的新靶点,发现gcdh和tktB的失活与msdh和ask的过表达会导致他克莫司产量增加,其中gcdh、tktB、msdh和ask分别编码戊二酰-CoA脱氢酶、转酮酶、甲基丙二酸半醛脱氢酶和天冬氨酸激酶。由此可见,上述酶在他克莫司的合成过程中起到一定作用。
6 结 论
他克莫司作为免疫抑制剂广泛用于器官移植的免疫排斥反应的治疗。研究表明不同基因型的个体在相同剂量给药下血药浓度差距甚大,故不同国家出台了相关指南为合理、安全用药提供了参考。在药效学的研究中证实他克莫司在治疗效果、副反应方面都较同类药物环孢霉素A更优。研究发现他克莫司可在多种菌种中产生,但根据产量及菌种研究的深度一般选择Streptomycestsukubaensis进行进一步研究。StreptomycestsukubaensisFK506合成基因簇的阐明及其合成代谢途径的解析为后续针对FK506的研究提供了理论基础以及改造框架。通过培养基及发酵条件的优化可以有效地提高FK506的产量,同时原始菌株的诱变筛选也对FK506产量有一定的提升。结合相关调控基因的深入解析,通过对相关基因的敲除同时外源添加相关物质可切实减少副产物的生成。利用代谢组相关分析技术确定一些在FK506合成过程中的关键代谢物,同时与发酵过程中适当添加可有效提高FK506的产量。然而,传统链霉菌基因工程和代谢工程的操作手段较为复杂,这阻碍了相关产物的研究发展进程。新的基因编辑技术的兴起以及链霉菌多种强启动子的解析为FK506产业的发展提供了巨大的前景。从目前的研究成果可以看出,大多数基因工程菌的FK506产量大幅提高都是通过外源添加相关物质实现的。因此,亟待研究的就是通过基因工程和代谢工程手段对Streptomycestsukubaensis中FK506整个合成代谢途径进行改造,在减少副产物生成的同时提高FK506在生产菌株中的产量,从而降低产品成本,提高工业化的水平。

