CTRP9对血管紧张素Ⅱ诱导的大鼠心肌成纤维细胞活化和增殖的影响
梁 翠,高 路,姚 瑞,李亚彭,李鹏程,刘 源,张殿红,王 铮,张彦周
郑州大学第一附属医院心血管内科 郑州 450052
心肌纤维化是冠心病、心肌梗死和心肌病等心脏疾病向心力衰竭进展的必然过程[1]。目前认为,心肌成纤维细胞在心肌纤维化的发生发展中起关键作用[2]。在各种致病因素作用下,成纤维细胞活化为肌成纤维细胞,后者发生形态学改变,表达平滑肌α肌动蛋白(α-SMA)、波形蛋白,还可表达多种细胞因子及受体,具有收缩功能[3]。成纤维细胞大量增殖,合成大量的细胞外基质,最终导致心肌纤维化。C1q肿瘤坏死因子相关蛋白9(CTRP9)是CTRP家族成员之一[4],研究[5]表明,CTRP9过表达可抑制糖尿病大鼠的心肌纤维化。2型糖尿病和冠心病患者血清CTRP9水平明显升高,且与炎症水平密切相关[6]。还有研究[7]发现,CTRP9可以通过抑制心肌细胞凋亡减轻心肌缺血/再灌注损伤。过表达CTRP9可减轻小鼠动脉粥样硬化[8]。此外,近期研究[9]发现,人源重组CTRP9可以减轻异丙肾上腺素诱导的小鼠心肌损伤。上述研究提示CTRP9对心脏有保护作用,但其具体作用机制仍不清楚。本研究观察了CTRP9对血管紧张素Ⅱ(AngⅡ)诱导的大鼠成纤维细胞活化、增殖的影响,现将结果报道如下。
1 材料与方法
1.1材料人重组CTRP9购于美国Abcam公司,磷酸化(p-)和总的(T-)mTOR、AMPKa及P70抗体购于美国CST公司,α-SMA抗体购于美国Abcam公司,GAPDH抗体购于美国Santa Cruz公司,AngⅡ购于美国Sigma公司,AMPKa抑制剂复合物C购于美国MedChem Express公司,CCK-8试剂盒购于上海碧云天公司,PCR反转录试剂盒购于美国罗氏公司。
1.2细胞培养取日龄1~3 d的SD大鼠乳鼠(购于北京华富康生物科技股份有限公司)心脏,置于10 mL DMEM/F12中;清洗后弃去培养基,用剪刀将心脏剪成1~2 mm3的组织碎块;加入1.25 g/L的胰蛋白酶消化10 min,消化5次,弃去第1次消化液,收集后4次消化液;40 μm过滤网滤去细胞团块。将滤液接种于两个10 cm培养皿中,差时贴壁90 min(成纤维细胞贴壁,心肌细胞仍悬浮),弃去心肌细胞,保留贴壁的成纤维细胞,取第2~3代的成纤维细胞用于后续实验。细胞接种于6孔板用于qRT-PCR,接种于96孔板用于CCK-8检测,接种于24孔板用于荧光染色,接种于10 cm培养皿用于蛋白提取。细胞用无血清的DMEM/F12孵育6 h后,按分组分别给予不同药物进行处理。
1.3细胞分组①为观察CTRP9对AngⅡ诱导的成纤维细胞增殖的影响,将细胞分为7组:对照组(不处理),AngⅡ组(1 μmol/L AngⅡ刺激48 h),10、25、50、100、200 mg/L CTRP9组(分别给予1 μmol/L AngⅡ和不同浓度CTRP9刺激48 h)。②为观察CTRP9对AngⅡ诱导的成纤维细胞活化、胶原合成和AMPKa通路蛋白表达的影响,将细胞分为4组:对照组,AngⅡ组(1 μmol/L AngⅡ刺激48 h),50、200 mg/L CTRP9组(分别给予1 μmol/L AngⅡ和不同浓度CTRP9刺激48 h)。③为观察AMPKa抑制剂对CTRP9抗成纤维细胞活化、增殖及胶原合成的作用,将细胞分为4组:对照组,AngⅡ组(1 μmol/L AngⅡ刺激48 h),CTRP9+复合物C组(细胞给予复合物C 10 μmol/L处理30 min后,再给予1 μmol/L AngⅡ和200 mg/L CTRP9刺激48 h),CTRP9组(细胞给予1 μmol/L AngⅡ和200 mg/L CTRP9刺激48 h)。
1.4细胞增殖率的CCK-8法检测各组细胞孵育48 h后,每孔加入1∶10稀释的CCK-8溶液100 μL,在培养箱中培养2.5 h。采用酶标仪检测450 nm处的光密度(OD),计算细胞增殖率:细胞增殖率=处理组OD/对照组OD×100%。实验重复6次。
1.5细胞中α-SMA的免疫荧光染色观察取各组细胞,用PBS清洗细胞,40 g/L多聚甲醛固定,体积分数0.1%Triton X-100通透5 min,将抗α-SMA单克隆抗体用体积分数1%羊血清按1∶100进行稀释后4 ℃孵育过夜。第2天用PBS清洗5次,加入二抗(1∶1 000稀释的Alexa FluorH 488羊抗鼠单克隆免疫球蛋白)室温孵育60 min。用PBS清洗6次,将细胞爬片转移到载玻片上,使用DAPI进行染色,显微镜下观察拍照。实验重复3次。
1.6Ⅰ型胶原、Ⅲ型胶原、纤维连接蛋白、结缔组织生长因子mRNA表达的qRT-PCR检测取各组细胞,用Trizol提取细胞总RNA,使用分光光度计测量纯度,将RNA反转录为cDNA。采用LightCycler 480 SYBR®Green 1 Master Mix体系进行PCR扩增:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s,共42个循环。采用2-ΔΔCt法计算目的mRNA的相对表达量。实验重复6次。
1.7AMPKa、P70和mTOR信号通路蛋白表达的Western blot检测将各组细胞溶于裂解缓冲液中,采用BCA法测量蛋白浓度。使用SDS-PAGE胶分离组织裂解产物,然后转移到PVDF膜上,再使用50 g/L脱脂牛奶封闭2 h。加入目的蛋白及内参GAPDH一抗(均按1∶1 000稀释)4 ℃孵育过夜,加入二抗(羊抗兔HRP标记的IgG,1∶10 000稀释)37 ℃孵育1 h。使用双色红外成像系统进行扫膜分析,计算磷酸化蛋白灰度值与总蛋白灰度值的比值。实验重复6次。
1.8统计学处理采用SPSS 13.0进行统计分析。不同组间细胞增殖率,Ⅰ型胶原、Ⅲ型胶原、纤维连接蛋白、结缔组织生长因子mRNA表达水平,p-AMPKa/T-AMPKa、p-mTOR/T-mTOR、p-P70/T-P70的比较均采用单因素方差分析,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1各组成纤维细胞增殖率的比较AngⅡ组细胞增殖率高于对照组,5个CTRP9组细胞增殖率均低于AngⅡ组(表1)。
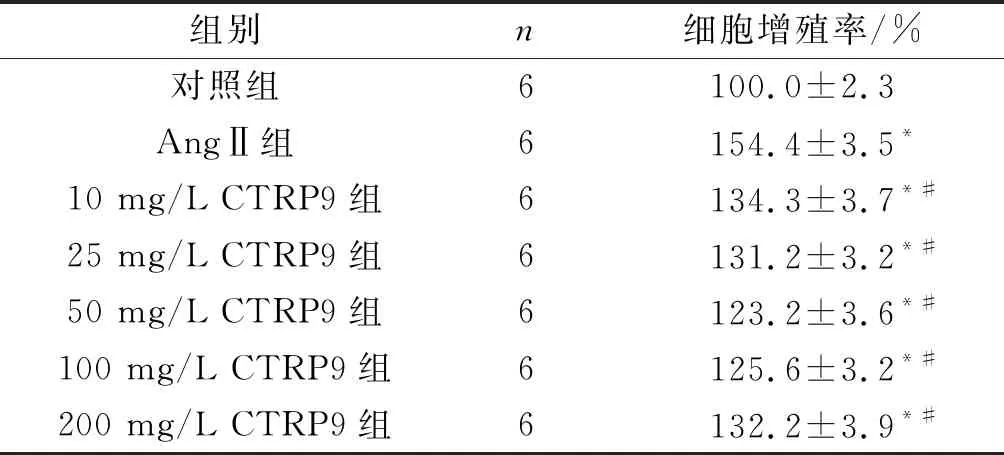
表1 各组成纤维细胞增殖率的比较
F=19.160,P<0.001;*:与对照组相比,P<0.05;#:与AngⅡ组相比,P<0.05
2.2CTRP9对AngⅡ诱导的成纤维细胞活化的影响结果(图1)显示,AngⅡ刺激48 h后心肌成纤维细胞α-SMA表达增多,50、200 mg/L的CTRP9均能减少α-SMA的表达。
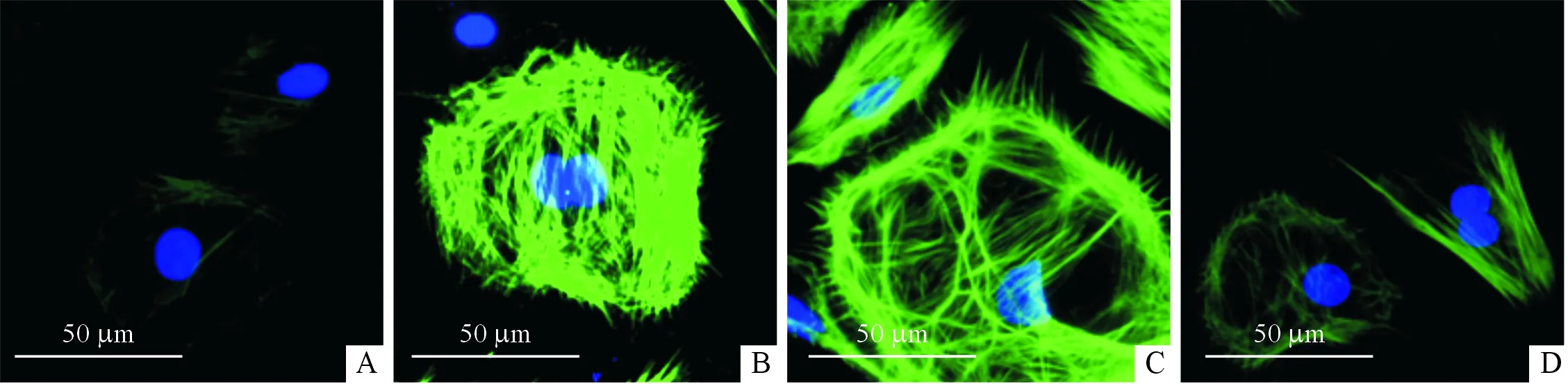
A:对照组;B:AngⅡ组;C:50 mg/L CTRP9组;D:200 mg/L CTRP9组;绿色:α-SMA;蓝色:细胞核
2.3CTRP9对AngⅡ诱导的成纤维细胞胶原合成的影响AngⅡ刺激48 h后,成纤维细胞Ⅰ型胶原、Ⅲ型胶原、纤维连接蛋白以及结缔组织生长因子mRNA的表达增多,50、200 mg/L的CTRP9均能减少上述促纤维化因子的表达(表2)。
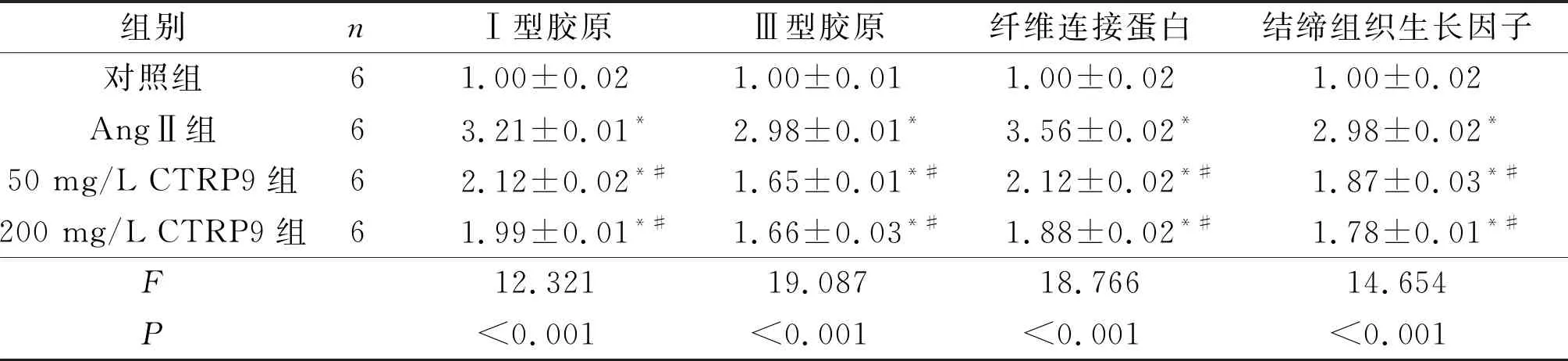
表2 各组成纤维细胞Ⅰ型胶原、Ⅲ型胶原、纤维连接蛋白以及结缔组织生长因子mRNA表达的比较
*:与对照组相比,P<0.05;#:与AngⅡ组相比,P<0.05
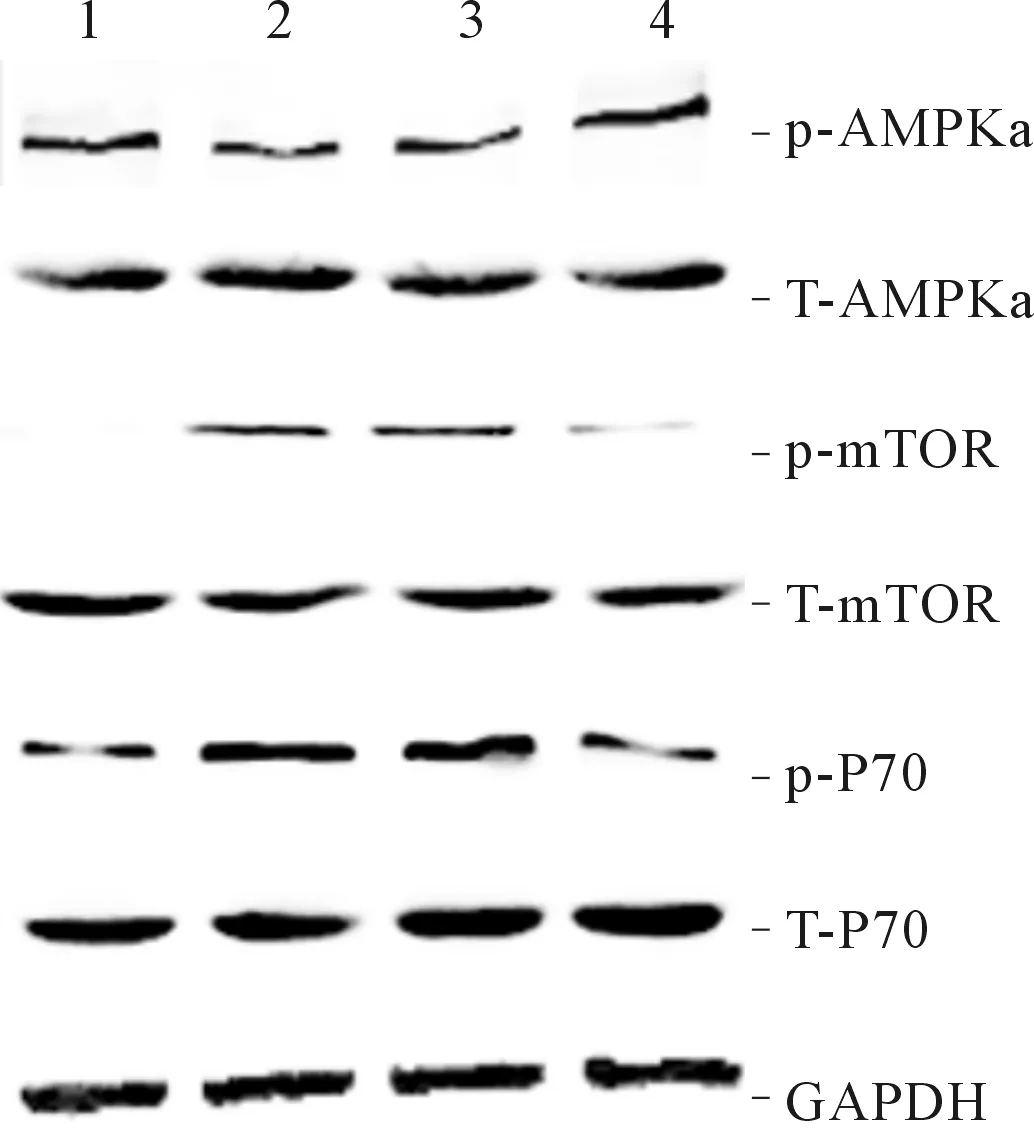
2.4CTRP9对AMPKa信号通路的影响结果(图2、表3)显示:AngⅡ刺激48 h后,成纤维细胞AMPKa蛋白的磷酸化水平较对照组下降,而其下游的mTOR和P70磷酸化水平增加。与AngⅡ组相比,200 mg/L CTRP9组AMPKa磷酸化水平增加,mTOR和P70磷酸化水平降低。
2.5AMPKa抑制剂对CTRP9抗成纤维细胞增殖、胶原合成作用的影响结果见表4。
2.6AMPKa抑制剂对CTRP9抗成纤维细胞活化作用的影响AngⅡ组、CTRP9+复合物C组α-SMA荧光染色均强于CTRP9组(图3)。
1:对照组;2:AngⅡ组;3:50 mg/L CTRP9组;4:200 mg/L CTRP9组
图2各组成纤维细胞p-AMPKa、T-AMPKa、p-mTOR、T-mTOR、p-P70、T-P70的表达
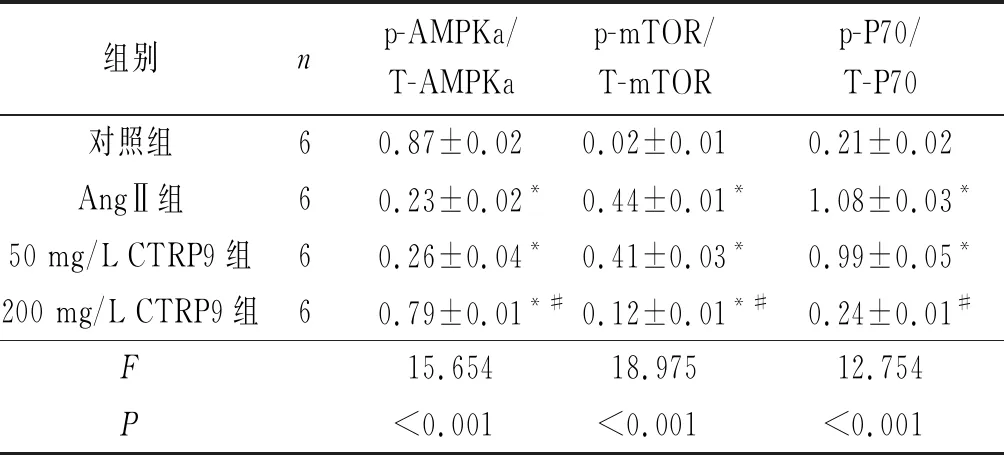
表3 各组成纤维细胞p-AMPKa/T-AMPKa、p-mTOR/T-mTOR、p-P70/T-P70的比较
*:与对照组相比,P<0.05;#:与AngⅡ组相比,P<0.05
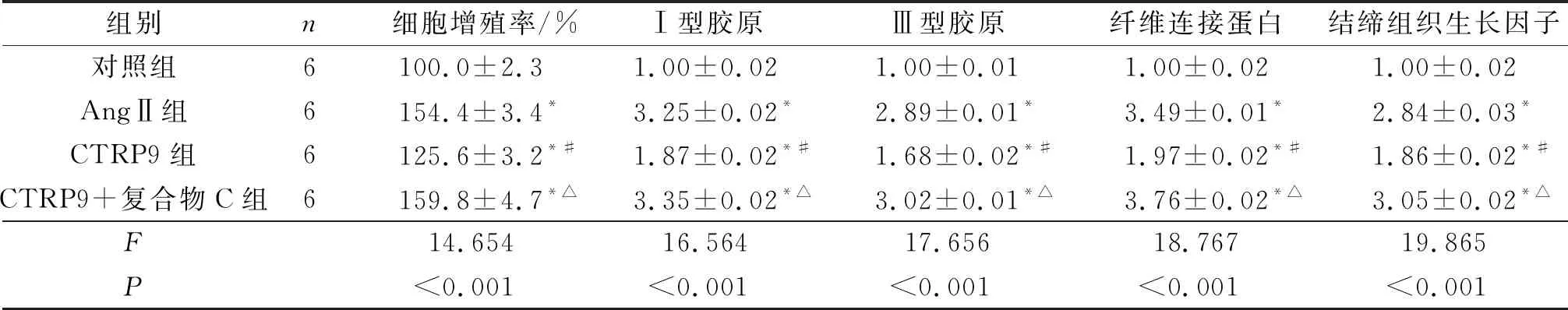
表4 各组成纤维细胞增殖、胶原合成能力的比较
*:与对照组相比,P<0.05;#:与AngⅡ组相比,P<0.05;△:与CTRP9组相比,P<0.05
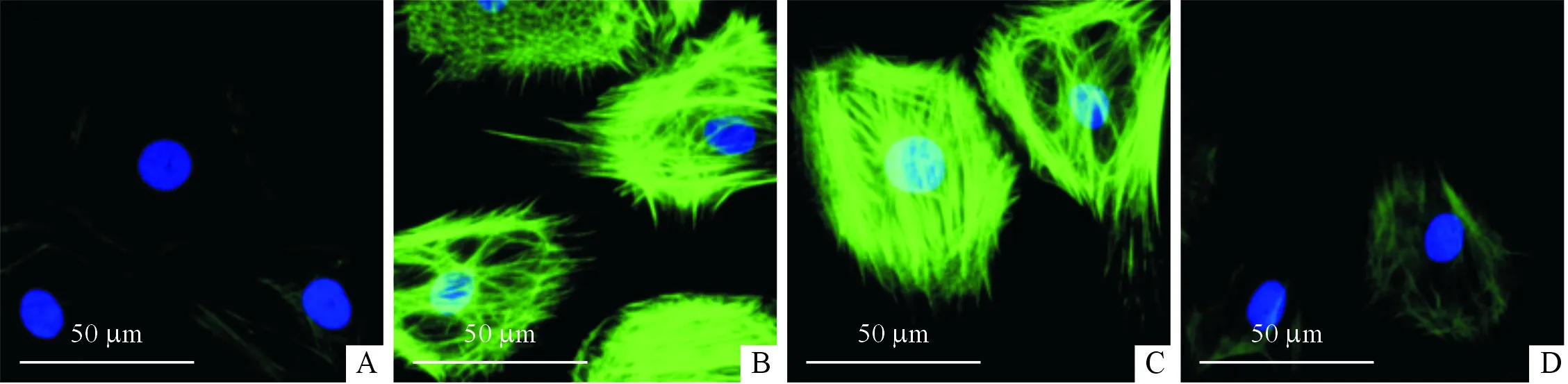
A:对照组;B:AngⅡ组;C:CTRP9+复合物C组;D:CTRP9组;绿色:α-SMA;蓝色:细胞核
3 讨论
成纤维细胞活化、心肌纤维化的关键过程,是成纤维细胞对多种细胞因子及其他局部刺激的综合应答反应[10]。多种细胞因子参与心肌纤维化,例如血小板源性生长因子、AngⅡ、转化生长因子、结缔组织生长因子等[11]。AngⅡ介导纤维化微环境的形成。AngⅡ作用于其受体, 通过活性氧依赖的Rho/Rac 及FAK依赖Ca2+/c-SRC通路激活转录因子AP-1,后者转录进入核内,在CREB 结合蛋白/p300作用下,启动Ⅰ型胶原、Ⅲ型胶原和纤维连接蛋白等基因的表达[12-13]。AMPK是在细胞中广泛表达的能量传感器,通过影响线粒体生成、蛋白质合成及分解等在细胞的生长和分化过程中发挥重要作用。作为调控心肌能量代谢的关键因素,AMPK在心肌纤维化中发挥重要作用。成纤维细胞主要表达AMPKa,AMPKa活化可以通过下调TGF-β通路抑制成纤维细胞α-SMA的表达,即抑制成纤维细胞的成熟[14]。AMPKa基因缺失在无任何刺激的情况下对心脏左室结构或功能没有影响,但可加剧心脏纤维化和心功能障碍[15];相反,AMPKa激活能显著降低心肌纤维化,其可通过抑制下游的mTOR、P70抑制心肌纤维化发展[16]。
作者采用10、25、50、100、200 mg/L的CTRP9处理大鼠心肌成纤维细胞,发现5种浓度的CTRP9均能够有效抑制AngⅡ诱导的成纤维细胞增殖。因此作者采用中间和最大浓度即50和200 mg/L的CTRP9进行后续研究,发现50和200 mg/L的CTRP9均能减少成纤维细胞α-SMA的表达,即抑制AngⅡ诱导的成纤维细胞活化,有效减少Ⅰ型胶原、Ⅲ型胶原和纤维连接蛋白等促纤维化因子mRNA的表达,同时升高AMPKa的表达。最后经AMPKa抑制剂复合物C处理成纤维细胞后,发现CTRP9+复合物C组成纤维细胞的增殖率以及Ⅰ型胶原、Ⅲ型胶原和纤维连接蛋白等促纤维化因子mRNA的表达水平高于CTRP9组,说明AMPKa抑制剂可阻断CTRP9的抗成纤维细胞增殖、活化和胶原合成作用,提示CTRP9可能是通过AMPKa信号通路发挥其抗纤维化作用。
综上所述,本研究结果提示CTRP9可通过激活AMPKa信号通路、减少促纤维化因子的表达,抑制AngⅡ诱导的大鼠心肌成纤维细胞活化、增殖和胶原合成功能,从而发挥抗心肌纤维化的作用。

