锰氧化物锂离子筛的掺杂改性及吸附性能研究
许乃才,黎四霞,曹佳佳,杨刚什尕
(青海师范大学化学化工学院,青海西宁810008)
锂及其化合物因具有优异的物理化学性能而被广泛应用在国防尖端、冶炼、制冷、玻璃制造、锂离子电池等行业[1]。 自然界并不存在天然锂,它主要以化合物的形式存在于锂矿、海水和盐湖卤水中。当前锂的提取研究主要集中在盐湖卤水中, 其中溶剂萃取法、沉淀法和吸附法是研究和应用较为普遍的方法[2]。 萃取法中萃取剂成本相对较高,且会给环境带来一定污染[3],因此在推广使用时有很大的局限性。沉淀法具有操作简便、效率和纯度较高的特点,但时间成本高且工艺复杂,不易处理低浓度的含锂卤水[4]。 吸附法具有选择性高、锂提取率高及易连续操作等优点, 从经济和环保角度考虑较其他方法占有很大优势。而在众多锂吸附剂中,尖晶石型锰氧化物锂离子筛具有吸附容量大、 成本低、 操作简单等优点, 有望成为高镁锂比盐湖卤水中规模化镁锂分离的最佳方式[5]。 然而,锂锰氧化物有一致命缺点,即Mn 在酸洗脱过程中易发生溶损而导致吸附剂结构坍塌,严重影响了其工业化应用进程。为了解决该问题,研究者采用掺杂和包覆手段对其进行改性,以抑制Jahn-Teller 效应,增强[MnO]6八面体的键合力来稳定尖晶石结构,从而改善材料的循环稳定性能。由于包覆并未从结构本质上解决Mn3+的溶损问题,因此掺杂改性目前研究较多。掺杂包括阳离子掺杂、阴离子掺杂和混合掺杂。 例如,董殿权等[6]研究了Ni2+掺杂的尖晶石型锰氧化物锂离子筛。 由于Ni—O 键的键能(382 kJ/mol)高于Mn—O 键(360 kJ/mol),当Ni2+取代尖晶石结构中的部分Mn3+后,锰氧八面体体积收缩,结合力和稳定性均有所增强。同时,Ni2+半径(0.069 nm)小于Mn3+(0.079 nm),当Ni2+进入尖晶石结构后晶格收缩,进一步增强了原子间作用力,有效降低了Mn 的溶损。 H.R.Lee 等[7]研究了F-掺杂的锰系锂离子筛。 他们将F-加入到Li[Li0.05Al0.10Mn1.85]O4中,再进行处理后得到F-掺杂的锂铝锰氧化物。 此举虽然可以通过增强静电作用来提升材料的稳定性, 但阴离子的加入同时增大了Jahn-Teller 效应,反而不利于降低锰的溶损。 禹筱元等[8]研究了铬和氟的协同掺杂, 制备了LiMn2-xCrxO4-3xF3x前驱体,经酸洗脱后的离子筛锂离子脱嵌可逆性和循环性较掺杂前均有所提升。从当前的掺杂研究报道可以看出,阳离子掺杂的效果相对较好, 但大部分研究集中在低价态金属阳离子上, 其实高价态元素的掺杂更容易与锂、氧结合,是今后研究的重要方向之一。 本研究用高温固相和离子交换法制备了锰氧化物锂离子筛,用Al3+和La3+对其进行掺杂改性,有望提高离子筛的吸附性能。
1 实验部分
1.1 实验试剂与仪器
试剂:二氧化锰(MnO2)、氢氧化锂(LiOH·H2O)、氯化镧(LaCl3·H2O)、硝酸铝[Al(NO3)3·9H2O]、硫酸锂(Li2SO4·H2O)、盐酸(HCl),所有试剂均为分析纯。实验用水为一次蒸馏水。
仪器:Sx2-5-12 型陶瓷纤维马弗炉;X′Pert Pro型X 射线衍射仪;JSM-5610LV/INCA 系列扫描电镜;iS50FT-IR 傅里叶变换红外光谱仪;Sartorius PB-10 型酸度计;ICS-5000 型多功能离子色谱仪。
1.2 制备LiMnO 前驱体
按n(Mn4+)∶n(Li+)=0.05∶0.05 分别称取4.35 g 二氧化锰和2.1 g 氢氧化锂放入研钵中,研磨数小时后将混合样品转入陶瓷坩埚中于700 ℃在马弗炉中煅烧8 h。 煅烧结束后待马弗炉自然冷却后取出样品,研磨至粉状颗粒即得到锂锰氧化物(LiMnO)前驱体。 按n(Mn4+)∶n(Li+)∶n(La3+)=0.05∶0.05∶0.003 5,分别称取4.35 g 二氧化锰、2.1 g 氢氧化锂和0.928 1 g氯化镧, 按上述实验步骤制备La3+掺杂的锂锰氧化物前驱体。 按n(Mn4+)∶n(Li+)∶n(Al3+)= 0.05∶0.05∶0.002 5, 分别称取4.35 g 二氧化锰、2.1 g 氢氧化锂和0.937 8 g 硝酸铝, 按上述实验步骤制备Al3+掺杂的锂锰氧化物前驱体。
1.3 HMnO 锂离子筛的制备
将制得的锂锰氧化物前驱体(LiMnO)和Al3+、La3+掺杂得到的前驱体分别在相同条件下于500 mL 0.6 mol/L 盐酸溶液中搅拌24 h, 使Li+和H+充分发生离子交换反应。抽滤,水洗,将所得滤饼在80 ℃烘箱中烘干即得到HMnO 型锂离子筛。
1.4 化学组成的确定
分别称取0.1 g LiMnO、Al-LiMnO 和La-LiMnO前驱体,加入30%的H2O2溶液和0.5 mol/L 的盐酸(总体积为12 mL),待样品充分溶解之后,取上清液过滤,用等离子体发射光谱仪(ICP)测定其中Li+、Mn2+、La3+、Al3+的浓度。 再经计算得到前驱体的化学组成。
1.5 吸附实验
称取0.114 3 g 硫酸锂置于烧杯中,用蒸馏水溶解后分多次转移至250 mL 容量瓶中定容得到50 mg/L 的Li+溶液。分别将0.25 g 未掺杂、Al3+和La3+掺杂的锰氧化物锂离子筛(HMnO)置于3 份250 mL 50 mg/L 的Li+溶液中(pH 约为11.0),室温下磁力搅拌使溶液匀速转动发生吸附反应。 对3 份吸附体系分别在不同时刻取1 mL 上清液置于50 mL 容量瓶中加蒸馏水稀释定容,摇匀后待检测Li+浓度。
吸附容量q(mg/g)用以下公式计算。
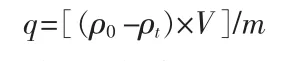
其中:ρ0为Li+初始质量浓度,mg/L;ρt为某时刻时Li+质量浓度,mg/L;V为溶液体积,L;m为吸附剂质量,g。
2 结果与讨论
2.1 产物的表征
2.1.1 物相结构分析
图1 为制备产物前驱体LiMnO、Al-LiMnO、La-LiMnO 和酸洗后锰氧化物锂离子筛HMnO、Al-HMnO、La-HMnO 的XRD 图。 从图1 可以看出,所有前驱体的衍射谱图分别在2θ 为18.8、36.5、38.2、44.4、48.6、58.7、64.5、67.9°位置处均出现了特征衍射 峰,可 归 属 于Li4Mn5O12的(111)、(311)、(222)、(400)、(331)、(511)、(440)、(531)衍射晶面,表明经高温固相反应合成的前驱体材料主要为尖晶石结构Li4Mn5O12[9]。 另外,样品的峰形尖锐、半峰宽较窄且衍射强度较强,表明产物的结晶度较好,晶型较完善[10]。仔细观察可以发现,未掺杂前驱体样品Li4Mn5O12中出现了Li2MnO3的杂相峰, 而La3+掺杂前驱体样品La-Li4Mn5O12中出现了LaMnO3.26的杂相峰。 表明上述两种前驱体中含有杂质,样品纯度不够高。表1 显示的是前驱体分子式的组成。 从表1 可以看出,Al3+和La3+均掺入到了尖晶石型锰氧化物骨架结构中,但掺入量因起始加入量和离子性质的不同而不同。另外, 因前驱体中含有不同种类和数量的含Mn 杂相,致使最终确定的化学式组成与理想式Li4Mn5O12中的n(Li)/n(Mn)有一定差别。 但3 种前驱体经盐酸溶液洗涤后,所有杂相峰均消失,锂锰氧化物的峰型基本没有发生变化,只是向右稍微有所偏移。该结果说明盐酸洗涤过程中虽然发生了Li+与H+的交换,在一定程度上改变了晶胞参数,使晶格有所收缩[9],但这并不会影响尖晶石的结构。经计算,盐酸洗脱后LiMnO、Al-LiMnO 和La-LiMnO 中Li+发生离子交换的物质的量分别为5.34×10-4mol,7.93×10-4mol 和6.44×10-4mol。表明Al3+掺杂的离子筛产生的活性吸附位点最多,La3+掺杂的离子筛次之, 不掺杂的锰氧化物拥有的吸附位点最少。

图1 锰氧化物锂离子筛及前驱体的XRD 图

表1 前驱体分子式的确定
2.1.2 形貌分析
图2 为前驱体LiMnO、Al-LiMnO、La-LiMnO 和酸洗后锰氧化物锂离子筛HMnO、Al-HMnO、La-HMnO 的扫描电镜照片。 由图2 可知, 未掺杂样品Li4Mn5O12前驱体呈现不规则纳米片状和棒状形貌,片层厚度约为200~300 nm;部分棒状展示出交叉生长的情况,长径比约为5∶1。 经盐酸洗涤后锰氧化物锂离子筛HMnO 的形貌基本没有发生变化,仍然呈现片状和棒状的混合形态。 说明离子交换酸洗过程对样品形貌基本没有影响。 La3+掺杂的前驱体La-LiMnO 和酸洗后的锂离子筛La-HMnO 均呈现出纳米颗粒形貌,尺寸大小不一,并伴有一定程度团聚现象,这应归因于材料较高表面能[11]。仔细观察可以发现材料的微观形貌中伴有极少量的多面体结构,这可能与尖晶石结构中含有微量的LaMnO3.26杂相有关。Al3+掺杂的前驱体Al-LiMnO 和酸洗后的锂离子筛Al-HMnO 同样呈现出纳米颗粒形貌, 后者颗粒尺寸相对较小。上述研究结果表明,经高温固相反应合成的LiMnO 前驱体与酸洗后的锰氧化物锂离子筛HMnO 形貌基本相同, 不同类型的金属离子掺杂对产物形貌和颗粒尺寸存在一定程度的影响。

图2 锰氧化物锂离子筛及前驱体的SEM 图
2.1.3 红外光谱分析
图3 为酸洗后锰氧化物锂离子筛HMnO、Al-HMnO 和La-HMnO 的红外光谱图。 由图3 可以发现,HMnO 在3 451 cm-1和1 637 cm-1位置处出现了较强的吸收峰, 可分别归属于水中—OH 的伸缩和弯曲振动峰[12],表明产物中含有吸附水。 同时,在544 cm-1和495 cm-1处也出现了吸收峰, 可归属于HMnO 中Mn—O 键的特征吸收峰[13],表明产物中含有锰氧化物。 Al-HMnO 和La-HMnO 的红外光谱图与未掺杂的HMnO 相似,均含吸附水和[MnO6]八面体,却没有显示出Al—O 和La—O 键强的特征吸收峰。 这可能与掺杂的Al3+和La3+量少有关,并且金属氧化物的红外特征吸收峰在800 cm-1波数以下有重合现象。 另外,3 种锂离子筛在约880 cm-1处均呈现出相同的吸收峰,这可能与H 型尖晶石的晶格耦合振动[14]有关,进一步证实了前驱体脱Li+后,尖晶石锰氧化物锂离子筛的结构依然稳定。
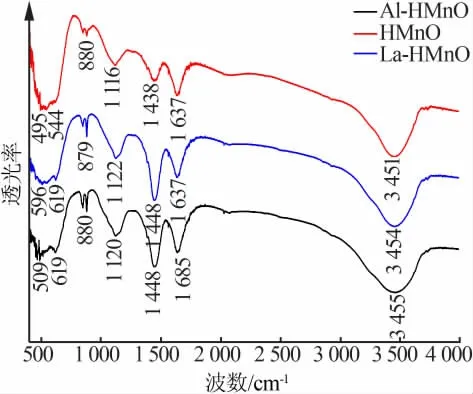
图3 锰氧化物锂离子筛的红外光谱分析图
2.1.4 能谱分析
为了证明La3+和Al3+是否掺杂到锂锰氧化物前驱体结构中,进行了样品的能谱分析。 图4 为掺杂La3+和Al3+锂锰氧化物前驱体的能谱图。 从图4 可以看出, La-LiMnO 前驱体中含有Mn、O、La、Cl、Al 5 种元素。 表明La3+被成功掺入LiMnO 化合物中,同时样品含有微量Cl 和Al 元素杂质。Al-LiMnO 前驱体中含有Mn、O、Al、Na、S 5 种元素。 其中,锂锰氧化物中的Mn、O 含量较高,掺入的Al3+含量居中,Na、S 为原料中微量杂质。 上述结果表明,在马弗炉高温煅烧制备前驱体锂锰氧化物过程中,La3+和Al3+的掺杂是成功的。
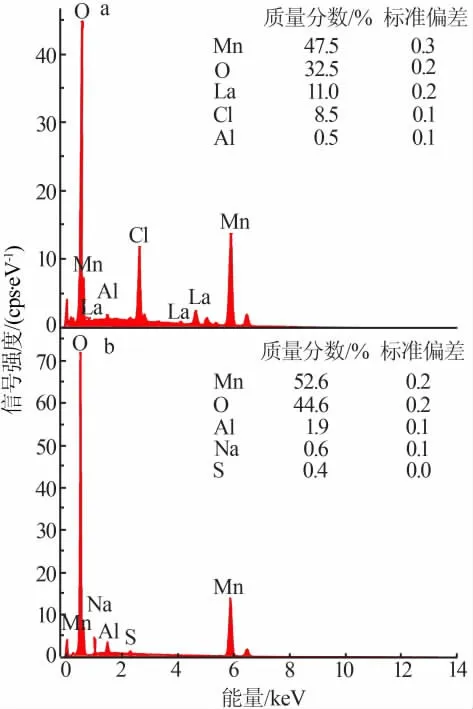
图4 掺杂锂锰氧化物前驱体的能谱图
2.2 锰氧化物锂离子筛的吸附性能
图5 为HMnO、Al-HMnO 和La-HMnO 在不同时间下对溶液中Li+吸附容量的对比图。 由图5 可知,在2 min 时,La-HMnO 的吸附容量为9.77 mg/g,高于Al-HMnO(3.83 mg/g)和HMnO(1.77 mg/g)的吸附容量。 20 min 时,La-HMnO 和Al-HMnO 的吸附容量分别为16.58 mg/g 和17.57 mg/g, 远远高于HMnO 的吸附容量(4.14 mg/g),且接近于吸附平衡。表明掺杂后锰氧化物锂离子筛的吸附速率较快,这可能与吸附剂内部的孔结构与微观形貌有关[15]。当吸附时间达到90 min 时,Al-HMnO、La-HMnO和HMnO 对Li+的吸附容量分别为18.86、13.74、6.85 mg/g。 表明Al3+、La3+的掺杂使锰氧化物锂离子筛的吸附容量有所提高。这是因为Al—O 键(512 kJ/mol)和La—O 键(799 kJ/mol)的键能均大于Mn—O 键(360 kJ/mol)[16], 掺杂后Al3+和La3+会部分取代锰氧化物骨架结构中的Mn3+,使得Mn4+/Mn3+数量比增大,Mn 元素的平均氧化数升高,从而减少Mn3+的歧化反应,降低了Jahn-Teller 畸变。 另外,La—O 键和Al—O 键较Mn—O 键更加稳定,在实际过程中不易断裂, 这在一定程度上有利于尖晶石结构趋于稳定化,循环性能得以改善[17]。 研究表明,对于尖晶石型锰氧化物锂离子筛,Li+的嵌入和脱出能力取决于尖晶石结构中吸附位点的数目、 分布以及具有可进行离子交换的H+含量[18]。 本文将Al3+和La3+掺入尖晶石型锂锰氧化物前驱体结构中后, 经酸洗脱产生的可交换H+数目有所提升,即活化了材料的离子交换位置,从而更有利于Li+的吸附[15]。

图5 时间对锰氧化物锂离子筛锂吸附容量的影响
3 结论
1)用高温煅烧和离子交换技术制备了HMnO、Al-HMnO 和La-HMnO 这3 种尖晶石型锰氧化物锂离子筛。酸洗对样品的形貌基本无影响,但有利于除去Li2MnO3和LaMnO3.26杂相。2)HMnO、Al-HMnO和La-HMnO 对溶液中的Li+具有一定吸附能力,且Al3+、La3+掺杂后提锂性能有所提高。这与掺杂离子部分取代锰氧化物骨架中的Mn 元素后,降低了Jahn-Teller 畸变效应,使尖晶石结构趋于稳定,同时活化了材料的离子交换位置有关。

