紫苑环肽对氧化胁迫下酿酒酵母细胞的保护作用
朱作艺,张玉,王君虹,李雪,王伟,2*
(1.浙江省农业科学院 农产品质量标准研究所,浙江 杭州 310021;2.浙江省植物有害生物防控重点实验室—省部共建国家重点实验室培育基地,浙江 杭州 310021)
紫苑(AstertataricusL.F.)为菊科植物的干燥根及根茎,作为传统中药已经具有2 000多年的历史,具有润肺下气、化痰止咳的功能[1],主要分布于东北、华北地区,以及甘肃、安徽等省,现已在国内大面积种植。紫苑环肽(astins)是从紫苑根茎中分离出来的一类卤代的环五肽类,目前已鉴定的紫苑环肽结构有3种,分别为astin A、astin B和astin C。有文献报道,astin A、astin B和astin C具有抗肿瘤活性[2]、诱导细胞凋亡和自噬的作用[3]。
酵母细胞同其他真核生物一样,在生长过程中要不断承受来自内外环境的压力。正常需氧条件下,酵母细胞中的代谢副产物会产生超氧阴离子、羟基自由基和过氧化氢等内源性活性氧物质(reactive oxygen species,ROS)。外界环境中的电离辐射、氧化还原剂或重金属等也能刺激细胞产生这些活性氧形态。在氧化胁迫条件下,酵母会产生过多的活性氧自由基。当细胞中累积的这些活性氧物质超过了细胞抗氧化防御缓冲能力时,会对酵母细胞的许多重要生物大分子发生不可逆转的氧化损伤,使核酸、蛋白质、膜多不饱和脂肪酸等出现交联或断裂,导致细胞结构和功能的破坏,甚至造成细胞死亡[4-8]。
本文建立以H2O2为氧化诱导剂的酿酒酵母细胞模型,从细胞存活率、细胞生长表型分析和ROS含量等不同方面来研究紫苑环肽(astin A和astin B)对氧化受损的酵母细胞的保护作用,为进一步研究紫苑环肽活性物质和后续的功能食品、保健品开发提供参考。
1 材料与方法
1.1 供试材料
紫苑环肽(astin A,纯度95%;astin B,纯度95%,吉尔生化(上海)有限公司合成);野生型酿酒酵母细胞BY4742(武汉淼灵生物科技有限公司);琼脂粉(青岛高科技工业园海博生物技术有限公司);酵母提取物(杭州微生物试剂有限公司);胰蛋白胨(国药集团试剂有限公司);葡萄糖(国药集团化学试剂有限公司);30%过氧化氢(国药集团化学试剂有限公司);氯化钠(国药集团化学试剂有限公司);酵母破壁酶溶液(上海索莱宝生物技术有限公司);真菌/酵母氧化应激活性氧(ROS)比色法定量试剂盒(上海杰美基因医药科技有限公司);细胞凋亡试剂盒(杭州联科生物公司)。
pH计(FE28,瑞士梅特勒-托利多仪器有限公司);DHP-9602恒温培养箱(上海一恒科学仪器有限公司);SW-CJ-2FD超净工作台(苏州苏净有限公司);MX-S混匀仪(大龙兴创试验仪器(北京)有限公司);紫外-可见光分光光度计(上海佑科仪器仪表有限公司);TDL-60B低速台式离心机(上海安亭设备有限公司);MicroPure UV/UF纯水仪(美国Thermo公司);ACCURI C6流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 紫苑环肽溶液的配制
将5 mg合成的高纯环肽(astin A和astin B)溶于含1%二甲基亚砜(DMSO)的5 mL无菌蒸馏水中,配制成环肽母液,使用时以1∶100比例加入培养基中。
1.2.2 YPD培养基配制
称取20.0 g胰蛋白胨,10.0 g酵母提取物,20.0 g葡萄糖,若配制固体培养基,则再加20.0 g琼脂粉。将上述成分加入到1 000 mL蒸馏水中,加热溶解,调节pH至7.2±0.2,分装后于121 ℃高压灭菌15 min。
1.2.3 生理盐水配制
称取氯化钠8.5 g,加入1 000 mL蒸馏水,加热溶解,分装后121 ℃高压灭菌15 min。
1.2.4 试验细胞分组
从平板上挑取酵母菌于YPD培养基中30 ℃预培养,以终浓度D600=0.05转移至新鲜YPD中培养至对数期,收集细胞调节浓度至D600=2.0(为酵母细胞生长对数期,使细胞浓度大约为5×107CFU·mL-1)。按照以下分组,加入2种环肽和2 mmol·L-1H2O2处理酵母细胞,每组设置3个平行试验。
NC:YPD+2 mmol·L-1H2O2;astin A:YPD+10 mg·L-1astin A;astin B:YPD+10 mg·L-1astin B;H2O2+ astin A:PD+2 mmol·L-1H2O2+10 mg·L-1astin A;H2O2+ astin B:YPD+2 mmol·L-1H2O2+10 mg·L-1astin B。
1.2.5 酵母细胞表型生长观察
按照上述分组处理酵母细胞,37 ℃作用90 min后离心收集菌体,用无菌生理盐水清洗药物,并重悬于1 mL生理盐水中,然后进行梯度稀释,每个梯度按1∶10进行稀释,直至稀释到1∶1 000,然后将每个稀释浓度从高浓度到低浓度各取5 μL,按照从左到右顺序依次滴加于YPD固体平板上。待菌液完全渗透到培养基后,将平板倒置30 ℃培养2 d。将培养完成后的YPD平板进行拍照记录。
1.2.6 酵母活性氧(ROS)测定
按照上述分组处理酵母细胞,37 ℃作用2 h后离心收集菌体,用无菌生理盐水清洗药物,弃上清液。按照真菌/酵母氧化应激活性氧(ROS)比色法定量试剂盒说明书测定各组酵母菌活性氧含量。
1.2.7 流式细胞仪检测细胞坏死凋亡
按照上述分组处理酵母细胞,37 ℃作用2 h后离心收集细胞,用生理盐水洗涤2次,加入500 μL 15U·mL-1酵母破壁酶溶液,28 ℃培养1 h进行去壁。离心收集细胞,用生理盐水去除酶液,将细胞重悬在100 μL Binding Buffer上样缓冲液中。先在每个样品加入5 μL Annexin V,混匀且室温下避光10 min,之后在每个样品中加入5 μL PI。室温下避光反应5 min。之后再加入400 μL Binding Buffer上样缓冲液,进行流式细胞仪分析。
2 结果与讨论
2.1 紫苑环肽对酿酒酵母细胞表型生长情况的影响
从不同组别菌液在YPD平板上生长状态(图1)可知,在培养菌液中加入2 mmol·L-1H2O2(YPD+H2O2组),相较于YPD+10 mg·L-1astins环肽组,其菌落成活率在稀释1 000倍时有明显下降,然而向氧化胁迫的酵母细胞体系中加入环肽干预(YPD+H2O2+10 mg·L-1astins环肽组),可明显提高酵母细胞的成活率。从1∶1 000倍稀释的菌液在YPD平板上生长状态可知,YPD+H2O2+10 mg·L-1astin A组别的酵母细胞成活率高于YPD+H2O2+10 mg·L-1astin B组。表明在氧化胁迫体系中,紫苑环肽astin A对酵母细胞的保护效果优于紫苑环肽astin B。
2.2 紫苑环肽对酿酒酵母细胞活性氧含量的影响
通过检测不同组别真核细胞(酵母)的活性氧ROS含量的变化情况,研究紫苑环肽对氧化胁迫条件下酵母细胞的保护作用。由图2可知,对照组ROS含量显著高于astin A和astin B,说明在H2O2的氧化胁迫下,酵母细胞内ROS含量明显上升,astin A和astin B的ROS含量显著下降,其他各组活性氧ROS含量相较于对照组均有显著降低(P<0.05)。
2.3 紫苑环肽对酵母细胞坏死凋亡情况的影响
由图3可知,加入H2O2后的酵母菌出现大量坏死,细胞坏死率为96.5%,极显著高于其他处理。astin A处理的细胞坏死率和凋亡率均为0.8%,而H2O2+astinA处理组细胞坏死率和凋亡率分别为30.7%和0.7%;astin B处理的细胞坏死率和凋亡率分别为0.8%和0.6%,而H2O2+astin B处理的细胞坏死率和凋亡率分别为35.9%和1.5%。由此可知,紫苑环肽对正常酵母细胞无损伤作用,但可显著降低酵母细胞的坏死率(P<0.001),通过分别加入10 mg·L-1的astin A和astin B至H2O2处理的酵母细胞,其坏死率从96.5%分别降至30.7%和35.9%,表明紫苑环肽对氧化胁迫的酵母细胞具有明显的保护作用。
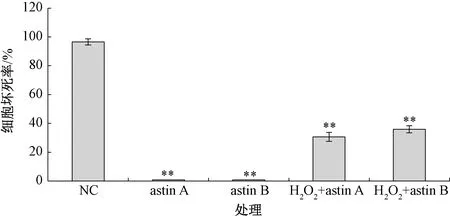
**表示与对照比差异极显著(P<0.01)。
3 小结
通过研究氧化胁迫的野生型酿酒酵母细胞在紫苑环肽作用下的生长表型情况、活性氧含量及细胞坏死凋亡情况,证实紫苑环肽对由H2O2引起的氧化损伤酿酒酵母细胞具有保护作用。试验结果表明,紫苑环肽能显著提高氧化胁迫下酿酒酵母细胞的存活率,降低细胞内ROS含量,这为进一步研究开发紫苑在食品、药品及人类健康方面的应用提供了重要依据。

