四季草莓成花关键基因的表达分析
杨梦婷,余红,忻雅,庞基良*
(1.杭州师范大学 生命与环境科学学院,浙江 杭州 310036;2.杭州市农业科学研究院 生物技术研究所,浙江 杭州 310024)
草莓(Fragaria×ananassaDuch.)属蔷薇科多年生草本植物,不仅有独特的口味还有较高的营养价值,是最受生产者和消费者欢迎的水果之一,素有“水果皇后”之称,其生产遍布世界各地,目前中国的草莓栽培面积和产量均居世界第一[1]。我国虽然拥有极为丰富的野生草莓资源,但几乎均为一季结果型草莓,较长的夏秋季节(6—11月)是草莓生产空缺期,市场上几乎没有新鲜草莓上市,远远不能满足人们对草莓的周年需求。1997年,山东农业大学罗新书教授从美国和加拿大引进2个草莓新品种[2],其一年四季结果的特性,解决了我国夏秋季节无草莓供应的市场问题,实现了草莓的周年生产与供应。这说明了草莓开花时间调控的研究具有一定的经济及市场效应。
目前,我们对栽培草莓开花的环境控制及激素影响已进行了广泛的研究[3-7],但对草莓内在的成花调控的分子机制了解甚少。LFY、SOC1、AP1和FT及其同源开花基因在高等植物的成花过程中具有重要作用。LFY基因是目前研究最多,了解最清楚的一个基因,不仅控制着花序分生组织向花分生组织的转变,而且还控制着开花时间[8]。相关报道显示,草莓LFY基因在成花初期的花芽中表达量最高,说明其在促进花形成过程中发挥作用[9]。SOC1基因能够与其他基因相互作用共同调节植物开花时间以及花的类型及花分生组织。相关研究显示,SOC1基因的过表达可以有效地促进早花,而SOC1突变体则会引起开花时间的延迟[10-12]。已有报道,草莓SOC1基因与其他SOC1同源物具有高度同一性,含有保守的MADS结构域和SOC1基序,是草莓中的开花促进剂[13]。AP1基因既属于花分生组织特征基因,又是花器官形态特征基因,在控制植物花分生组织特性与花器官的形成过程中起着重要的作用[14]。有研究表明,草莓AP1基因的表达与草莓的生殖生长密切相关,推测其在草莓花分生组织形成和花器官发育中有一定的调控作用[15]。FT基因编码的蛋白产物可以长距离转运成花激素,所以是植物成花转变过程中的关键调控因子,对花的形成具有决定作用[16-17]。已有研究证明,短日或低温刺激会诱导草莓FT基因表达从而促进开花[18],更有猜测草莓FT基因在草莓低温休眠和果实膨大过程中发挥重要作用[19]。
近年来,科学家们相继在草莓中克隆得到成花关键基因,并对其功能进行研究,但有关草莓成花的分子调控网络还有待揭示,尚未见一季草莓与四季草莓成花分子差异的相关报道。因此,本研究将对一季草莓品种章姬与四季草莓品种蒙特瑞的4个成花关键基因LFY、SOC1、AP1和FT的表达量进行比较分析,初步探讨四季草莓周年开花的机制,为进一步了解草莓成花分子机理奠定基础,为其他农作物培育四季品种提供理论依据。
1 材料与方法
1.1 材料
一季草莓品种章姬与四季草莓品种蒙特瑞于2018年11月20日从杭州市农业科学研究院草莓种植基地移栽至杭州师范大学塑料大棚内,进行常规栽培管理。于2019年1月至5月间进行取样,每次取样时间间隔约半个月(1月15日、1月30日、2月15日、2月28日、3月15日、3月30日、4月15日、4月30日、5月15日、5月30日),样品皆为嫩叶,每份样品约1 g,重复3次。
1.2 引物
利用Primer Premier 5软件设计LFY基因引物,其余引物参照Nakano等[18]和Lei等[13],引物序列见表1。

表1 本研究所用的引物序列
1.3 RNA的提取
用AxyPrep总RNA小量制备试剂盒提取总RNA。利用1.0%的琼脂糖凝胶电泳检测总RNA的完整性,用核酸蛋白分析仪检测RNA的纯度。
1.4 RT-PCR
反转录体积为20 μL在0.2 L反应管中加入总RNA 7 μL、Primer Mix 2 μL、dNTP Mix 4 μL、DTT 2 μL、RT Buffer 4 μL、HiFiSript 1 μL,混匀后先42 ℃孵育15 min,再85 ℃孵育5 min,然后迅速置于冰上冷却,完成反转录反应。取1 μL cDNA用核酸蛋白分析仪检测其纯度。取1 μL cDNA加入5 μL 2×Trans Mix,0.5 μL上下游引物,1 μL DNA,3 μL ddH2O进行PCR扩增。PCR反应程序为94 ℃预变性5 min;94 ℃变性35 s,55 ℃退火45 s,72 ℃延伸45 s,36个循环;72 ℃延伸10 min。用1.0%的琼脂糖凝胶电泳检测扩增产物。
1.5 实时荧光定量RT-PCR
实时荧光定量RT-PCR反应体系为10 μL,包括0.5 μL cDNA(400 ng·μL-1),浓度为10 μmol·L-1的上下游引物各0.2 μL,5 μL 2×UltraSYBR Mixture(High ROX),最后用ddH2O补足到10 μL。以草莓Actin为内参基因,每个样本做4次重复,反应条件如下:95 ℃ 10 min;95 ℃ 10 s,58 ℃ 30 s,72 ℃ 32 s,38个循环。采用2-△△Ct法计算相对表达量的高低。
2 结果与分析
2.1 不同时期蒙特瑞与章姬嫩叶总RNA检测
用AxyPrep总RNA小量制备试剂盒成功提取到草莓总RNA,1%琼脂糖凝胶电泳检测结果(图1)显示,28S rRNA和18S rRNA两条谱带清晰明亮,且都没有明显的拖带,D260/D280比值为1.91~2.06,说明提取的RNA较纯净,无蛋白及化学试剂污染,可以用于反转录、常规PCR以及定量PCR等后续研究。
2.2 草莓成花关键基因的实时荧光定量RT-PCR分析
实时荧光定量RT-PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,使得每一个循环可见,最后通过标准曲线对未知模板进行定量分析的方法[20]。本实验利用2-△△Ct方法进行一季草莓品种章姬与四季草莓品种蒙特瑞不同时期LFY、SOC1、AP1和FT基因的相对定量计算。以2019年1月15日所取的材料作为对照,其LFY、SOC1、AP1和FT基因的表达量定义为1个单位,对其他阶段的表达量进行定量分析。结果表明:LFY、SOC1、AP1和FT四个基因在一季草莓章姬和四季草莓蒙特瑞中不同时期的表达趋势基本一致。1月15日至1月30日,蒙特瑞和章姬的LFY基因表达都呈现上升趋势,而3月15日至4月15日都呈下降趋势。章姬中LFY基因表达峰值出现在2月28日;而蒙特瑞中LFY基因表达峰值出现在3月15日(图2)。5月15日,蒙特瑞和章姬的SOC1基因均出现表达高峰。蒙特瑞中SOC1基因相对表达量在整个实验时期整体均高于章姬中的SOC1基因。1月15日至 1月30日,蒙特瑞和章姬中AP1基因表达都呈上升趋势,随后章姬继续上升,并于3月15日出现表达峰值;而在蒙特瑞中AP1基因表达在1月30日之后呈现下降趋势,直至2月28日才重新呈上升趋势,其表达峰值同样出现在3月15日。1月15日至5月30日,章姬中FT基因相对表达量始终高于蒙特瑞中FT基因相对表达量,且在3月15日,均出现表达高峰。

1~3为蒙特瑞的RNA;4~6为章姬的RNA;A~J为不同取材时间提取的RNA,取材时间分别为2019年1月15日、1月30日、2月15日、2月28日、3月15日、3月30日、4月15日、4月30日、5月15日、5月30日。
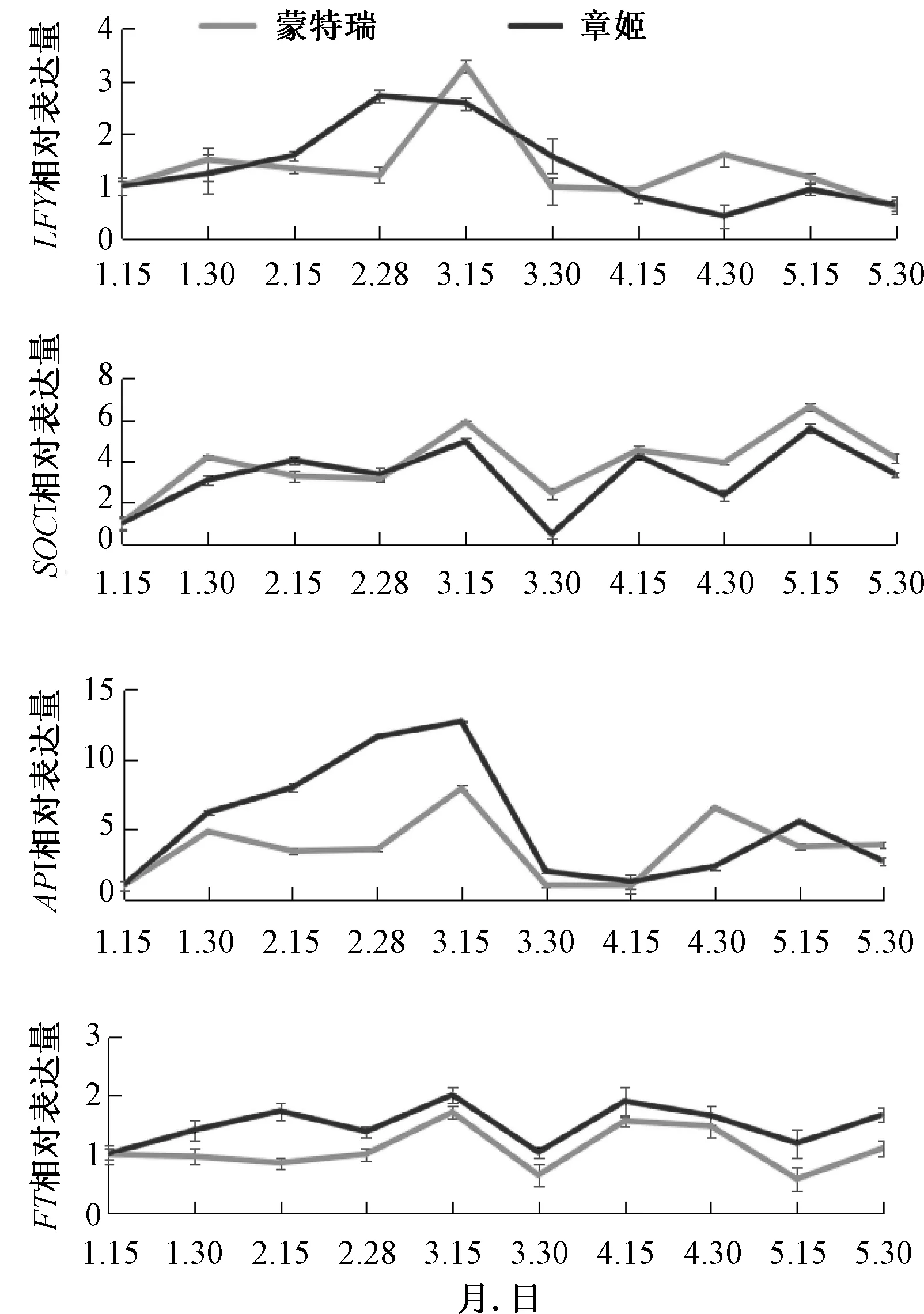
图2 蒙特瑞和章姬不同时期嫩叶中FaLFY、FaSOC1、FaAP1和FaFT基因的相对表达量
3 讨论
成花转变是植物生长发育中的重要过程,这一转变受遗传和环境等多因子控制[21]。近年来,人们已应用分子生物学技术克隆了多种作物的一系列成花相关基因,并深入研究了这些基因的调控机理[22-24]。LFY基因是植物的花分生组织特征基因,是目前研究最透,也是最重要的基因。该同源基因在很多植物中都在花序分生组织转变为花分生组织和成花诱导过程中发挥作用[25-27]。LFY基因不仅可以控制花序分生组织向花分生组织的转变[28],还控制开花时间[8]。从本研究结果中可以发现,一季草莓章姬在2月28日表达量最高,大约两个半月后(5月15日)其表达量出现小峰值;四季草莓蒙特瑞在3月15日表达量最高,1月30日与4月30日其表达量都出现小峰值,三者时间间隔皆为一个半月,并且2个小峰值均高于章姬的小峰值,说明LFY在促进四季草莓周年成花形成过程中发挥了重要作用。
SOC1是MADS-box基因家族的一员,能够整合来自光周期途径、春化途径、自主途径和赤霉素途径的花时基因信号[10,29],进而募集其他功能蛋白或与功能蛋白互作[30],改变染色质结构形态并作用于下游花分生组织特异基因,从而促进植物的开花。本研究中,SOC1在蒙特瑞和章姬中都稳定表达,但在蒙特瑞中不同时期的SOC1表达量都普遍高于章姬,表明SOC1是调控四季草莓成花转变的重要基因。AP1也是调节花发育的重要基因,其功能与LFY部分冗余,表达时期晚于LFY,两者具有加性效应,能相互促进表达[31]。AP1/FUL在拟南芥与烟草中的直向同源基因的过表达会导致早期开花,并且这些基因可以调节不同的下游基因以执行不同的花发育相关功能[32-33]。在本研究中,AP1基因与LFY基因的表达趋势基本一致,但AP1基因表达量整体远高于同期LFY基因的表达值,且在1月30日至3月15日,章姬中AP1基因的表达量变化波动较大,而蒙特瑞基本稳定表达,这可能就导致了章姬只能一季成花。
许多研究表明,FT基因及其同源物可以调节植物开花[34-36]。在拟南芥中发现,FT基因对花的形成具有决定作用[16-17]。Nakano等[18]在草莓中发现,FT基因在环境诱因控制的花感应中起重要作用,且其表达相比叶片光周期信号的调节,更显著地受到温度的调控。在本研究中,FT基因在蒙特瑞和章姬中都稳定表达,且章姬中的表达量始终高于蒙特瑞中的表达量,FT基因对四季草莓成花的作用或受到多基因多途径调控,其表达丰度差异不显著。

