生物炭对桃园土壤微生物功能多样性的影响
刘涛,应建平,张涛,谢乐添
(1.杭州市原种场,浙江 杭州 311300;2.浙江农林大学 林业与生物技术学院,浙江 杭州 311115)
土壤是农业生产及生态系统的基础[1],既是作物生长的重要介质,也是维持作物群体生产力、影响生态环境质量的重要因素[2]。微生物是土壤的重要组成部分,在土壤养分循环、有机质矿化、腐殖质合成和毒物分解等多种土壤生物化学反应中扮演着重要角色[3-4],与土壤肥力密切相关。微生物对分解土壤有机质、促进腐殖质形成、改善土壤理化性质、增强土壤酶活性及促进植物生长、吸附和转化有机污染物和重金属等方面起着重要作用[5-8]。土壤微生物群落功能多样性是土壤微生物群落状态与功能的指标,反映了土壤中微生物的生态特征。微生物群落功能为评价微生物多样性提供了一个可行的、生态相关的测量方法[9]。而BIOLOG代谢多样性类型与微生物群落组成相关[10],使其对功能微生物群落变化较为敏感。微生物的生物量自身含有一定数量的碳、氮、磷、硫等,可看成是一个有效养分的储备库,对土壤养分具有储存和调节作用,具有“源与库”的调控功能[11]。微生物生物量能敏感地反映土壤过程的变化,因为它比土壤有机物周转更快。
生物炭是生物质在低氧或缺氧条件下通过高温裂解碳化,形成的高度芳香化、富含碳的多孔颗粒固体[12]。研究表明,在土壤中加入生物炭,不但对增加土壤肥力、均衡土壤有机碳库有重要意义[13],还可以延缓作物肥料养分在土壤中的释放,减少养分的损失,提升肥料养分在作物中的利用率[14]。张秀等[15]研究表明,往镉污染的土壤中施用生物炭,能提高土壤中微生物群落碳源代谢活性及功能多样性,效果最好的为2.5%生物质炭处理。武爱莲等[16]研究发现,施用生物炭会降低褐土中微生物的活性,并且减少或改变褐土中微生物碳源利用的种类,使土壤原有微生物群落组分发生改变。此外,微生物肥料在果树上的应用研究近年来也取得较大进展。何明莉等[17]在苹果、桃、葡萄等多种果树上施入酵素菌豆粕生物有机肥后,树势有所增强,产量明显高于对照,且明显提升果实品质。施用微生物肥料可提高土壤肥力,改善土壤理化性质。微生物肥料可分解土壤中难溶性磷酸盐,提高磷肥的利用率。研究认为,磷细菌肥料产生胞外磷酸酶,可催化磷酸酯或磷酸酐等有机磷水解为有效磷[18]。
生物炭肥和微生物肥的单独应用已有许多研究,但联合应用的研究较少。本试验通过土壤中添加生物炭肥和微生物肥试验,旨在探讨其对土壤理化性质和土壤微生物群落结构的影响。
1 材料与方法
1.1 材料
试验地设在杭州玉渚农业科技有限公司的水蜜桃果园,水蜜桃品种为夏之梦,树龄均为8年。本试验中所采用的生物炭购自溧阳市德胜活性炭厂,所采用的微生物肥购自山东木美土里生物科技有限公司。
1.2 处理设计
试验共设6个处理。以不施生物炭和微生物肥为对照(CK);不施生物炭+施微生物肥(BF);低量生物炭+不施微生物肥(BC1);低量生物炭+施微生物肥(BC1+BF);高量生物炭+不施微生物肥(BC2);高量生物炭+施微生物肥(BC2+BF)。每处理重复3次,每重复15棵树。具体施用量为:BF处理的微生物肥施量为0.75 kg·m-2;BC1处理的低量生物炭施量为2 kg·m-2;BC2的高量生物炭施量为4 kg·m-2,土地翻耕深度均为35 cm。
1.3 测定方法
采集每个处理桃树主根周围50 cm处的土壤,随机3处取表面20 cm的土壤,同一果树的土壤取完土壤后立刻混匀,使用冰盒保存,于当日取部分土壤经20目(孔径0.84 mm)过筛并风干,用于土壤碱解氮、速效磷、速效钾含量的测定;取部分土壤经100目(孔径0.149 mm)过筛并风干,用于土壤全氮、有机质含量的测定;取部分土壤经20目过筛,于-20 ℃冰箱保存,用于土壤微生物量、含水量测定,以及Biolog微平板实验。
1.3.1 土壤理化性质测定
土壤碱解氮含量测定。扩散吸收法。取2.00 g过20目筛的土壤和0.2 g FeSO4放在扩散皿的外室,2 mL硼酸混合指示剂(2.0 g硼酸+20 mL混合指示剂,调pH至4.5定容至1 L,混合指示剂为0.099溴甲酚绿+0.066甲基红使用100 mL乙醇溶解)放在扩散皿的内室,再在外室加入10 mL的1.0 mol·L-1NaOH水解土壤,水平轻轻旋转扩散皿,使溶液与土壤充分混匀,用橡皮筋固定,随后放入40 ℃恒温箱中,24 h后取出。使用标准酸滴定内室的硼酸混合指示剂,记录颜色从蓝到微红所消耗的标准酸,然后计算土壤中水解性N的含量。
土壤速效钾含量测定。50 mL 1 mol·L-1乙酸铵浸提5.0 g过20目筛的土壤,过滤取2 mL滤液加水定容至50 mL,用火焰分光光度计测定。
土壤速效磷含量测定。以0.03 mol·L-1NH4F+0.025 mol·L-1HCl作浸提剂,将5 g过20目筛的土壤溶解于50 mL浸提剂中,过滤后取10 mL滤液加入10 mL 49 g·L-1的硼酸和二硝基酚,用HCl和NaOH调至微黄,加入5 mL钼锑抗定容至50 mL,用紫外分光光度计测定。
有机质含量测定。0.2 g过100目筛的土壤加入试管中再加5 mL重铬酸钾、5 mL硫酸放上弯颈漏洞放入110 ℃的烘箱中90 min,取出后加水倒入三脚瓶中加入邻菲罗啉使用硫酸亚铁滴定。
土壤全氮含量测定。凯氏定氮法。取1 g过100目筛的土壤放入消煮管中,加入1.1 g混合指示剂(100 g K2SO4+10 g CuSO4+1 g Se粉研磨)和5 mL硫酸放上弯颈漏斗过夜,然后消煮并用定氮仪测定含氮量。
土壤含水量测定。取10 g左右土壤在120 ℃烘箱烘干测定土壤含水量。
1.3.2 土壤微生物量测定
取15 g鲜土放入烧杯中用氯仿熏蒸24 h,另取15 g鲜土放入不加入盛有氯仿的烧杯的真空干燥器中放置24 h作对照组。熏蒸结束后加入60 mL 0.5 mol·L-1的K2SO4震荡离心取上清液,稀释10倍后使用仪器测定。
1.3.3 土壤微生物群落丰富度测定
采用Biolog微平板法测定。称取相当于10.0 g风干土的新鲜土壤,放至盛有100 mL的0.85%生理盐水的250 mL三角瓶中,将其在漩涡振荡器上震动1 min,冰水浴1 min,反复3次,静置2 min后吸取上清液3 mL放入盛有27 mL 0.85%生理盐水的离心管中,即得供试土壤接种液,将其接种到Biolog板上后立刻使用酶标仪扫描,然后放在25 ℃恒温培养箱中陪养,每隔24 h使用酶标仪扫描,试验持续7 d。
微平板孔中溶液吸光值平均颜色变化率(average well color development,AWCD)计算公式:
AWCD=∑(C-R)/31。
式中,C为所测每个有培养基孔(31个)的吸光值,R为对照空白孔的吸光值。
土壤微生物群落多样性指数计算公式:
H(Shannon指数)=-∑PilnPi;
D(Simpson指数)=1-∑Pi2;
U(McIntosh指数)=[∑(ni2)]1/2。
式中,Pi为第i孔的相对吸光值与整个微平板所有相对吸光值总和之比。
1.3.4 数据处理
采用Sigmaplot软件作图;数据采用SPSS 16.0软件进行单因素方差分析,统计分析处理间土壤理化性质、微生物量碳氮、土壤微生物群落丰度之间的差异;多重比较采用Duncan’s法(P=0.05),平均值在P<0.05水平下的任何差异都具有统计学意义。
2 结果与分析
2.1 不同施肥处理对土壤理化性质的影响
由图1可知,除BC1+BF处理的全氮含量显著高于BF处理外,其他各处理间无显著差异;除BC1+BF处理的碱解氮含量显著低于CK外,其他各处理间无显著差异;除BC1+BF处理的速效磷含量高于CK外,其他各土壤处理均明显低于CK,且其间无显著差异;除BC1+BF处理的速效钾含量显著高于CK、BC2+BF处理的速效钾含量显著高于BF外,其他不同土壤处理间无明显差异。
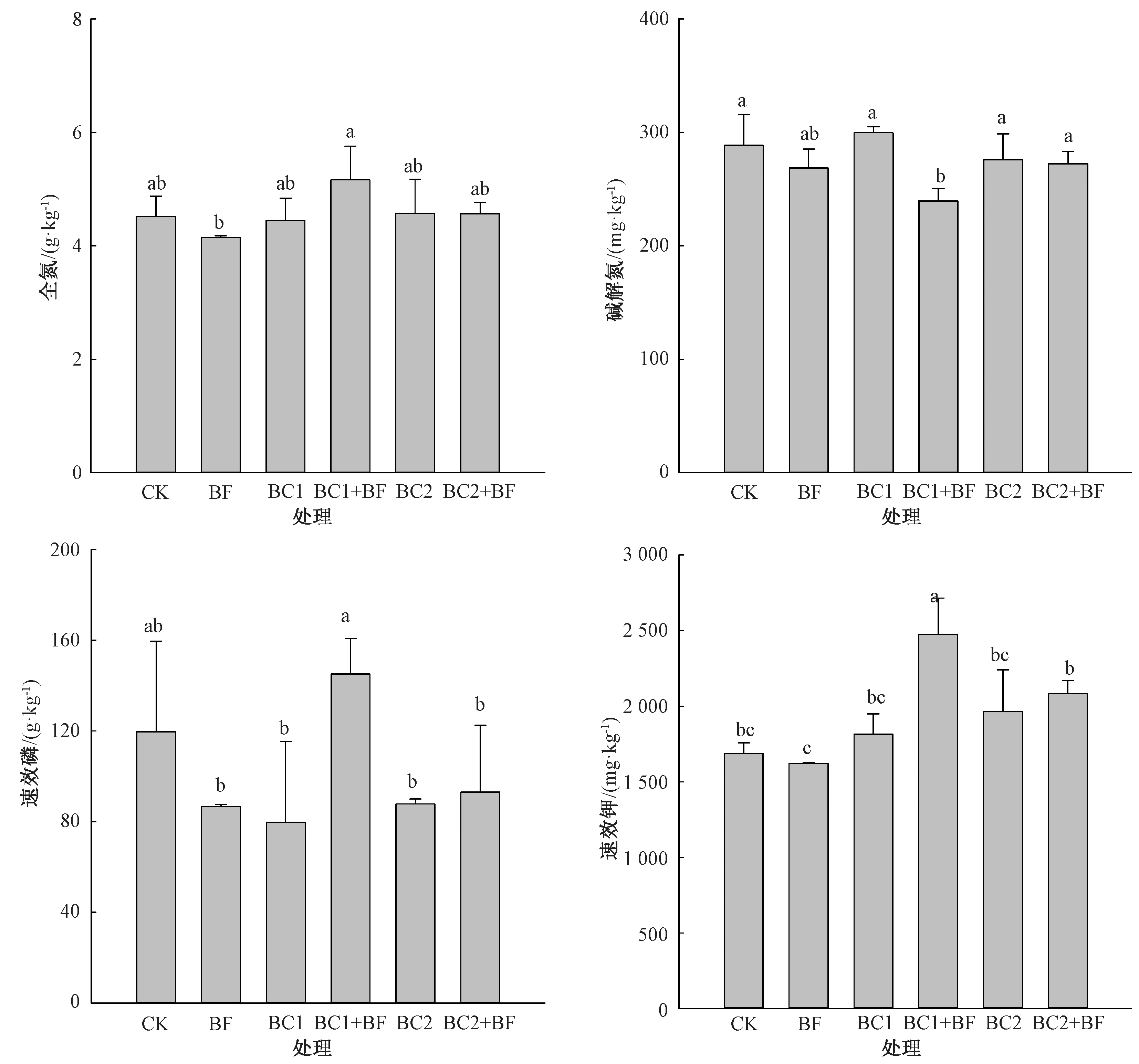
柱间无相同字母表示处理间差异显著(P<0.05)。图2同。
由图2可知,各不同土壤处理下的土壤含水量与CK处理间并不存在显著差异。除BC2+BF处理的土壤有机质含量显著高于CK外,其他处理的土壤有机质含量之间均无显著差异。
2.2 不同施肥对土壤微生物量的影响
表1显示的是长期不同施肥处理中土壤微生物量碳(SMBC)、土壤微生物量氮(SMBN)含量测定的结果。由表可知,BF、BC2+BF处理的土壤SMBC值显著高于对照,除对照外的其他五个处理之间无显著性差异。BC2、BC2+BF处理的土壤SMBN值显著低于对照,BF处理高于对照但差异不显著,BC1、BC1+BF处理低于对照但差异不显著,BC1+BF、BC2、BC2+BF处理间无显著性差异。

图2 不同施肥处理的土壤含水量和有机质含量

表1 不同处理对土壤微生物量碳和氮含量的影响
注:同列无相同字母表示处理间差异显著(P<0.05)。表2同。
2.3 不同施肥对群落丰度的影响
AWCD表征微生物群落碳源利用率,是土壤微生物群落利用单一碳源能力的重要指标,反映了土壤微生物活性和微生物群落生理功能的多样性。不同处理的AWCD值在第1天变化不大,之后快速上升,第5天后逐渐平静。其中,BC2的AWCD值明显低与其他处理(图3)。

图3 不同施肥处理下AWCD值随时间的变化曲线
培养72 h后测定的AWCD数据经标准化处理,并利用相关文献提供的方法进行主成分分析。根据提取的主成分个数一般要求累计方差贡献率达到85%的原则,共提取9个主成分,累计贡献率达88.1%。其中,第1主成分(PC1)的方差贡献率为33.9%,第2主成分(PC2)为10.1%。第3~9主成分贡献率均较小,分别为9.7%、7.9%、6.8%、6.4%、5.1%、4.8%、3.4%,故只对前2个主成分进行分析。不同施肥处理在PC轴上出现明显分异。在PCA1轴上各处理分散分布在正半轴一侧,不同处理间存在差异;在PCA2轴上BC2处理分布与其他有较大差异,BC2+BF处理分布在0点附近,其他处理分布较为集中,大多在正半轴一侧,且各处理间存在差异(图4)。整体来看,不同施肥处理存在差异,BC2处理和其他处理差异较大,表现出微生物群落的不稳定性。
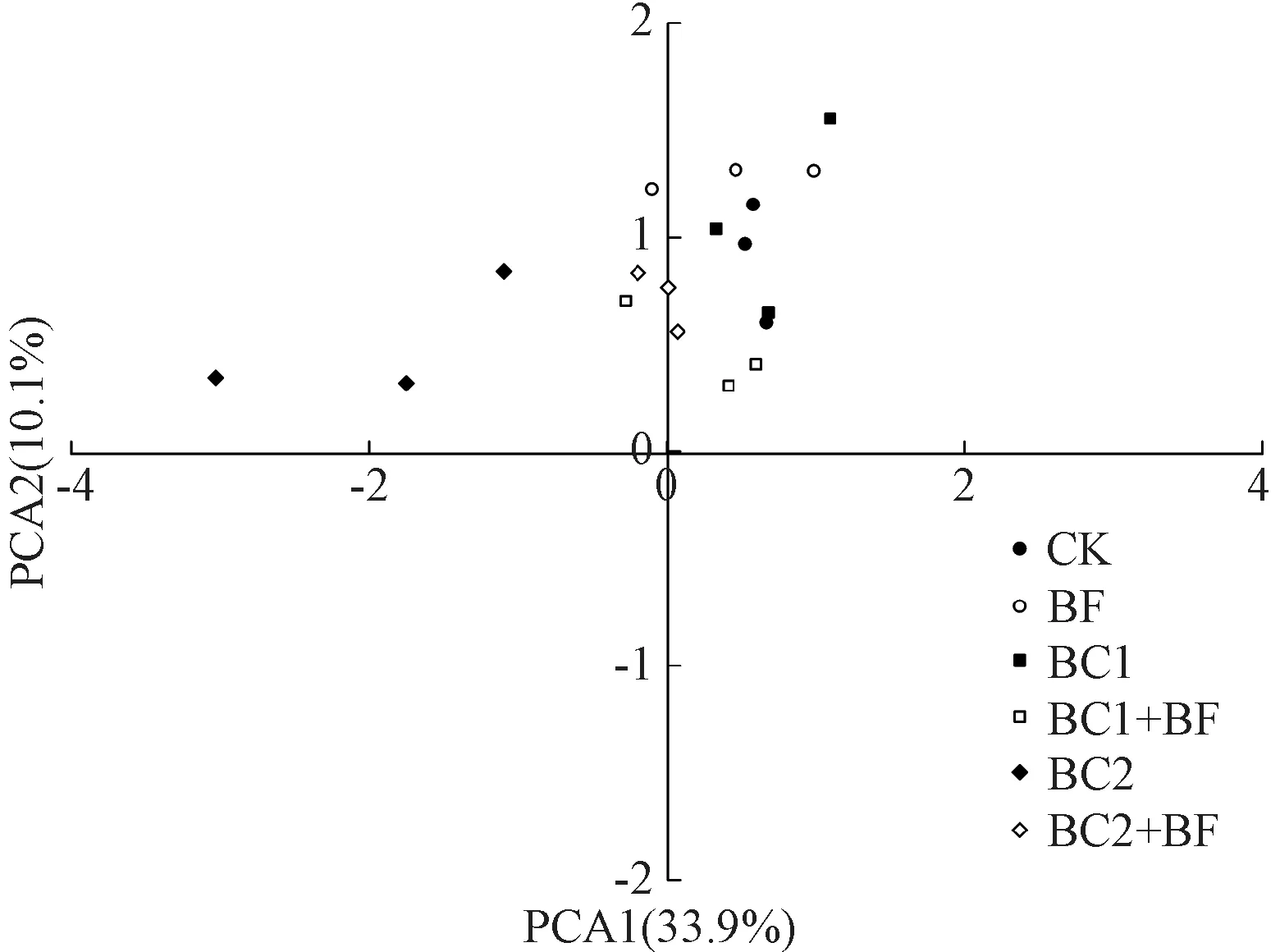
图4 不同施肥处理的主成分分析
AWCD值、Shannon指数、Simpson指数、McIntosh指数分别反映土壤微生物群落对碳源利用的总能力、土壤微生物物种的丰富度、土壤微生物物种的优势度以及度量群落物种的均匀度。从表2中可得,AWCD值、Shannon指数、Simpson指数的BC2处理低于其他处理,且其他处理间无显著性差异。McIntosh指数的BC1+BF显著高于其他处理,其他处理间无显著性差异。
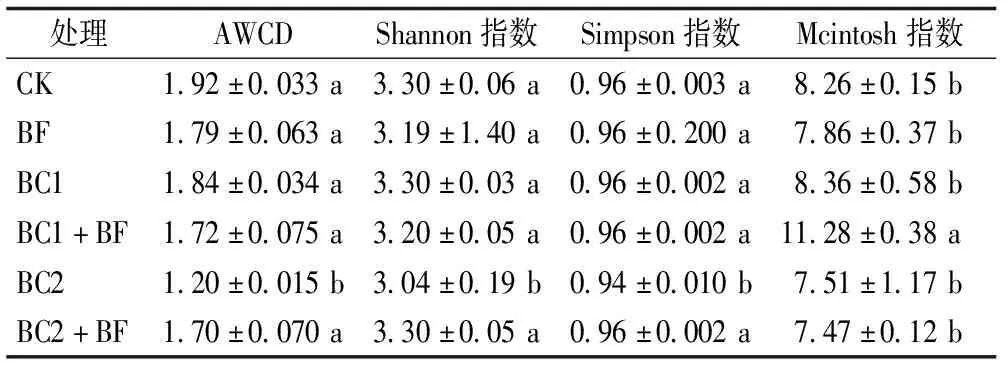
表2 不同施肥处理微生物群落的AWCD及多样性指数值
3 讨论
生物炭是生物质在低氧或缺氧条件下,通过高温裂解碳化,形成高度芳香化、富含碳的多孔颗粒固体[12];而微生物肥中特定的功能微生物通过自身的生命活动,促进土壤中物质的转化,提高作物营养水平,促进和协助营养吸收,刺激调控作物的生长,防治有害微生物,增加作物产量,提高品质[19]。本研究结果表明,低量生物炭+施微生物肥处理的速效磷含量和速效钾含量均明显高于仅施低量生物炭处理,但其碱解氮含量明显低于低量生物炭处理;高量生物炭+施微生物肥处理下只有土壤有机质含量明显高于高量生物炭处理,表明施入微生物肥能改善低量生物炭和高量生物炭处理下的速效磷、速效钾或有机质含量。土壤有机质属于土壤内的重要组成部分,在土壤肥力、环境保护、农业可持续发展中发挥着重要作用[20]。本研究结果显示,单独加入生物炭或微生物肥,不能提高有机质含量,但高量生物炭配施微生物肥则能提高有机质含量。
土壤微生物量的高低反映了土壤同化和矿化能力的大小,是土壤生态系统肥力的重要生物学指标[17]。生物炭对微生物的影响主要是因其多孔和巨大比表面积的结构特性为微生物提供适宜的环境,或者其吸附养分或改良土壤的性质间接影响微生物群。常栋等[21]的研究表明,添加生物炭基肥显著提高了土壤微生物量。本研究结果显示,相比对照,低量生物炭、低量生物炭+施微生物肥处理下的SMBC和SMBN含量均无明显差异;高量生物炭处理下SMBC也无显著性差异,SMBN含量明显降低。但高量生物炭+施微生物肥处理则显著提高SMBC,SMBN含量,但仍低于CK处理。表明高量生物炭处理抑制了土壤中同化氮的微生物,但配施微生物肥可使土壤中利用碳源的微生物明显增多。
土壤微生物群落功能多样性是土壤微生物群落状态与功能的指标,反映土壤中微生物的生态特征。Biolog方法用于环境微生物群落研究具有灵敏度高,分辨力强等特点[22]。在BIOLOG法中,AWCD值、Shannon指数、Simpson指数、McIntosh指数分别反映土壤微生物群落对碳源利用的总能力、土壤微生物物种的丰富度、土壤微生物物种的优势度以及度量群落物种的均匀度。本研究结果显示,高量生物炭处理的AWCD值、Shannon指数、Simpson指数均低于CK处理,但高量生物炭+施微生物肥处理下,这些参数均有显著提高,但与对照间无显著差异。这表明高量生物炭处理会抑制土壤的微生物,这与彭文龙[23]的研究一致。由于生物炭中含有一些不利于微生物生长的物质,过量的生物炭会对微生物产生毒性。然而,施入微生物肥后能明显缓减这种抑制作用,这从本研究的主成分分析结果中可以进一步证实。

