原花青素对高糖环境下人视网膜内皮细胞增殖及VEGF表达的影响
(1.南华大学附属第二医院眼科,湖南 衡阳 421001;2.郑州大学信息工程学院计算机科学与技术专业,河南 郑州 450001)
糖尿病是一种常见的慢性病,成人患病率为8.5%,糖尿病视网膜病变(diabetic retinopathy,DR)为常见并发症之一,约35%的糖尿病患者受其影响,7%的患者视力受到威胁[1]。DR历来被视为视网膜血管病变,一系列的病理变化不仅对视网膜造成影响,还会导致血管的损伤。除了视网膜前出血、视网膜新生血管、玻璃体积血、视网膜脱离等,糖尿病黄斑水肿(DME)也是糖尿病视网膜病变的一种并发症,它的特点是血管通透性增加,以及液体渗出血管导致视网膜细胞外液的异常积聚,从而可能导致失明[2]。原花青素(procyanidin,PC)是饮食中主要的多酚类物质,具有血管舒张、抗氧化、改善内皮功能、抗炎等多种作用[3]。同时,原花青素可抑制血管内皮生长因子(Vascular endogrowth factor, VEGF)信号传导[4],而VEGF可刺激血管生成,在胚胎发育和组织损伤修复过程中,对促进新生血管的形成起着至关重要的作用。在糖尿病患者中,升高的血糖水平会导致许多生化途径的异常调节,最终导致视网膜组织产生超氧化物和氧化应激的负担。由于线粒体功能障碍、炎症和缺氧驱动的VEGF分泌导致血管和神经细胞凋亡、新生血管和血管通透性升高[5],从而导致DR相关并发症。适当使用眼内给药抗血管内皮生长因子(Anti-VEGF)可治疗及预防视力损害性糖尿病视网膜病变,尤其是糖尿病黄斑水肿(DME)[6],因此,抗VEGF药物可降低DR失明的发生率,其长期疗效和安全性已在众多随机试验中得到证实[7]。依据原花青素相关特性及DR发病机制,本实验从建立体外模型来探讨原花青素对体外培养的人视网膜血管内皮细胞的影响出发探究其对治疗DR的药用价值。
1 材料与方法
1.1 主要试剂
胎牛血清购自sigma公司;原花青素购自株洲远成合中科技发展公司;兔抗人VEGF抗体、β-Actin抗体、兔抗人vWF、兔抗山羊Alexa-fluor购自Proteintech公司;胰蛋白酶购自美国sigma公司;高糖培养液(High glucose DMEM)购自Gibco公司;噻唑蓝(MTT)和二甲基亚砜(DMSO)购自Solarbio公司;RIPA裂解液购自碧云天生物有限公司;SDS和5×SDS上样缓冲液购自上海生工生物工程有限公司;第Ⅷ因子相关抗原抗体购自Proteintech公司;PVDF膜购自北京利科生化科贸有限公司。
1.2 方法
1.2.1 HRCECs的培养 无菌手术室获得人角膜移植术后供体眼球,沿赤道部平行剪开眼球,在显微镜下,使用显微器械钝性剥取视网膜神经层,经消化、剪碎、匀浆后,滤网过滤,终止消化并离心,收集细胞,加入细胞培养液(加入了10%胎牛血清、100 u/mL青霉素、50 u/mL庆大霉素)混匀,接种于培养瓶内,将其置于5%CO2、37 ℃培养箱内培养细胞,根据细胞生长情况予以换液,约1~2天换液1次。注意观察视网膜微血管内皮细胞是否呈梭形贴壁生长,培养瓶中的原代细胞贴壁面积大于80%时予以传代培养。
1.2.2 HRCECs的鉴定 使用倒置相差显微镜观察HRCECs的生长特性以及形态特征,将生长状态良好的细胞加入培养液制成浓度约4.5×104个/mL的细胞悬液,将无菌盖玻片置于24孔板内,每孔接种1 mL,置培养箱中培养。待细胞爬满玻片后PBS漂洗细胞2遍,加入4%多聚甲醛固定30 min,PBS漂洗3遍后加入第Ⅷ因子相关抗原抗体,置于4 ℃环境下过夜,重复上述漂洗步骤,滴入二抗混合液后漂洗封片,显微镜下观察其表达并采集图像。
1.2.3 实验分组 本实验分组为以下六组:TL组:低糖对照组(葡萄糖浓度为1 g/L);TH组:高糖对照组(葡萄糖浓度为4.5 g/L);T1组:高糖+200 μg/mL的原花青素组;T2组:高糖+400 μg/mL的原花青素组;T3组:高糖+600 μg/mL的原花青素组;T4组:高糖+800 μg/mL的原花青素组。
1.2.4 MTT法检测HRCECs增殖 取培养良好的细胞,弃去上清液后分别加入1 mL高糖培养液及1 mL低糖培养液,制成细胞悬液;将其接种于96孔板,每孔200 μL,约有细胞5×103个;本实验共有6个分组,每组设置5个复孔,96孔板的边缘孔只加入培养液作为空白对照以便调零及预防蒸发。待细胞贴壁时弃去培养液,将配制好的原花青素母液用高糖培养液稀释成所需浓度,按实验分组加药:TL组每孔加入200 μL低糖培养液;TH组每孔加入200 μL高糖培养液;T1-T4组按照用高糖培养液稀释好的原花青素浓度分别为(200、400、600、800 μg/mL)加入96孔板,每孔200 μL。将其继续分别培养至24 h、48 h、72 h。再向每孔加入20 μL的MTT粉剂溶液,继续培养4 h;将培养液吸除后用PBS洗涤3次,再向每孔加入20 μL的DMSO溶液,振荡10 min至其蓝紫色结晶溶解;96孔板放入酶联免疫监测仪,选择波长为490 nm,记录结果后依据公式计算:细胞存活率=实验组(T1-T4组)平均OD值/对照组(TL、TH组)平均OD值×100%;细胞抑制率=(1-实验组OD值/对照组OD值)×100%。以上全部步骤重复三次计算最终结果。
1.2.5 蛋白质免疫印迹法(Western Blot)检测HRCECs的VEGF表达 按照细胞传代方法,将离心后的细胞弃去上清液后分别用高糖培养液及低糖培养液制备成浓度为4.5×104个/mL的细胞悬液,接种于6孔板,每孔2 mL,培养至细胞贴壁。TL组只加入低糖培养液;TH组只加入高糖培养液;T1-T4组按照原花青素浓度分别为(200、400、600、800 μg/mL)加入高糖培养液,每组2个复孔。分别培养至24 h、48 h、72 h后取出用于提取蛋白。将蛋白样品按分组顺序自凝胶凹槽的一侧加入,每孔20 μL,第一孔加入5 μL mark及15 μL溴酚蓝作为标记,以80 V电压电泳约30 min至mark红色标记线出现,再将电压加大至150 V电泳30 min至标记线到达凝胶下缘或者以蛋白分子量相对应位置为标准后转膜。将转膜后的PVDF膜正面朝上置于TBST溶液中清洗数秒,再放入含5%脱脂牛奶的TBS液体的容器中,低速摇晃2小时;取出PVDF膜吸净液体,表面滴满一抗放置4 ℃冰箱中孵育,第二天取出放入TBS于摇床上清洗3次,每次10 min;再次取出吸净后加入二抗于室温下孵育1小时。孵育好二抗的PVDF膜用TBS清洗3次,每次10 min,在避光条件下将其放入事先准备好的显影液中,打开Image lab软件,放置凝胶、显影,保存图片。
1.3 统计学处理
2 结 果
2.1 HRCECs的培养和鉴定
原代HRCECs在5%CO2、37℃环境的培养箱内培养一至两天后见细胞开始贴壁生长,在倒置显微镜下可见其为扁平梭状,其中混有多种杂质细胞,根据细胞生长状态予以换液,待细胞培养一至两周时,杂质细胞已明显减少,HRCECs呈铺路石样铺满培养皿底部(图1),并出现细胞接触抑制现象。将原代HRCECs予以1:2比例规律开始传代,约1~2天予以换液,取对数生长期细胞用于实验。利用荧光素标记的第Ⅷ因子相关抗原抗体孵育后的人视网膜血管内皮细胞的包浆中可见黄绿色荧光,黑绿色的为胞核,细胞轮廓清楚(图2)。此现象表示体外培育HRCECs成功。
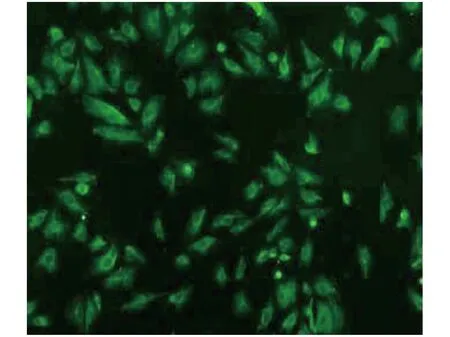
图2 HRCECs免疫荧光鉴定(100×)
2.2 HRCECs增殖
将HRECEs细胞接种于96孔板培养,高糖组与对照组(低糖组)之间比较,同一培养时间段,低糖组HRCECs数量都小于高糖组,其详细吸光度值见(表1.1);HRCECs经过24 h、48 h、72 h培养后,不同浓度原花青素(200、400、600、800 μg/mL)+高糖组不同组别之间两两比较,随着原花青素浓度升高对HRCECs细胞抑制率增加,结果具有显著性差异(P<0.05);且受同一浓度的原花青素干预培养的HRCECs,其细胞抑制率随着药物干预时间的增加而升高,其详细吸光度值及细胞抑制率见(表1)。
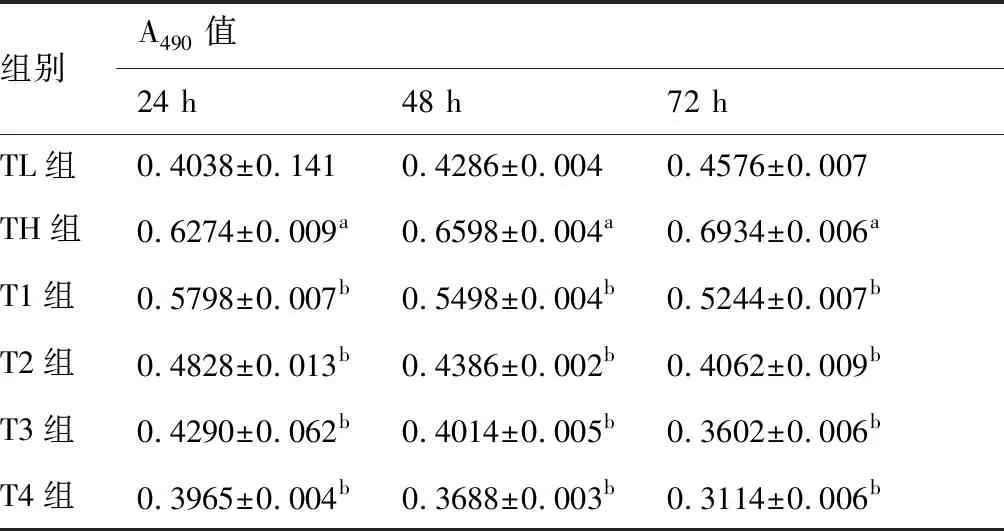
表1 不同浓度的PC对体外高糖环境下培养的HRCECs增殖的影响 (n=5)
与TL组比较,aP<0.05;与TH组比较,bP<0.05
2.3 不同浓度PC对体外高糖环境下培养的HRCECs中VEGF表达的影响
应用蛋白质免疫印迹法(Western Blot)检测本实验不同分组HRCECs中VEGF的表达情况:1)HRCECs经过同一时间培养后,高糖组HRCECs中VEGF的表达量都高于低糖组,其蛋白条带灰度值数据分析结果具有显著差异,有统计学意义(P<0.05);2)HRCECs在同一培养时间下,不同浓度原花青素(200、400、600、800 μg/mL)+高糖组不同浓度分组间两两比较,HRCECs中VEGF的表达量随着原花青素浓度升高而降低,结果具有显著性差异(P<0.05),且受同一浓度的原花青素干预培养的HRCECs,其VEGF的表达量随着药物干预时间的增加而降低。(图3~5,表2)
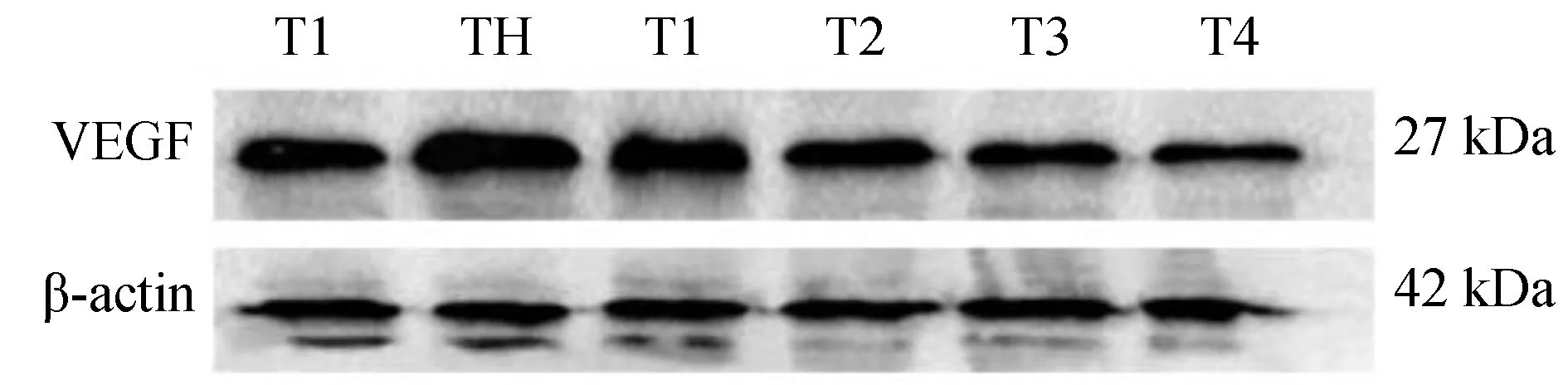
图3 不同浓度PC对高糖环境下培养24小时HRCECs中VEGF表达
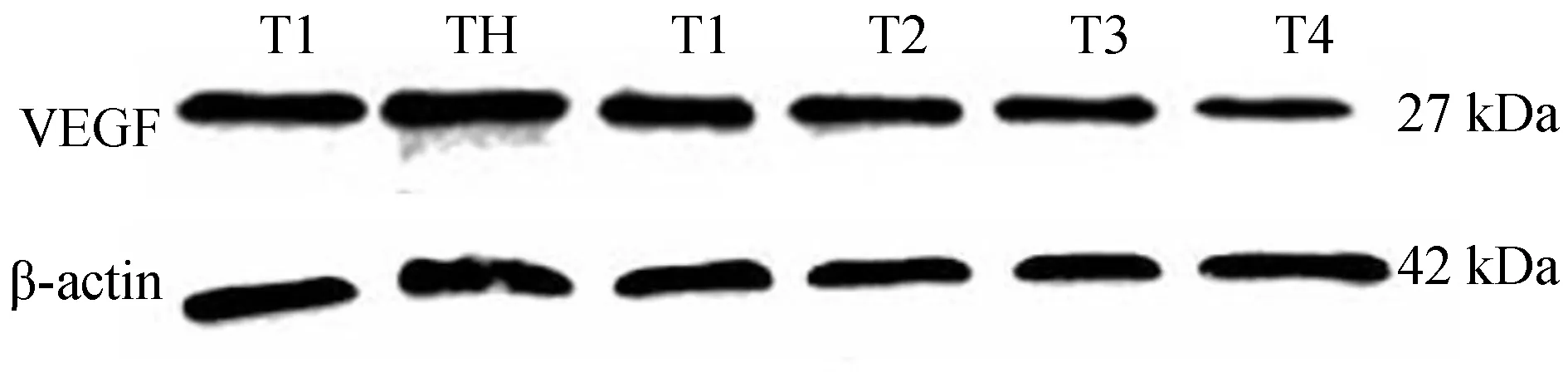
图4 不同浓度PC对高糖环境下培养48小时HRCECs中VEGF表达
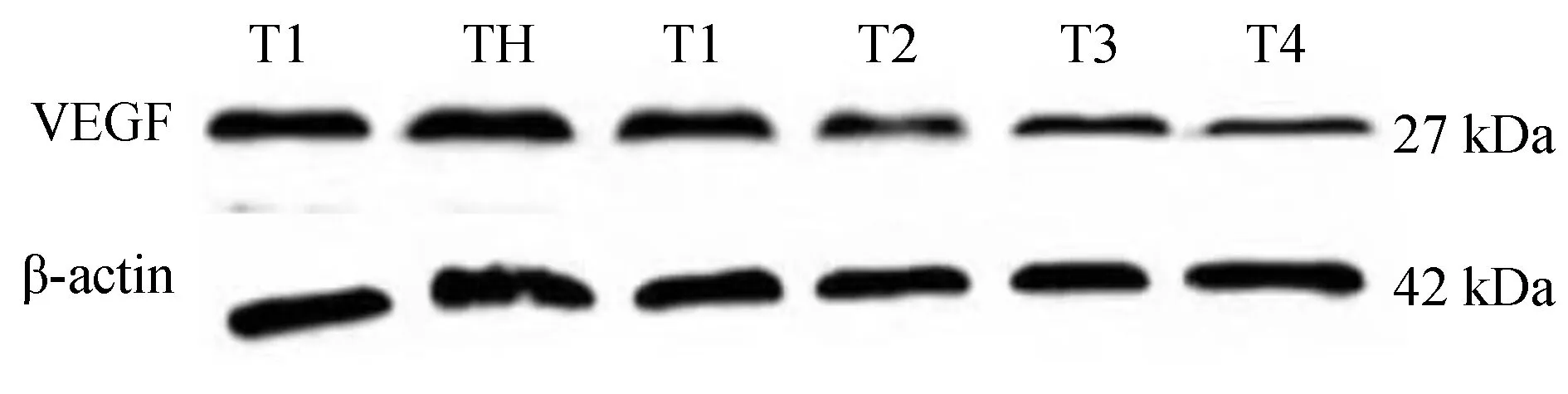
图5 不同浓度PC对高糖环境下培养72小时HRCECs中VEGF蛋白表达
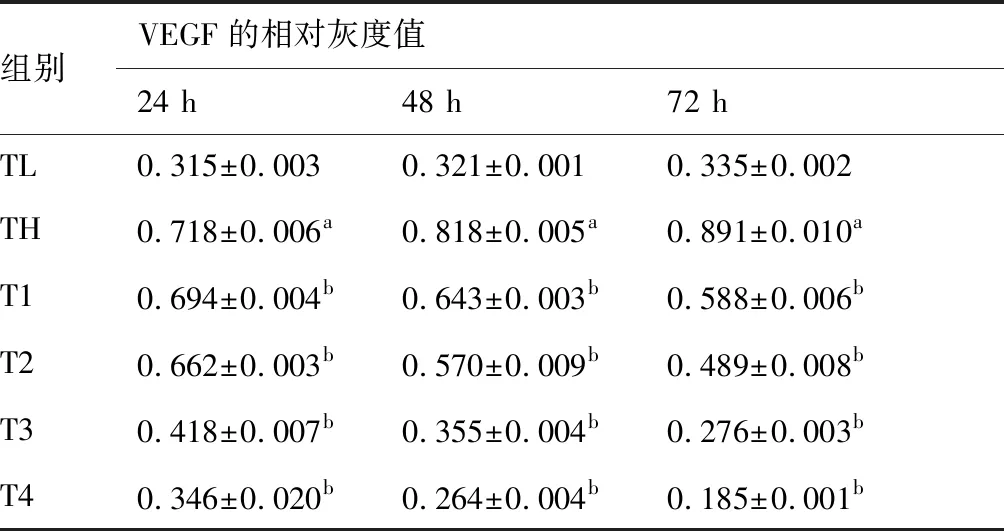
表2 原花青素对分别在24、48、72小时下体外培养的HRCECs中的VEGF表达 (n=5)
与TL组比较,aP<0.05;与TH组比较,bP<0.05
3 讨 论
DR的发病机制尚未完全清楚,高血糖是始动及基础因素,近年来,随着分子生物学的研究进展,发现DR的发生发展受多种信号介导,如氧化应激反应增强、线粒体活性氧增多、蛋白激酶C的激活、多元醇通路的过度激活、细胞因子的表达增加等。其中VEGF是高度有效的促血管生成细胞因子,VEGF的表达上调,可诱导新生血管形成并增加血管的通透性,导致视网膜出血、渗出、及新生血管的形成等病理生理改变,其在DR的发生发展过程中有着极其重要的作用。据统计,如果不治疗增殖性糖尿病视网膜病变(PDR),50%的患者将在确诊后5年内失明[8]。因此,对PDR的治疗显得尤为重要。抗VEGF药物目前是治疗DR并发症DME及促进眼底新生血管消退的标准药物[9],可以抑制血管内皮生长因子(VEGF)的信号传导[4],诱导血管内皮细胞凋亡。本研究利用PC干预体外建立高糖环境下人视网膜内皮细胞培养过程,观察其可能对DR的治疗效果。
高糖环境下,机体的氧化-抗氧化系统平衡会被打破,产生过量的活性氧(ROS),导致细胞毒性和氧化应激[10],从而破坏视网膜细胞正常生理功能。氧化应激在糖尿病视网膜病变的发生发展中起着核心作用,在许多与糖尿病视网膜病变发展相关的异常中,氧化应激处于中心位置[11]。糖尿病患者视网膜中的ROS增加刺激促炎细胞因子的释放,促进涉及多种信号通路的慢性低级别炎症,同时导致视网膜内皮细胞损伤,微血管通透性增加,炎症部位炎症细胞的聚集,这些炎症细胞与内皮细胞和视网膜上的其他常驻细胞之间发生异常的相互作用,通过细胞间分子信号传导造成视网膜血管结构损害并触发血管生成[12];而PC可以通过减少ROS的过度生成,抑制高糖诱导的血管平滑肌细胞生长[13],具有良好的体外抗氧化和抗炎活性。研究发现PC能直接抑制血管生长因子受体-2激酶的活性及内皮细胞中血管生长因子受体/细胞分裂素活化蛋白激酶介导的信号通路途径,继而抑制血管内皮细胞增殖和迁移及血管的出芽。NF-κB信号通路存在于多细胞分化和增殖的过程中,PC通过下调NF-κB的表达水平,抑制NF-κB信号通路的激活继而抑制细胞的增殖[14]。本研究随着原花青素浓度升高对HRCECs细胞抑制率增加;且受同一浓度的原花青素干预培养的HRCECs,其细胞抑制率随着药物干预时间的增加而升高。这提示PC对于体外高糖模型下培养的HRCECs增殖有抑制作用,且呈时间-浓度依赖性。
另一方面,VEGF的高表达被认为是参与视网膜损伤的主要标志物。本实验中,在高糖环境下,HRCECs中VEGF表达对比低糖环境明显增加,这与报道的在PDR中,高血糖引起的VEGF水平升高致使异常新生血管生成而成为视力下降的一个主要因素相一致[15],除了促进血管生成,VEGF可能还参与神经元损害[16],进一步危害DR患者的视力。因此,VEGF是治疗DR大多数药理干预的靶点[17]。本实验结果表明,HRCECs在同一培养时间下,VEGF的表达量随着原花青素浓度升高而降低,且受同一浓度的原花青素干预培养的HRCECs,其VEGF的表达量随着药物干预的时间的增加而降低。说明PC可以抑制高糖诱导的VEGF的表达,可能作为一种抗VEGF药物参与DR的治疗。

