膀胱灌注青藤碱对MNU诱发雄性SD大鼠膀胱癌的抑制作用
2
(1. 南华大学附属第二医院泌尿外科,湖南 衡阳 421001;2.南华大学组胚教研室, 湖南 衡阳 421001)
膀胱癌属于比较常见的泌尿外科肿瘤,发病率逐年上升。近年来浅表性膀胱癌仍然是在肿瘤电切术的基础上,膀胱灌注卡介苗(Bacillus Calmette Guerin,BCG)进行免疫治疗或化疗药物灌注治疗。一系列病理生理学和免疫学研究表明,BCG通过诱导炎性反应,激活机体免疫反应而发挥抗肿瘤效应。资料[1-2]表明,膀胱灌注BCG后复发率较高。人们为此尝试不同的药物,以期改善膀胱癌的治愈率。肿瘤的发生、进展与肿瘤免疫密切相关。青藤碱(Alkaloid sinomenine,SIN)是从青风藤提取出来的有效活性单体,已被证实具有抑制肿瘤细胞增殖的作用[3-6]。有文献[7]报道,MNU和N-正丁基-N-(4-羟基-丁基)亚硝胺(BBN)均属于强致癌剂,通常应用于大鼠膀胱灌注诱癌,其中BBN组诱癌率72.7%,而MNU组诱癌率达94.4%。本研究建立大鼠膀胱癌模型,探讨膀胱灌注SIN对大鼠膀胱癌的肿瘤免疫的干预作用。
1 材料与方法
1.1 实验动物
从南华大学动物实验中心购买75只清洁级雄性SD大鼠,均为18~20个月龄,体重均为250~270g。购入后将其放入饲养笼,动物房内保持清洁,并且通风良好,保持温度恒定(23~25 ℃)、相对湿度恒定(40%~60%),喂养食物为颗粒等级饲料,水源为自来水,使其适应一周后方进入实验。实验过程严格遵守并执行南华大学颁发的《动物实验伦理准则》。
1.2 主要药品
N-甲基亚硝基脲(Solarbio)、盐酸青藤碱粉剂(湖南正清制药有限公司)、BCG冻干制剂(瑞楚制药)。
1.3 试验方法
1.3.1 配制MNU液、BCG溶液和青藤碱溶液 按照王艺臻[8]的MNU配制方法,将1.0 g MNU溶入50 mL枸橼酸钠缓冲液,充分溶解后置入20 ℃冰箱避光保存;将50 mg BCG冻干制剂分别溶入20 mL、40 mL生理盐水,分别配制成1.25 mg/mL、2.5 mg/mL等2个浓度。按照屈绍思[9]的实验方法,将青藤碱粉剂加入生理盐水,配置成40 mg/mL的青藤碱溶液。
1.3.2 实验分组和大鼠膀胱癌模型的建立 将SD大鼠分为5组,每组15只。分为对照组、模型组、青藤碱组、青藤碱+1/2 BCG组、BCG组等5组。除了对照组,其他四组共计60只大鼠参考王艺臻[8]的实验设计方法,建立大鼠膀胱癌模型。大致过程如下:以20 mg/kg的剂量向大鼠经腹腔注射戊巴比妥液进行麻醉,满意后将大鼠固定,碘伏消毒尿道口,采用5 cm硬膜外导管经尿道口垂直插入,至硬膜外导管内可见尿液滴出,证实硬膜外导管顺利抵达膀胱。取胰岛素注射器作为膀胱灌注的推药器具,从硬膜外导管远端缓缓注入0.1 mL MNU溶液进行膀胱灌注(灌注时程为每2周1次,持续10周)。操作结束后,放回饲养笼中。
10周后,对照组和模型组以生理盐水每只0.2 mL按照如上操作方法进行膀胱灌注处理;青藤碱组膀胱灌注0.2 mL青藤碱溶液;青藤碱+1/2 BCG组在青藤碱组基础上,同时加用浓度1.25 mg/mL的BCG 0.2 mL膀胱灌注;BCG组给予浓度2.5 mg/mL BCG 0.2 mL膀胱灌注。以上操作均每周1次,持续4周。14周后采用颈椎脱臼法处死大鼠后,迅速移除腹腔内容物,从大鼠下腔静脉无菌采血,分离血清,-20 ℃环境保存;摘取膀胱后,置于-80 ℃冰箱中保存。
1.4 观察指标
1.4.1 大鼠一般生活情况 每日观察大鼠毛色,以及大鼠一般行为,如进食、饮水等。
1.4.2 采用荧光定量-聚合酶链反应(Real Time PCR)检测膀胱组织CTLA-4和PD-1 严格按照实验步骤,经过匀浆、吸打、离心、纯化RNA等,提取样本总RNA,进行反转录反应,使RNA反转录为cDNA。最后进行扩增,荧光定量PCR仪进行PCR,采用相对定量计算公式进行定量分析。
1.4.3 蛋白免疫印迹反应(Western-Blot)测定膀胱组织CTLA-4和PD-1 严格参照操作要求,经过配制工作液、提取总蛋白、制胶、电泳、转膜、封闭与抗体孵育和显影等步骤,最后用凝胶成像系统成像,再用Quantity One软件分析各条带灰度值,得到目标蛋白与β-actin的灰度比值,即为目标蛋白相对表达值。
1.4.4 采用ELISA法测定大鼠血清B7/H3的表达 采用双抗体夹心法,按照说明书要求,依次经过包被-加样-加酶标抗体-加底物液显色-终止反应-结果判定等一系列过程,在波长450 nm处采用酶标仪测定OD值,绘制标准曲线,横坐标为标准品浓度,纵坐标为OD值,依据标准曲线计算结果。
1.4.5 采用HE染色法进行大鼠膀胱组织病理检查 依次经过甲醛固定、各梯度乙醇脱水、二甲苯透明化、滴蜡包埋、切片、脱蜡、脱二甲苯、洗涤、苏木素染色、伊红染色、脱水、透明化和封片处理后,使用400倍光学显微镜进行观察。病理结果描述参照《KOSS诊断细胞学及其组织病理学基础》,采用HE染色评分进行分类及分级:0分提示未见癌组织;0.5分为轻微增生;1分为上皮无异型性或者仅为轻度异型性、轻度增生者;2分为上皮中度增生、异型性;3分为重度增生、高度异型性;4分对应乳头状癌;5分提示肿瘤浸润及远处转移。膀胱炎症评分:0分提示无炎症;1分提示膀胱表面和微血管周围可见炎症细胞浸润;2分提示膀胱组织内可见炎细胞1~20个/片;3分提示膀胱组织内可见炎细胞21~100个/片;4分提示膀胱组织内可见炎细胞大于100个/片。将各组相对应的数据累加,即为病理学总评分。
1.5 统计学处理
应用SPSS 22.0统计软件进行分析,计量资料以均数±标准差表示,各组计量资料的比较采用单因素方差分析;计数采用χ2检验,P<0.05表示差异具有统计学意义。
2 结 果
2.1 各组大鼠一般情况
观察到第14周,大鼠均无死亡现象发生。对照组、青藤碱+1/2BCG组及BCG组大鼠毛色光滑,进食正常,对外来刺激敏感;模型组和青藤碱组大鼠欠光滑,进食量及饮水量均有所减少,对外来刺激反应稍显迟钝。
2.2 各组大鼠检测结果比较
5组大鼠的CTLA-4mRNA,对照组显著低于其余各组(P<0.05),而模型组显著高于其余各组(P<0.05);BCG组显著低于青藤碱组(P<0.05);青藤碱+1/2BCG组、BCG组比较差异无显著性(P>0.05)。5组大鼠的PD-1mRNA,对照组显著低于其余各组(P<0.05),而模型组显著高于其余各组(P<0.05);青藤碱+半量BCG组、BCG组显著低于青藤碱组(P<0.05);青藤碱+1/2BCG组、BCG组比较差异无显著性(P>0.05)。5组大鼠的B7-H3蛋白,对照组显著低于其余各组(P<0.05);青藤碱+半量BCG组、BCG组显著低于模型组、青藤碱组(P<0.05);青藤碱+1/2BCG组、BCG组比较差异无显著性(P>0.05)。详见表1、图1。
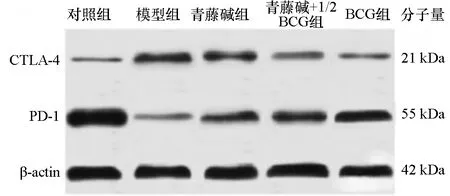
图1 各组CTLA-4、PD-1表达比较
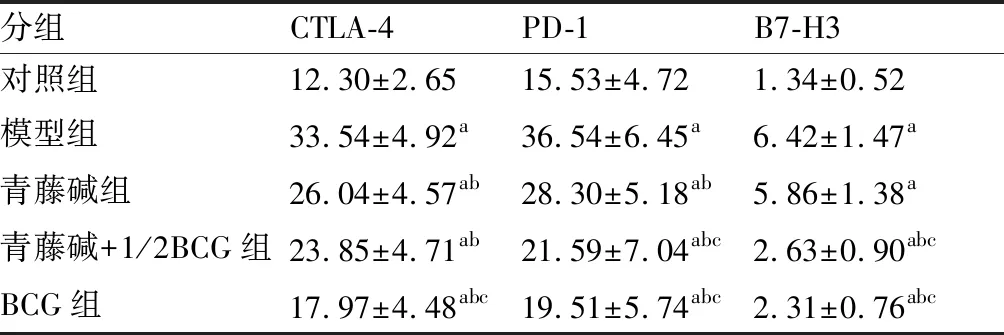
表1 各组大鼠各指标结果比较
与对照组比较,aP<0.05;与模型组比较,bP<0.05;与青藤碱组比较,cP<0.05.(n=15)
2.3 各组大鼠病检结果比较
对照组未见细胞异型性,评分0.79±0.31;模型组细胞排列紊乱,多数高度异型增生并中-重度炎细胞浸润,评分3.18±1.33;青藤碱组细胞排列紊乱,部分为高度异型增生,多数为中度异型增生,评分2.31±0.84;青藤碱+1/2BCG组细胞排列紊乱,多数为中度异型增生伴炎细胞浸润,评分为1.39±0.65;BCG组细胞排列紊乱,多数为轻-中度异型增生伴轻度-中度炎细胞浸润,评分1.16±0.52。对照组评分显著低于其余各组(P<0.05);模型组显著高于其余各组(P<0.05);青藤碱组显著高于青藤碱+1/2BCG组、BCG组(P<0.05);青藤碱+1/2BCG组、BCG组相比差异无显著性(P>0.05),见图2。

图2 各组病理学改变(HE染色法×400)A:对照组;B:模型组;C:青藤碱组;D:青藤碱+1/2BCG组;E:BCG组
3 讨 论
近年来,免疫检查点抑制剂如抗细胞毒T淋巴细胞相关抗原(CTLA-4)、抗程序性死亡受体1(PD-1)和抗程序性死亡配体1 (PD-L1)等用于治疗肿瘤具有非常光明的前景[10]。CTLA-4不仅可与CD28竞争结合APC表面的B7分子配体,抑制免疫细胞共刺激信号,还可产生其他抑制性信号,抑制CTL的增殖与活化,最终产生的效应为抗肿瘤作用大大减弱[11]。因此,如果CTLA-4过度表达,会导致T细胞的活化受到抑制,肿瘤细胞无法得到有效杀伤,从而使其达到免疫逃逸的目的。反之,抑制CTLA-4的表达可降低CTLA-4与B7结合的亲和力,使得T细胞的活性大为增强,机体抗肿瘤免疫能力大大增强[12]。本研究中各组大鼠致癌后,大鼠膀胱组织CTLA-4蛋白显著增高,提示大鼠患膀胱癌,机体的免疫功能失衡。对致癌大鼠分别应用SIN、BCG或SIN联合半量BCG进行膀胱灌注,大鼠膀胱组织CTLA-4蛋白表达量均显著下降,提示上述各干预措施对大鼠膀胱癌细胞增殖都起到了一定的抑制作用。而将SIN、BCG或SIN联合半量BCG进行膀胱灌注的各组大鼠进行对比,发现SIN联合半量BCG进行膀胱灌注的大鼠膀胱组织与CTLA-4和BCG进行膀胱灌注的大鼠对比差异无显著性,表明了SIN和BCG进行膀胱灌注疗效具有协同性,提示了SIN可作为治疗膀胱癌的有效辅助用药。本研究的SIN浓度的配置参考了屈绍思[8]的实验设计浓度,考虑到该文献中高浓度SIN组大鼠出现死亡的现象,且不能明确是否属于SIN的毒副作用,因此将其中等浓度SIN作为本研究的实验设计浓度。
PD-1/PD-L1抑制剂与CTLA-4抑制剂效果相似,能够抑制T细胞的活化与增殖,但在作用机制上两者有所不同。CTLA-4抑制剂主要在T细胞活化的早期起作用,而PD-1抑制剂主要作用于T细胞活化的晚期。与CTLA-4相比,PD-1的抑制作用更强。PD-1是T细胞上主要存在的一种抑制性受体,肿瘤发生时机体内的肿瘤微环境会使浸润性T细胞高表达PD-1,同时肿瘤细胞中PD-L1的表达上调,与PD-1受体相结合,导致肿瘤微环境中PD-1通路持续开放,进而导致T细胞凋亡,肿瘤细胞则逃脱机体的免疫监视,发生肿瘤免疫逃逸[13],因此通过抑制PD-1的表达可阻断以上生物过程,达到增强免疫活性来杀伤肿瘤细胞的效应[14]。有学者研究将PD-1/PD-L1抑制剂应用于膀胱癌患者,发现PD-1/PD-L1抑制剂能显著延长膀胱癌患者总体生存期[15-17]。本研究中各组大鼠膀胱癌组织PD-1蛋白表达呈现出与CTLA-4蛋白相似的趋势,提示对致癌大鼠分别应用SIN、BCG或SIN联合半量BCG进行膀胱灌注,大鼠膀胱组织CTLA-4蛋白表达量均显著下降,提示上述各干预措施对大鼠膀胱癌细胞增殖都起到了一定的抑制作用。B7-H3也是近年来兴起的研究较热的免疫检查点分子之一。我国最近的一项临床研究中,证实了B7-H3在大多数NSCLC患者的血液中高表达,并且与预后差有关[18]。也有研究发现了其在非小细胞肺癌患者的恶性胸腔积液中普遍高表达,且与预后差相关[19]。本研究中各组大鼠致癌后,大鼠血清B7-H3表达量显著增高。SIN进行膀胱灌注后,大鼠血清B7-H3表达量均无显著性变化,提示SIN对MNU致癌的膀胱癌大鼠进行膀胱灌注无法有效降低大鼠血清B7-H3。SIN联合半量BCG进行膀胱灌注后,大鼠血清B7-H3显著降低,可能是因为BCG发挥了积极有效的抗肿瘤效应。上述结果可能表明在膀胱癌发生和进展的免疫失衡机制中,SIN对于在B7-H3这个免疫检查点分子似乎不起作用。这个研究结果提示SIN不能显著降低膀胱癌大鼠血清B7-H3的表达,反过来验证了肿瘤发病机制的多样性和复杂性,以及治疗肿瘤进行联合用药的必要性。
病理学诊断是诊断肿瘤良恶性的金标准,直接决定了肿瘤患者的预后。本研究中,除了正常对照组没有建立大鼠膀胱癌模型外,其余建模组均成功致癌。根据5组病检总评分结果,可见单用SIN进行膀胱灌注的15只大鼠病检结果较模型组显著改善,提示对膀胱癌大鼠给予SIN进行膀胱灌注,能有效改善其病理评分。当SIN联合半量BCG进行膀胱灌注后,病理评分进一步降低,这充分展现了联合用药的协同效应,直观地体现了SIN在膀胱癌中抗肿瘤的积极效应,证实了SIN能有效改善膀胱癌预后,是一种治疗膀胱癌的有效的化疗辅助用药。
综上所述,肿瘤的发生发展过程呈现多通路、多机制的特点。青藤碱能显著抑制膀胱癌大鼠CTLA-4、PD-1的表达,降低膀胱炎症及HE染色评分,可能通过下调膀胱癌的免疫检查点分子表达而抑制膀胱癌进展。

