miR-181a靶向RASSF1A促进多发性骨髓瘤U266细胞增殖、侵袭
邓文松,马巧玲,张晓云,吴志华,洪丽梅
(1.中国人民解放军联勤保障部队第908医院检验科,江西鹰潭 335000;2.鹰潭市中心血站,江西鹰潭335000)
多发性骨髓瘤(multiple myeloma,MM)的发病率呈逐年上升趋势,且治疗后的复发率较高,给临床诊治及患者预后带来较大的不利影响。微小RNA(microRNA,miR)是近年来受到广泛关注的非编码小分子RNA,在体内参与多种生物学行为的调控,并被证实与多种恶性肿瘤的发生、发展有关。miR-181a是一种具有促癌特性的微小RNA,研究证实,miR-181a在MM患者骨髓组织中呈显著高表达趋势[1-2],提示miR-181a可能参与骨髓瘤的发生、发展。另有多项研究证实,在胃癌及骨肉瘤细胞中,miR-181a的促癌活性与靶向抑制抑癌基因Ras相关区域家族1A(ras association domain family 1,RASSF1A)的表达密切相关[3-4],但miR-181a是否在MM患者骨髓中靶向RASSF1A并调控相应的恶性生物学行为目前尚未明确。为探讨miR-181a对多发性骨髓瘤恶性生物学特征的调节作用及可能的作用机制,本研究拟检测骨髓瘤组织及正常骨髓组织中miR-181a表达的差异,并以多发性骨髓瘤细胞系U266为研究对象分析miR-181a靶向RASSF1A促进U266细胞增殖、侵袭的作用。
1 材料与方法
1.1研究对象 收集2014年2月至2018年12月在我院行骨髓穿刺并经病理组织学诊断为MM患者40例,男23例,女17例,年龄(48.6±8.1)岁;纳入标准:(1)符合MM的诊断标准[5];(2)临床及病理资料完整;(3)未接受过MM相关治疗。排除标准:(1)既往有恶性肿瘤病史;(2)合并其他血液系统疾病;(3)合并自身免疫性疾病、肝肾功能不全等。采集同期在我院接受骨髓穿刺并经病理组织学证实为正常骨髓的受试者50例,男29例、女21例,年龄(47.2±9.2)岁,均排除合并严重肝肾功异常、血液系统疾病、自身免疫性疾病、恶性肿瘤等其他系统疾病。各研究对象均知情同意,本研究经中国人民解放军第一八四医院伦理委员会批准(批准号:XHEC-D-2018076)。MM患者与正常骨髓象受试者的性别、年龄差异无统计学意义(P>0.05)。
1.2主要试剂与仪器 U266细胞系购自中科院上海细胞资源中心;DMEM培养基、胎牛血清(FBS)、胰蛋白酶(美国Gibco公司);MTS细胞活力检测试剂盒、野生型及突变型RASSF1A3′UTR的荧光素酶报告及相应的荧光素酶曝光基因检测试剂盒(美国Promega公司);Lipofectamine 3000(美国Invitrogen公司);结晶紫(美国Sigma公司);miRNA提取试剂盒、miRNA cDNA第一链合成试剂盒、miRNA实时荧光定量PCR检测试剂盒(北京天根公司);RIPA裂解液、BCA蛋白质定量试剂盒(北京索莱宝公司);兔抗人RASSF1A、cyclinD1、RhoA多克隆抗体(美国Abcam公司);驴抗兔辣根过氧化物酶IgG二抗(北京奥维亚生物技术公司)。Bx53正置显微镜(日本Olmpus公司);Elx800酶联仪(美国Bio-Tek公司);Multiskan Sky分光光度计(美国Thermo公司);CFX96实时荧光定量PCR仪(美国Bio-Rad公司);Tanon-4100化学显影仪(上海天能公司);DR1900分光光度计(美国哈希公司);GloMax 2020单管型发光检测仪(北京原平皓生物公司)。
1.3细胞培养及转染 取生长状态良好的U266细胞,用含10%FBS的DMEM培养基贴壁培养,待细胞融合度达90%时,用12.5 g/L胰蛋白酶消化传代并继续培养,取传代后处于对数生长期的细胞进行分组处理。实验设为NC mimic组、miR-181a mimic组、NC inhibitor组、miR-181a inhibitor组,按照Lipofectamine 3000试剂盒说明书将NC mimic(2 μL/mL)、miR-181a mimic、NC inhibitor(20 pmol/mL)、miR-181a inhibitor(20 pmol/mL)分别转染进入各组细胞,连续转染24 h。每个样本设5个复孔。
1.4实时荧光定量PCR检测miR-181a表达量
1.4.1RNA提取及逆转录反应 取MM患者骨髓组织及正常骨髓组织各约20~30 mg,另取转染后的各组U266细胞1×106个,按照miRNA提取试剂盒说明书分离组织或细胞中的miRNA,采用DR1900分光光度计检测吸光度(A260/280 nm)在1.7~2.0的样本用于后续实验。取2 μg miRNA并按照miRNA cDNA第一链合成试剂盒说明书将miRNA逆转录为cDNA,样本置于-20 ℃保存。
1.4.2引物设计及实时荧光定量PCR 采用Primer Premier 5.0软件设计引物,并送上海生工公司合成。miR-181a的正向引物序列:5′-TAGCTAGCTAGTCAGTGTC′-3′;β-actin正向引物序列:5′-TCGATCGATGCTAGCTAT′-3′,反向引物序列:5′-TAGCATAGCTAGCTAGCT-3′,退火温度58 ℃、产物164 bp;按照miRNA实时荧光定量PCR检测试剂盒说明书进行检测,PCR反应体系为20 μL,包括cDNA 2 μL,10 μmol/L正向引物0.4 μL,通用反向引物0.4 μL,PCR Mix 10 μL,去离子水7.2 μL。循环参数:95 ℃预变性3 min;95 ℃ 20 s,60 ℃ 34 s,共40个循环,在60 ℃时采用CFX96实时荧光定量PCR仪配套软件iQ5 V2.1.97进行荧光采集及熔解曲线分析,根据循环阈值(Ct),以β-actin为内参照。按照2-ΔΔCt法计算miR-181a的表达量。
1.5MTS法检测细胞增殖活力 取经12.5 g/L胰蛋白酶消化后的各组U266细胞,用DMEM培养基调节细胞密度至1×106/mL,取200 μL接种于96孔细胞培养板内,按照1.3的方法分组并转染24 h后,按照MTS细胞活力检测试剂盒说明书操作进行细胞增殖活力检测,用Elx800酶联仪测定450 nm波长处的吸光度(A450 nm)值。
1.6Transwell试验检测细胞侵袭能力 取经12.5 g/L胰蛋白酶消化后的U266细胞,用无血清DMEM培养基重悬,调节细胞密度至1×106mL,取200 μL细胞悬液接种于预涂基质胶的Transwell上层小室,下层小室加入800 μL含20%FBS的DMEM培养基,按照1.3的方法分组并转染24 h后,取出小室,PBS漂洗2次后用棉签擦去未穿膜细胞,经4%多聚甲醛固定30 min后结晶紫染色10 min,在光学显微镜下观察并计数穿膜细胞的数目。
1.7荧光素酶报告基因的检测 取经12.5 g/L胰蛋白酶消化后的U266细胞,调节细胞密度至1×106/mL,取500 μL接种于24孔细胞培养板,先将野生型及突变型的RASSF1A荧光素酶报告基因转染进入细胞,使报告基因的终浓度达1 μg/mL,按照1.3转染步骤操作,转染24 h后用2.5 g/L胰蛋白酶消化并以3 000 r/min离心10 min,收集细胞,按照荧光素酶报告基因检测试剂盒及GloMax 2020单管型发光检测仪检测萤火虫荧光值和海肾荧光值。荧光素酶报告基因的荧光活性计算公式:萤火虫荧光值/海肾荧光值。
1.8蛋白质提取及western blot
1.8.1蛋白质提取 组织蛋白质提取:取MM患者骨髓组织及正常骨髓组织20 mg,加入RIPA裂解液0.5 mL后进行超声匀浆处理;细胞蛋白质提取:取1×106个U266细胞接种于12孔细胞培养板,按照1.3的方法分组处理后,加入RIPA裂解液0.1 mL后用细胞刮刀裂解细胞。取裂解液,按照BCA试剂盒说明书操作测定总蛋白质含量,然后加入1/4体积的5×SDS蛋白质上样缓冲液,100 ℃加热变性10 min,分装并置-80 ℃保存。
1.8.2western blot 配制10% SDS-PAGE分离胶,将上述蛋白质样品按30 μg总蛋白质的量进行聚丙烯酰胺凝胶电泳(积层胶采用80 V电压,分离胶采用100 V电压),电泳结束后在350 mA恒流条件下2 h将蛋白质转移至NC膜,转膜结束后将膜置于50 g/L脱脂牛奶中室温封闭NC膜2 h,加入兔抗人RASSF1A、cyclinD1、RhoA多克隆抗体(1∶1 000稀释)在4 ℃温育过夜,加入 TBS/T在水平摇床上洗膜3次,每次5 min;加入驴抗兔辣根过氧化物酶IgG二抗(1∶2 000稀释)温育2 h,加入TBS/T在水平摇床上洗膜5次后,在Tanon-4100化学显影仪扫描并曝光得到蛋白质条带,公式:目标蛋白质灰度值/β-actin灰度值。

2 结果
2.1各组miR-181a及RASSF1A、cyclinD1、RhoA表达的比较 实时荧光定量PCR结果表明,MM患者骨髓组织中miR-181a的表达水平为1.31±0.28,明显高于正常骨髓组织(0.67±0.09)(P<0.05);western blot结果表明,cyclinD1、RhoA蛋白的表达量明显高于正常骨髓组织,而RASSF1A蛋白的表达量明显低于正常骨髓组织,差异均有统计学意义(P均<0.05)。见图1、表1。经Pearson检验,MM骨髓组织中miR-181a的表达量与RASSF1A的表达量呈负相关(r=-0.351,P<0.05),而与cyclinD1、RhoA的表达量呈正相关(r分别为0.318,0.408,P<0.05)。
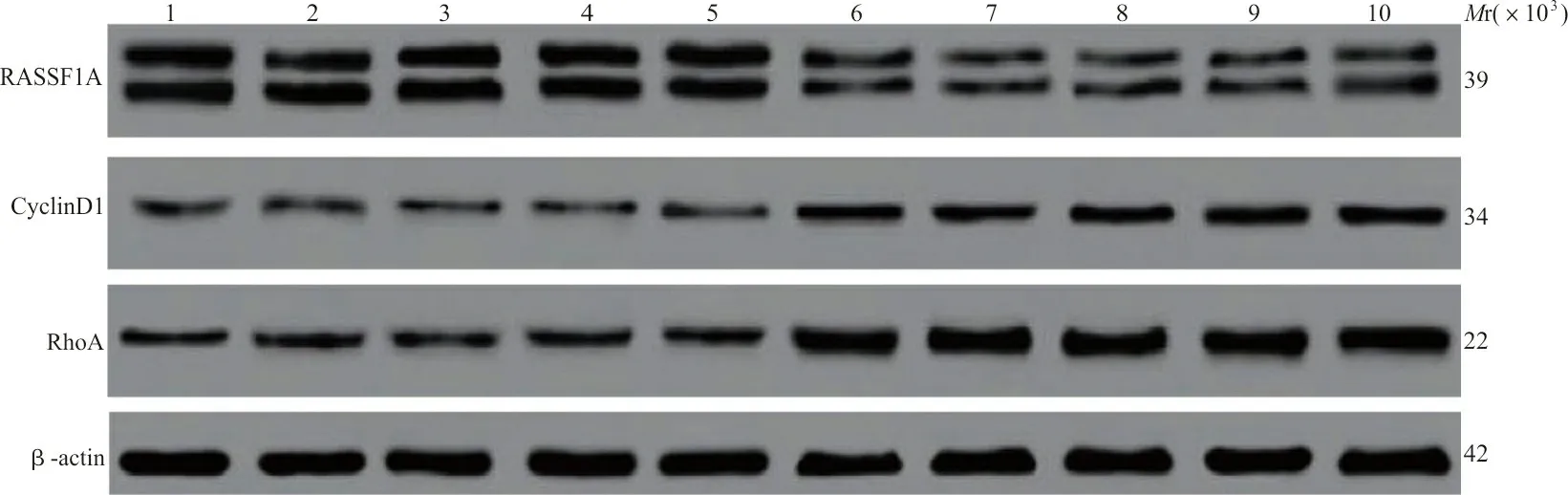
注:1~5为正常骨髓组织,6~10为MM骨髓组织。
表1 MM骨髓与正常骨髓中miR-181a及RASSF1A、cyclinD1、RhoA表达的比较

参数MM骨髓(n=40)正常骨髓(n=50)tPmiR-181a1.31±0.280.67±0.0913.880<0.001RASSF1A0.85±0.191.44±0.3111.108<0.001cyclinD10.65±0.130.34±0.0812.779<0.001RhoA0.95±0.210.60±0.149.049<0.001
2.2转染后U266细胞miR-181a的表达量 实时荧光定量PCR结果表明,转染24 h后,NC mimic组、miR-181a mimic组U266细胞中miR-181a的表达量分别为0.61±0.09和12.66±2.23,两组间差异有统计学意义(t=10.798,P<0.001)。而NC inhibitor组、miR-181a inhibitor组U266细胞中miR-181a的表达量分别为0.56±0.08和0.31±0.06,两组间差异亦有统计学意义(t=5.590,P<0.001)。
2.3转染后各组U266细胞的增殖活力 MTS法检测结果表明,转染后24 h,NC mimic组、miR-181a mimic组U266细胞的A450 nm值分别为0.51±0.07和0.86±0.17,两组间差异有统计学意义(t=4.257,P<0.05);NC inhibitor组、miR-181a inhibitor组U266细胞的A450 nm值分别为0.55±0.08和0.32±0.07,两组间差异亦有统计学意义(t=4.838,P<0.05)。
2.4转染后各组U266细胞的侵袭数目 Transwell试验检测结果表明,转染后24 h,NC mimic组、miR-181a mimic组U266细胞的侵袭数目分别为(10.29±2.12)个、(38.59±7.41)个,两组间差异有统计学意义(t=8.210,P<0.05);而NC inhibitor组、miR-181a inhibitor组U266细胞的侵袭数目分别为(11.41±2.76)个、(7.28±1.24)个,两组间差异亦有统计学意义(t=3.052,P<0.05)。见图2。
2.5miR-181a对RASSF1A及下游增殖、侵袭基因的调节作用 western blot结果表明,转染24 h后,miR-181a mimic组U266细胞中RASSF1A蛋白表达量明显低于NC mimic组(t=5.438,P<0.05),而cyclinD1、RhoA蛋白表达量明显高于NC mimic组(t分别为3.917,3.654,P<0.05);此外,miR-181a inhibitor组U266细胞中RASSF1A蛋白的表达量明显高于NC inhibitor组(t=3.464,P<0.05),cyclinD1、RhoA蛋白表达量明显低于NC inhibitor组(t分别为6.277,9.295,P<0.05)。见图3、表2。

图3 转染mimic(A)、inhibitor(B)后U266细胞中RASSF1A、cyclinD1、RhoA蛋白的表达

蛋白质NCmimicmiR-181amimicNCinhibitormiR-181ainhibitorRASSF1A1.54±0.260.81±0.151.25±0.211.83±0.31cyclinD10.55±0.070.84±0.150.71±0.120.32±0.07RhoA0.62±0.120.97±0.170.66±0.100.39±0.06
2.6miR-181a靶向RASSF1A3′UTR的验证 双荧光素酶报告基因检测表明,miR-181a mimic组野生型RASSF1A3′UTR荧光素酶报告基因的荧光活性值分别为0.291±0.062和0.173±0.035,两组间差异有统计学意义(t=3.315,P<0.05);而NC mimic组、miR-181a mimic组突变型RASSF1A3′UTR分别为0.289±0.051和0.295±0.042,两组间差异无统计学意义(t=0.182,P>0.05)。此外,miR-181a inhibitor组野生型RASSF1A3′UTR荧光素酶报告基因的荧光活性值分别为0.273±0.057和0.399±0.067,两组间差异有统计学意义(t=3.203,P<0.05);而NC inhibitor组、miR-181a inhibitor组突变型RASSF1A3′UTR分别为0.280±0.055和0.291±0.067,两组间差异无统计学意义(t=0.284,P>0.05)。
3 讨论
近年来,miR-181a在恶性肿瘤发生、发展中的作用受到越来越多关注。多项研究[6-8]证实,肝癌、胃癌、结直肠癌、宫颈癌等恶性肿瘤病灶内miR-181a的表达均升高。刘仁涛等[2]研究报道,miR-181a在MM骨髓组织中的表达水平(112.68±16.53)明显高于正常对照组(75.94±10.02),差异有统计学意义(P<0.01)。在本实验中,miR-181a在MM骨髓组织中的表达水平为1.31±0.28,亦明显高于正常骨髓组织(0.67±0.09),与刘仁涛等[2]的报道结果较为一致。结合已知的miR-181a靶向抑制多种抑癌基因并促进肿瘤细胞增殖、侵袭的效应分析报道[3-4],我们推测骨髓中高表达的miR-181a可能通过促进MM细胞的增殖、侵袭参与疾病的发生、发展。
本研究进一步在离体细胞中验证了miR-181a对MM细胞恶性生物学行为的调节作用。Sun等[9]研究证实,miR-181a靶向SRC激酶信号抑制剂(SRCIN1)促进结直肠癌细胞的血管新生。Le等[10]研究证实,miR-181a靶向视网膜母细胞瘤基因1(RB1)促进甲状腺癌细胞的生长。本实验中,转染miR-181a mimic后U266细胞中miR-181a的表达水平明显增加,而转染miR-181a inhibitor后细胞中miR-181a的表达水平明显减少。在转染后对细胞增殖和侵袭的观察结果显示,miR-181a mimic能够促进MM细胞的增殖和侵袭,miR-181a inhibitor能够抑制MM细胞的增殖和侵袭,表明miR-181a参与MM增殖和侵袭的调控。
miR-181a已经被证实能够靶向RASSF1A基因mRNA的3′UTR,抑制RASSF1A基因的表达[3-4]。RASSF1A作为重要的抑癌基因,能够通过抑制下游cyclinD1的表达以抑制细胞增殖,并抑制下游RhoA的表达以抑制细胞侵袭;当RASSF1A基因的表达被miR-181a抑制时,相应的抑癌作用也被削弱,进而参与多种恶性肿瘤的发生、发展过程[11-12]。在MM骨髓中,RASSF1A基因已经被证实呈显著低表达的趋势[2]。在本研究中,MM骨髓中RASSF1A的表达明显减少,而下游cyclinD1、RhoA的表达明显增多,表明RASSF1A介导的抑癌作用在MM中受到抑制。本实验还在U266细胞中观察到miR-181a mimic能够减少RASSF1A的表达,增加cyclinD1及RhoA的表达,miR-181a inhibitor能够增加RASSF1A的表达,减少cyclinD1及RhoA的表达,并且miR-181a mimic能够使RASSF1A3′UTR荧光素酶报告基因的荧光活性降低。以上结果表明miR-181a能够在MM中靶向抑制RASSF1A的表达,进而使下游cyclinD1及RhoA表达增加并促进细胞的增殖和侵袭。
综上所述,miR-181a能够促进MM细胞的增殖、侵袭并靶向抑制RASSF1A的表达;本研究存在以下不足之处:首先,收集的临床样本数量较少,今后需进一步扩大样本量,明确miR-181a在MM骨髓中的表达,并随访其与病情转归、预后的相关性;其次,虽然通过离体细胞证实了miR-181a促进MM细胞增殖和侵袭的作用,但缺乏活体实验数据,今后仍需进行动物实验及人体实验,以验证miR-181a在MM发生、发展中的作用。

