TRPC1对慢性阻塞性肺疾病慢性气道炎症的影响
吴晓娟 贾宝林 罗晓斌 邱容 罗文 李敏超 何正光
慢性阻塞性肺疾病(慢阻肺)是一种复杂的气道慢性炎症性病变,其特点是进行性、不完全可逆性气流受限[1]。慢阻肺发病率、致残率及死亡率逐年升高,目前已经上升为一种全球性的健康问题[2]。在吸烟、空气污染、感染等多种危险因素作用下,淋巴细胞、中性粒细胞、巨噬细胞、嗜酸性粒细胞导致气道慢性炎症反应,引起气道平滑肌细胞、成纤维细胞增生及细胞外基质沉积,从而出现慢阻肺典型的病理特征气道重塑[3]。瞬时受体电位通道C(transient receptor potential channel C,TRPC)是重要的细胞膜受体蛋白,在温度、酸、光、机械力等多种化学及物理刺激后该通道激活[4],钙离子内流,引起下游一系列反应。TRPC1是TRPC的亚家族之一[5],研究证明TRPC1在慢阻肺患者气道上皮细胞呈高表达状态[6]。故此,本研究主要探讨气道内TRPC1表达水平与慢阻肺患者慢性气道炎症之间的关系,并观察吸入型激素(inhaled glucocorticoid, ICS)布地奈德对TRPC1表达水平的影响。
资料与方法
一、研究对象
收集2017年7月~2018年2月遂宁市中心医院因肺部结节需行纤维支气管镜检查的46例慢阻肺患者和32例非慢阻肺患者。慢阻肺组纳入标准:符合中华医学会呼吸病学分会2013年慢性阻塞性肺疾病诊治指南的诊断标准;近1个月无急性加重且未合并肺部感染;胸部CT检查提示肺部结节直径≤3 cm;男女不限;年龄55~85岁。排除标准:有支气管扩张、哮喘、肺部感染、肺结核、严重免疫功能低下及免疫缺陷等疾病;合并有严重心、肝、肾功能不全,且不能耐受支气管镜检查的患者;有激素使用禁忌证者。对照组纳入标准:肺通气功能正常;胸部CT检查显示肺部结节直径≤3 cm;近1个月以来未服用激素及免疫抑制剂类药物;肺部未合并感染;男女不限;年龄55~85岁。合并有肺部感染、肺结核等基础肺疾病及其他系统严重性疾病不能耐受支气管镜检查者不纳入对照组。
慢阻肺组患者再随机分为ICS组(23例)及非ICS组(23例)。ICS组每日3次规律吸入布地奈德混悬液1 mg(阿斯利康制药有限公司,规格2 mL∶1 mg);非ICS组每日3次规律予以同等剂量安慰剂治疗。治疗前及治疗后3个月以同样方法行纤维支气管镜检查。告知所有受试者研究目的并签署知情同意书,该实验通过遂宁市中心医院伦理委员会批准后进行。
二、主要试剂
白细胞介素13(interleukin-13, IL-13)、成纤维细胞生长因子2(fibroblast growth factor-2, FGF-2)酶联免疫吸附试验(ELISA)试剂盒(武汉优尔生商贸有限公司);兔抗人TRPC1抗体(Abcam 公司);兔抗人GAPDH单克隆抗体和山羊抗兔IgG抗体(上海碧云天生物技术有限公司)。Trizol试剂盒(Invitrogen, CA, USA),SYBR Premix Ex TaqTM ⅡPCR kit、PrimeScript RT reagent Kit试 剂 盒、DL2000 marker(日本TaKaRa公司)。
三、方法
1 标本的收集 完善血常规、凝血功能、心电图、肺功能等检查后,受试者于纤维支气管镜下行支气管肺泡灌洗,回收率要求达40%~60%,灌洗液以 4 ℃ 1 500 r/min 离心10 min,上清液置于-80 ℃待检,留取细胞沉渣涂片,吉姆萨染色法染色后于光学显微镜下进行细胞分类计数[7]。支气管肺泡灌洗后在纤维支气管镜引导下采用防污染细胞刷(Anrei, LAMHCB-2012-2010,杭州)均于右肺中叶段或亚段支气管处进行刷检,刷检后将细胞刷收回导管内,将整个细胞刷退出气道外,刷检标本置于-80 ℃,待检。
2 Western Blot检测支气管上皮细胞中的TRPC1表达 方法按照参考文献[8]进行,细胞裂解液提取支气管上皮细胞总蛋白,BCA法进行蛋白定量。采用SDS-PAGE电泳将蛋白进行分离,然后转至PVDF膜,室温封闭1h后加入兔抗TRPC1多克隆抗体(1∶1 000),以GAPDH(1∶1000)作为内参,4℃孵育过夜,TBST洗膜三次。采用辣根过氧化酶标记的山羊抗兔IgG二抗(1∶1 000)室温孵育1h,TBST再次洗膜三次,ECL显影和定影。结果采用Quantity one软件进行分析,以与GAPDH产物的比值作为该蛋白的相对表达量。
3 qRT-PCR检测支气管上皮细胞TRPC1 mRNA的表达 Trizol法提取细胞总RNA。采用PrimeScript RT reagent Kit 试剂盒逆转录合成cDNA,以cDNA为模板进行扩增。扩增体系:SYBR Premix Ex TaqTM Ⅱ 12.5μL,引物1μL,cDNA 2 μL,ddH2O 8.5 μL。TRPC1引物序列:上游5′-GAAGATTTTGGGAAATTTCTGG-3′,下游5′-CTTATCCTCATGTTTGCTAT-3′。GAPDH引物序列:上游5′-AATCCCATCATCACCATCTTCCA-3′;下游5′-CCTGCTTCACCACCTTCTTGAGG-3′。反应条件:94 ℃预变性3 min;94 ℃变性15 s;55 ℃退火30 s;72 ℃延伸1 min;共进行35个循环,最后在72 ℃条件下延伸10 min。光密度(OD)分析采用Image J软件,与GAPDH比值作为目的基因的相对表达量。
4 BALF中炎症介质IL-13、FGF-2的检测 ELISA法检测BALF上清液IL-13和FGF-2浓度,操作方法按试剂盒说明进行。
四、统计学方法

结 果
一、受试者年龄、吸烟史及肺功能等临床特征比较
对照组和慢阻肺组的年龄、吸烟指数、性别比较,无统计学意义,具有可比性。而肺功能检查结果显示,与对照组相比较,慢阻肺组患者的第一秒用力呼气容积/用力肺活量(FEV1/FVC%)、FEV1占预计值百分比(FEV1/Pre%)、第一秒用力呼气容积(FEV1)、用力肺活量(FVC)均显著降低,差异具有统计学意义。ICS组和Non-ICS组在年龄、吸烟史、性别及肺功能FEV1/FVC%、FEV1/Pre%、FEV1、FVC方面相比,差异无统计学意义,具有可比性(见表1,2)。
二、TRPC1蛋白在支气管上皮细胞中的表达水平
Western Blot检测结果表明,相比于对照组,慢阻肺组支气管上皮细胞TRPC1蛋白表达水平明显升高,差异具有统计学意义(P<0.01);同时,使用布地奈德后TRPC1表达量下降,ICS组支气管上皮细胞的TRPC1蛋白表达水平低于非ICS组,差异具有统计学意义(P<0.05)(图1~3)。
三、qRT-PCR测定TRPC1mRNA在支气管上皮细胞中的表达情况
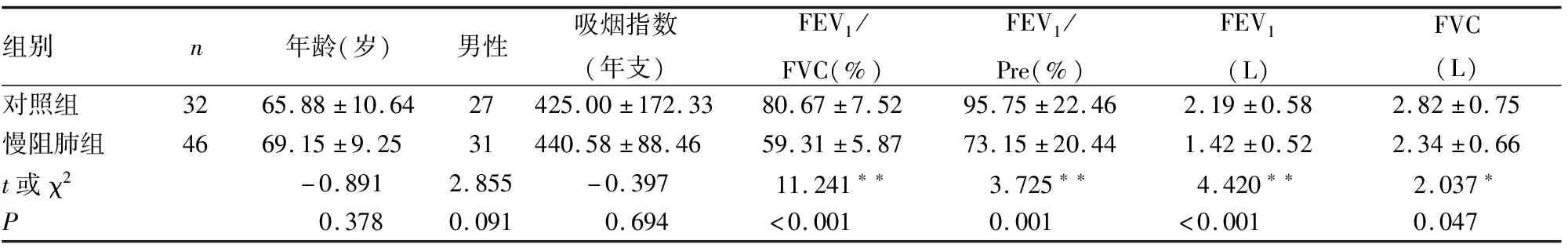
表1 对照组和慢阻肺组受试者各特点比较
注:*P<0.05,**P<0.01

表2 ICS组和Non-ICS组临床特点比较
注:均P>0.05
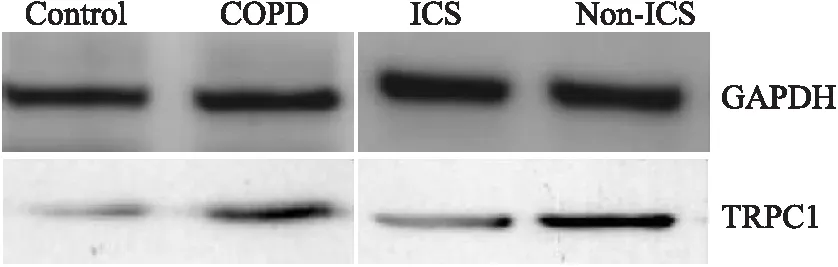
图1 Western blot检测各组支气管上皮细胞的TRPC1蛋白表达水平

图2 对照组和慢阻肺组中的TRPC1蛋白相对表达量

图3 ICS组和非ICS组中的TRPC1蛋白相对表达量
qRT-PCR结果显示,慢阻肺组和对照组TRPC1mRNA表达量分别为(1.30±0.99)、(0.29±0.15),慢阻肺组支气管上皮细胞中的TRPC1mRNA表达水平显著高于对照组,差异具有统计学意义(P<0.05)(图4);而非ICS组和ICS组TRPC1mRNA表达量为(1.78±1.29)、(0.91±0.59),未吸入ICS的患者与吸入ICS的患者相比,支气管上皮细胞中的TRPC1mRNA表达量明显增加(P<0.05)(见图5)。
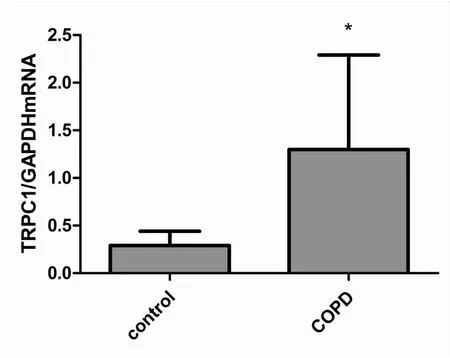
图4 qRT-PCR法测定对照组和慢阻肺组支气管上皮细胞内的TRPC1mRNA表达水平

图5 qRT-PCR法测定ICS组和非ICS组支气管上皮细胞内的TRPC1mRNA表达水平
四、支气管肺泡灌洗液(bronchoalveolar lavage fluids, BALF)中的细胞学分类计数
如表2所示,与对照组相比,慢阻肺组BALF中的中性粒细胞、巨噬细胞、淋巴细胞数增多,差异具有统计学意义(P<0.05),但是两组BALF中的嗜酸性细胞计数相互比较则无明显差异性(P>0.05)(表2)。长期规律使用ICS的慢阻肺患者BALF中的中性粒细胞、巨噬细胞、嗜酸性粒细胞和淋巴细胞数较未使用ICS的慢阻肺患者均降低(P<0.05)(见表3)。
表2 对照组和慢阻肺组BALF中的细胞学分类计数
注:**P<0.01
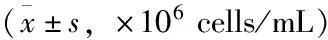
表3 ICS组和非ICS组 BALF中的细胞学分类计数
注:*P<0.05,**P<0.01
五、ELISA法检测 BALF中的FGF-2, IL-13表达水平
慢阻肺组BALF中的炎性因子FGF-2, IL-13表达水平显著高于对照组,差异具有统计学意义(P<0.01)(表4)。相比于非ICS组,ICS组BALF中的FGF-2, IL-13表达量明显降低(P<0.05)(见表5)。
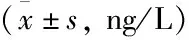
表4 对照组和慢阻肺组BALF中的FGF-2, IL-13表达水平
注:**P<0.01
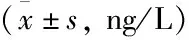
表5 ICS组和非ICS组BALF中的FGF-2, IL-13表达水平
注:*P<0.05
六、相关性分析
相关性分析结果显示,TRPC1mRNA及蛋白表达水平均与FEV1/Pre%呈负相关关系(r=-0.505,r=-0.443,P<0.01);而TRPC1蛋白表达水平与BALF中性粒细胞、淋巴细胞、巨噬细胞数呈正相关关系(r分别为0.401,0.530,0.451,P<0.05),TRPC1mRNA表达水平与BALF中性粒细胞、淋巴细胞、巨噬细胞数也呈正相关关系(r分别为0.551,0.539,0.378,P<0.05)。同时,发现支气管上皮细胞的TRPC1蛋白表达水平与BALF中的IL-13、FGF-2浓度之间呈正相关关系(r分别为0.373,0.318,P<0.05),TRPC1mRNA表达水平与BALF中IL-13、FGF-2浓度同样呈正相关关系(r分别为0.422,0.327,P<0.05)。
讨 论
慢性阻塞性肺疾病是一种复杂的慢性气道炎症性疾病,在多种炎性细胞及炎性介质的反复刺激下,支气管上皮细胞增生、鳞状细胞和杯状细胞化生、胶原蛋白沉积、基质纤维化及小血管生成,导致气道重塑,从而使得该类患者出现不完全可逆性气流受限。本研究结果发现,慢阻肺患者的TRPC1通道蛋白水平及mRNA表达量均显著高于正常人,该实验结果与Xu 等[9]的结果相符。近几年发现,TRPC1是哺乳动物细胞的一种新型Ca2+通道[10],在各种物理、化学等因素刺激下,该通道打开,胞内第二信使Ca2+内流增加,通过TRPC1-Ca2+-PKC信号途径上调炎性因子FGF-2、MMP-9、TGF-β1、IL-13等的生成,促进气道重塑[11-12],故我们认为TRPC1在慢阻肺气道重塑过程中起重要作用。
TRPC1除了在中性粒细胞、巨噬细胞、淋巴细胞中表达外,还诱导中性粒细胞迁移及趋化,在炎症反应过程中起重要作用[13]。同时,我们的实验证明,慢阻肺患者BALF中的巨噬细胞、中性粒细胞、淋巴细胞数及炎症介质IL-13、FGF-2 水平明显高于正常人,相关性分析结果显示,TRPC1表达水平与BALF的中性粒细胞、巨噬细胞、淋巴细胞数及IL-13、FGF-2浓度呈正相关关系,而TRPC1表达量与肺功能FEV1/Pre之间呈负相关关系。Eda Yildirim等的实验也发现,TRPC1-/-组小鼠比TRPC1+/+组BALF中的淋巴细胞、巨噬细胞等细胞数显著减少[14]。由于慢阻肺患者气道内TRPC1呈高表达状态,因此,我们认为TRPC1激活后,胞内Ca2+内流,通过TRPC1-Ca2+-PKC信号通路提高巨噬细胞、中性粒细胞、淋巴细胞数及炎性因子的表达水平从而促进气道慢性炎症反应,加重慢阻肺疾病的发展。我们的实验首次发现,TRPC1可能通过参与慢性气道炎性反应过程,出现慢阻肺典型的病理变化特征气道重塑,导致慢阻肺患者气流受限不完全可逆、急性发作次数增加及肺功能的进行性下降。
前期的动物实验证实,TRPC1与气道慢性炎症及气道重塑密切相关,而吸入型激素布地奈德在一定程度上可通过下调TRPC1的表达干预气道重塑过程[15],本研究发现,规律使用ICS的慢阻肺患者气道上皮细胞TRPC1表达量和BALF中的巨噬细胞、中性粒细胞、嗜酸性粒细胞、淋巴细胞数及炎症介质IL-13、FGF-2 水平显著低于未使用ICS的慢阻肺患者,故此,我们推测ICS可能通过干预TRPC1的表达及炎性细胞和炎症介质的合成,从而减轻慢阻肺患者气道慢性炎症反应过程,改善患者肺功能。
综上所述,本研究证实,TRPC1通道在可能通过参与慢阻肺气道炎性细胞及炎症介质的合成从而在慢性气道炎症反应过程中起重要作用,而ICS在一定程度上可能通过下调该作用减缓气道炎症反应过程,减轻慢阻肺疾病的发生、发展。

