白藜芦醇抑制重组人白细胞介素11促进肺腺癌转移灶形成实验研究*
彭 娜,卢美君,康马飞,刘秀丽,李碧慧,董翠梅
桂林医学院附属医院肿瘤内科(桂林541001)
肺癌是我国最常见的恶性肿瘤之一,尽管近年来外科手术、放疗和药物治疗等治疗水平在不断提高,但肺癌患者的病死率仍居高不下,死亡原因主要是肿瘤转移。肿瘤转移是一个复杂的、多步骤的演变过程。肿瘤细胞要完成转移过程,必须经历从原发瘤中脱落、进入血管和(或)淋巴管、在循环中生存、粘附于继发器官微血管、渗出血管和(或)淋巴管、进入继发器官组织、形成微转移瘤并诱发血管发生,最终形成转移瘤。
临床化疗过程中,血小板减少是非常常见的毒副反应,目前最常用的升血小板药物是重组人白细胞介素11(Recombinant human interleukin 11,rhIL-11)。然而,在胃肠癌中的研究显示,外源性白细胞介素11可使胃癌AGS 和 MKN45细胞迁徙率增加[1],提示IL-11可能促进肿瘤侵袭和转移。我们科研团队的基础研究也证实,rhIL-11作用于A549细胞后,细胞的迁移和侵袭能力显著增强[2]。临床研究提示,rhIL-11可能促进肺癌转移[3]。那么,有什么药物能抑制rhIL-11促肿瘤细胞转移呢?我们以肺腺癌A549细胞为研究对象,通过动物实验观察rhIL-11促肿瘤转移灶形成作用和评价白藜芦醇的抗肿瘤转移灶形成作用。
材料与方法
1 细胞培养 将A549细胞从液氮中取出,快速放入37℃水浴锅中,使冻存液溶解,将溶解后冻存液转移到含有5 ml培养基的离心管中,室温1200 rmp 3 min离心收集细胞,弃上清;用含10%胎牛血清的DMEM完全培养基重悬细胞,轻轻吹打混匀,接种到培养皿中,37℃ 5%CO2饱和湿度条件下培养。当显微镜下观察贴壁细胞生长80%以上,0.25%胰蛋白酶消化传代,按1∶3的比例传代。收集对数生长的A549细胞,消化并用PBS重悬成1×107/ml的单细胞悬液。
2 动物模型分组及处理
2.1 经尾静脉注射造模:雌性BALB/C裸鼠,18~22 g,裸鼠由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2016-0002。裸鼠在SPF条件下饲养,给与全价小鼠颗粒饲料,自由采食和饮水。实验单位使用许可证号:SYXK桂2013-0001。BALB/C裸鼠适应性饲养1周,每组数量6只,经尾静脉注射肺癌细胞后连续给药2周,第6周结束时处死裸鼠,并解剖观察有无腹腔、胸腔、肺、肝、肾等远处转移,拍照并取疑似部位置于4%多聚甲醛中固定,行病理HE染色检查。
2.2 给药治疗分组:①对照组:于裸鼠后背部皮下注射生理盐水。②低剂量rhIL-11组:于裸鼠后背部皮下注射rhIL-11[500 μg/(kg·d)],连用14 d。③高剂量rhIL-11组:于裸鼠后背部皮下注射rhIL-11[750 μg/(kg·d)],连用14 d。④低剂量rhIL-11+白藜芦醇组:于裸鼠后背部皮下注射rhIL-11[500 μg/(kg·d)]+白藜芦醇[10 mg/(kg·d),灌胃](同时给药,两药均使用14 d)。⑤高剂量rhIL-11+白藜芦醇组:于裸鼠后背部皮下注射rhIL-11[剂量750 μg/(kg·d)]+白藜芦醇[10 mg/kg·d),灌胃](同时给药,两药均使用14 d)。
2.3 转移灶的取材及HE染色:①将各组中可疑的肿瘤转移灶完整切除,并置于4%多聚甲醛中固定。②将固定好的组织放入包埋盒中,用铅笔在包埋盒上做好样本标记,进行手动脱水。75%乙醇4 h,85%乙醇2 h,90%乙醇5 h,95%乙醇1 h,无水乙醇Ⅰ 0.5 h,无水乙醇Ⅱ 0.5 h。③组织透明:无水乙醇:二甲苯(1∶1)10 min,二甲苯Ⅰ 10 min,二甲苯Ⅱ 7 min。④浸蜡:用生物组织脱水机将透明后的组织块依次经3缸石蜡(60℃)进行浸蜡,每次各1 h。⑤包埋:在冰盒上,将浸透蜡的组织放入不锈钢组织包埋模中,使其包裹在石蜡块中。⑥切片和展片。⑦脱蜡:将石蜡切片依次放入二甲苯Ⅰ(10 min)-二甲苯Ⅱ(10 min)-无水乙醇Ⅰ(5 min)-无水乙醇Ⅱ(5 min)-95%酒精(3 min)-90%酒精(3 min)-80%酒精(2 min)-70%酒精(2 min),然后蒸馏水浸洗2 min。⑧封片:苏木素染色20 s,自来水冲洗5 min,1%盐酸酒精分化1 s,水洗返蓝10 min,无水乙醇I 5 min,无水乙醇Ⅱ 5 min,二甲苯I 5 min,二甲苯Ⅱ 5 min,风干后中性树胶封片,镜检。
3 统计学方法 使用SPSS 20.0统计学软件进行分析,计数资料的比较采用χ2检验,P<0.05为差异具有统计学意义。
结 果
rhIL-11组[750 μg/(kg·d)组和500 μg/(kg·d)组]出现转移病灶显著多于对照组(Fisher精确概率法,P=0.026)。rhIL-11[750 μg/(kg·d)+白藜芦醇组和500 μg/(kg·d) +白藜芦醇组]出现转移病灶显著少于rhIL-11[750 μg/(kg·d)组和500 μg/(kg·d)组](χ2=4.216,P=0.040)。见表1、图1。

表1不同浓度rhIL-11对A549细胞远处转移的影响及白藜芦醇的干预效果(n=6)
讨 论
研究认为,IL-11可以促进肿瘤的生长和转移,IL-11高表达是恶性肿瘤患者预后不良的独立预测因子[4-6]。研究认为IL-11受体(IL-11R)是肿瘤转移决定因素[7]。本研究显示,与对照组相比,使用rhIL-11的裸鼠出现肿瘤病灶的裸鼠数量增大,而且随着rhIL-11剂量增加,出现转移灶的裸鼠数量及转移灶数量均增大,提示rhIL-11可能有促进肿瘤转移灶形成作用。虽然使用rhIL-11后出现转移灶的裸鼠数量与对照组相比较无统计学差异,但绝对数有较大差别,考虑是由于样本量太小而导致没有统计学差异,值得加大样本量进一步研究。
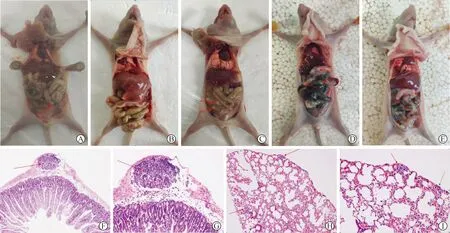
注:图A、B、C、D、E分别是对照组、rhIL-11[500 μg/(kg·d)]组、rhIL-11[500 μg/(kg·d)]+白藜芦醇组、rhIL-11[750 μg/(kg·d)]组和rhIL-11[750 μg/(kg·d)]+白藜芦醇组的腹腔转移灶;图F和G是肠转移灶的HE染色×100和×200光镜图;图H和I是肺转移灶的HE染色×100和×200光镜图
图1 rhIL-11和白藜芦醇对肺癌A549细胞远处转移的影响
白藜芦醇(3,5,4’-三羟基-反式二苯乙烯)是一种植物抗氧化剂,存在于红葡萄中,对各种恶性肿瘤的发生有抑制作用[8]。有研究发现,白藜芦醇通过抑制Notch1和PTEN/Akt信号通路诱导和促进caspase依赖性细胞死亡[9],阻止TNF-β/ TNF-β受体诱导激活NF-κB信号通路和NF-κB调节基因产物,从而介导多靶点细胞信号通路抗肿瘤[10]。白藜芦醇具有抑制癌细胞增殖,以及诱导细胞周期阻滞和凋亡的作用[11-12],白藜芦醇可能通过调节BCL-2、 Bax、P53的表达抑制胰腺癌移植瘤的生长[13]。通过诱导凋亡、调节DNA甲基化和组蛋白修饰协同抑制癌细胞[14-16]。最近的研究表明,白藜芦醇可以抑制肿瘤微环境应激(如缺氧、氧化应激和炎症)引起的肿瘤细胞的恶性表型[17-19],抑制血管生成[20]。在肿瘤治疗方面,白藜芦醇有与化放疗、内分泌治疗等协同提高疗效作用[21-25],有逆转化疗耐药[26-27]和降低化放疗不良反应作用[28],上述研究提示,白藜芦醇通过多种机制抑制肿瘤细胞生长和影响肿瘤微环境。其中,白藜芦醇抑制肿瘤血管生成可能与其抑制肿瘤转移灶形成密切相关。本研究显示,rhIL-11+白藜芦醇组出现转移病灶的裸鼠数小于rhIL-11处理组(3/12对7/12),虽然差异无统计学意义,但绝对数有较大差别,而且在转移灶个数方面,rhIL-11+白藜芦醇组也小于rhIL-11组(5个对13个),绝对数也有较大差别。两组之间的差别无统计学意义考虑与样本量太小有关。故本研究认为,rhIL-11可能促进肺腺癌A549细胞的转移灶形成,而白藜芦醇可以减少肿瘤转移灶的形成,有待于增加样本量进一步研究。
分期越晚的肿瘤患者,循环中的肿瘤细胞就越多,循环肿瘤细胞的多少也成为评估预后的指标之一[29-30],循环中的肿瘤细胞在有利于肿瘤细胞生长的环境下就可以形成转移瘤病灶。本研究从裸鼠的尾静脉注入肺腺癌A549细胞,模拟循环肿瘤细胞。与rhIL-11处理组比较,rhIL-11+白藜芦醇组出现转移病灶的裸鼠数(3/12对7/12)以及转移灶个数(5个对13个)均较小,考虑白藜芦醇可能影响肿瘤微环境,阻碍循环肿瘤细胞形成转移病灶。
综上所述,rhIL-11可促进肺腺癌A549细胞转移灶的形成,而白藜芦醇可抑制转移病灶的形成。

