空气放电处理对尖孢镰刀菌生理代谢和细胞膜的影响
刘梦蝶,李彩云,李 洁,2,3,,严守雷,2,3,王清章,2,3
(1.华中农业大学食品科技学院,湖北 武汉 430070;2.环境食品学教育部重点实验室,湖北 武汉 430070;3.湖北省水生蔬菜保鲜加工工程技术研究中心,湖北 武汉 430070)
莲藕(Nelumbo nucifera Gaertn.)是我国最具特色、栽培面积最大的水生经济作物,目前,莲藕已成为我国重要的出口创汇蔬菜之一。莲藕水分质量分数高达78%,营养成分丰富,贮运过程中易于褐变和腐败,成为制约其出口的主要因素[1-2]。实验室前期研究发现,尖孢镰刀菌(Fusarium oxysporum)为莲藕采后的主要腐败菌[3]。
空气放电保鲜法是通过采用非均电场无声放电或电晕放电使空气电离产生放电生成气,主要是臭氧(ozone,O3)和负离子(negative air ion,NAI)(包括O2-、H2O-、O3-等),用一定浓度的放电生成气对果品进行短期处理或长期贮藏使环境中保持一定浓度的放电生成气,从而抑制果实呼吸,减少果品腐烂,延长果蔬贮藏期的保鲜技术[4-5]。空气放电保鲜技术具有能耗低、操作简便、安全环保等特点,针对空气放电的大部分研究集中在以果品贮藏保鲜为代表的保鲜技术的应用,对空气放电生成气抑菌机理的研究相对而言较少,本实验研究空气放电处理对莲藕采后的腐败菌尖孢镰刀菌的抑菌作用。
空气放电技术的抑菌作用主要体现在臭氧和负离子都有很高的氧化活性,其作用于细胞壁,能够影响甚至破坏细胞壁(膜)结构和功能,影响细胞内酶的活性,造成细胞正常生理紊乱,从而抑制和杀灭病原菌[2,6]。利用本实验室已获专利授权的空气放电装置[7]对莲藕采后主要腐败菌尖孢镰刀菌进行抑菌实验,结果显示空气放电处理能显著抑制该菌菌丝生长和孢子萌发,对其细胞结构具有明显的破环作用[8-9]。微生物细胞膜的保护及传递信息的功能与整个细胞生命活动息息相关,本实验将从物质代谢和能量代谢角度研究空气放电处理对尖孢镰刀菌生理代谢的影响,并在此基础上研究空气放电处理对尖孢镰刀菌细胞膜完整性、流动性等生理功能的影响,从细胞水平阐明空气放电处理对尖孢镰刀菌的影响,为空气放电处理抑制莲藕腐败及其在果蔬保鲜中的应用提供科学依据。
1 材料与方法
1.1 菌株、材料与试剂
尖孢镰刀菌(Fusarium oxysporum)为莲藕贮藏期病原菌,经本实验室分离、纯化、鉴定后保存备用。
马铃薯葡萄糖培养基(potato dextrose agar,PDA)北京陆桥责任技术有限公司;马铃薯葡萄糖液体培养基(potato dextrose broth,PDB) 国药集团化学试剂有限公司;ATP检测试剂盒 上海碧云天生物技术有限公司;碘化丙啶(propidium iodide,PI) 上海贝博生物科技有限公司;1,6-二苯基-1,3,5-己三烯(1,6-diphenyl-1,3,5-hexatriene,DPH)、DiBAC4(3) 美国Sigma公司。
1.2 仪器与设备
QT2SVP500一体化臭氧发生器 深圳市松野电器有限公司;MIC-03臭氧变送器 深圳市蓝月测控技术有限公司;TFB-YA278负离子发生器 天长市创普电子有限公司;DM-3000荧光显微镜 德国Leica公司;guava easyCyte 8流式细胞仪 美国Merck Millipore公司;Oxygraph液相氧电极 英国Hansatech公司。
1.3 方法
1.3.1 实验分组及处理
F. oxysporum在PDA平板上培养7 d后,在菌落边缘打出直径6 mm的菌饼移至新的PDA平板中央,当密闭空气放电设备内ozone和NAI生成气达到设定浓度后将样品放入:ozone组(浓度6.87 mg/m3)、NAI组(浓度5×106ions/cm3)、ozone+NAI组(6.87 mg/m3ozone+5×106ions/cm3NAI同时处理),每组均处理18 h,重复3 皿,以不做任何处理为对照(CK组)。各处理组分别取4 个菌饼移至100 mL PDB培养基中,摇瓶培养5 d(26 ℃、120 r/min),抽滤得菌丝真空冷冻干燥后保存。
1.3.2 能源物质质量分数的测定
1.3.2.1 总糖质量分数的测定
参照吴方丽[10]的方法进行测定。精确称取不同处理的干菌丝0.25 g,加蒸馏水50 mL、浓硫酸7.5 mL,煮沸5 min。冷却至室温,用3 mol/L NaOH溶液中和至中性。定容至250 mL,过滤。取滤液10 mL置于三角瓶中,然后加入斐林试剂a、b液各5 mL,微沸2 min后加次甲基蓝指示剂2 滴。在沸腾状态下用质量分数0.1%葡萄糖溶液滴定至蓝色正好褪去,记录葡萄糖溶液的消耗量,按式(1)计算总糖质量分数。
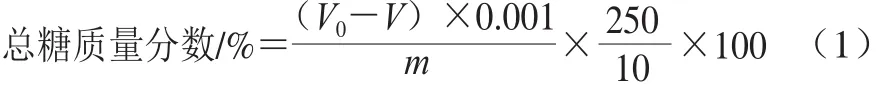
式中:V0为空白实验消耗的葡萄糖溶液体积/mL;V为样品消耗的葡萄糖溶液体积/mL;m为样品质量/g。
1.3.2.2 蛋白质量分数的测定
参照杜亚楠[11]的方法进行测定。精确称取不同处理的干菌丝0.05 g,分别放入干燥的三角瓶中。然后在各瓶中分别加入5 mL 0.05 mol/L的NaOH溶液湿润,之后再加入20 mL双缩脲试剂,漩涡振荡5 min,室温静置反应30 min,在540 nm波长处测定上清液吸光度。蛋白质量分数按式(2)计算。
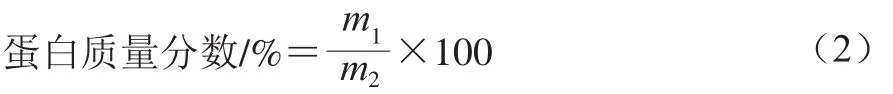
式中:m1为从标准曲线上查得的蛋白质量/mg;m2为样品质量/mg。
1.3.2.3 脂肪质量分数的测定
参照张宪利等[12]的方法进行测定。精确称取不同处理的干菌丝0.45 g用定量滤纸包好,置于索氏脂肪抽提器中。连接已恒质量的抽脂瓶,加入无水乙醚。55 ℃水浴加热提取14 h左右。提取完毕后,水浴蒸去残留乙醚,再于100~105 ℃烘箱中干燥8 h至恒质量。脂肪质量分数按式(3)计算。
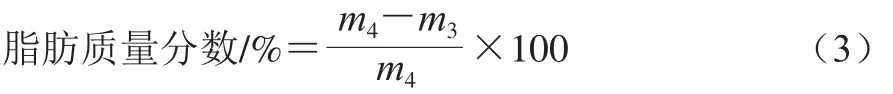
式中:m3为提取后残留样品干质量/mg;m4为样品干质量/mg。
1.3.3 菌丝能量代谢的分析
1.3.3.1 呼吸作用的测定
将培养7 d的PDA平板放入空气放电设备中处理:ozone(浓度6.87 mg/m3)组、NAI(浓度5×106ions/cm3)组、ozone(6.87 mg/m3)+NAI同时处理(5×106ions/cm3)组每组各处理3 h后,轻轻刮下菌丝,准确称取0.05 g,放入含2 mL蒸馏水的反应杯中。参考Clark型氧电极的极谱法测定菌丝体的呼吸作用[13]。呼吸影响率按式(4)计算,正值表示促进,负值表示抑制。

式中:R为处理组耗氧速率/(nmol/(min·mg));R0为对照组耗氧速率。
1.3.3.2 ATP含量的测定
F. oxysporum空气放电处理同1.3.1节,不同处理组的平板在26 ℃生化培养箱避光培养7 d后将菌丝轻轻刮下,加入2 mL裂解液冰上研磨匀浆裂解,然后4 ℃ 12 000×g离心5 min,取上清液备用。按照体积比1∶9的比例用稀释液稀释ATP检测试剂得工作液,加100 μL ATP检测工作液到检测孔,室温放置3~5 min,以使本底性的ATP全部被消耗掉。再向孔内加上20 μL样品或标准品,3~5 s后置于荧光酶标仪中检测化学发光。
1.3.4 空气放电处理对尖孢镰刀菌细胞膜的损伤
PDA平板菌丝培养及处理同1.3.1节,取不同组的平板,将其产生的分生孢子用无菌水润洗下,离心收集孢子(4 ℃、1 000×g、5 min),磷酸盐缓冲液(phosphate buffered saline,PBS)悬浮。在接种菌饼后的PDA平板中插入灭菌盖玻片同1.3.1节中空气放电处理,培养7 d后,轻轻取出爬好菌丝的盖玻片。
1.3.4.1 细胞膜完整性的测定
孢子染色:取洗涤后的孢子细胞,调整细胞浓度约为107个/mL,取100 μL细胞悬液,加入5 μL PI染液,轻轻混匀,室温避光染色10 min,制作玻片置于荧光显微镜观察[14]。
菌丝染色:用PBS将PI染色液20 倍稀释,取出爬好菌丝的盖玻片,加适量染色液于玻片上,室温避光染色10 min,用PBS洗涤玻片2 次,吸水纸小心擦干,置于荧光显微镜下观察[15]。
1.3.4.2 细胞内容物渗出的测定
F. oxysporum在PDA平板上培养7 d后,在菌落边缘打出直径6 mm的菌饼取4 块移至灭菌后的100 mL PDB培养基中,摇瓶培养3 d(26 ℃、120 r/min),经3 层无菌纱布过滤冲洗收集菌丝,加入100 mL PBS(0.05 mol/L、pH 7.0)摇匀,移取10 mL至直径9 cm培养皿,轻轻摇晃使其摊匀在培养皿中,处理组将皿移至空气放电设备内各不同处理的浓度同1.3.1节,分别处理6 h和12 h,每个处理重复3 皿,以不做任何处理为对照。
胞内电解质的渗出:收集菌液,测其电导率[16]。
胞内大分子物质的渗出:收集处理后的菌液,12 000×g离心2 min,取上清液在260 nm波长处测其吸光度[17]。
1.3.4.3 细胞膜流动性的测定
取6.97 mg DPH溶于四氢呋喃得3 mmol/L DPH染色母液4 ℃冷藏备用。稀释得浓度为1×107个/mL的孢子悬液,用体积分数0.37%甲醛溶液固定30 min,PBS洗涤后加入DPH染色液使其终浓度为0.3 mmol/L,室温染色45 min,PBS洗涤后置于荧光分光光度计检测。激发波长为361 nm,发射波长为443 nm[18]。
1.3.4.4 细胞膜电位的测定
取DiBAC4(3)染料25 mg溶于PBS配制成0.1 mg/mL的母液,4 ℃冷藏备用。PBS稀释得50 μg/mL的DiBAC4(3)染色液,适量孢子细胞重悬于500 μL染色液中浓度为1×106个/mL,避光孵育1 h,PBS洗涤2 次,置于流式细胞仪检测,激发波长488 nm,收集绿色荧光[19]。
1.4 数据统计分析
所有实验重复3 次,使用DPS 7.05统计软件对数据进行处理。采用Tukey法和LSD法多重比较各处理组之间的差异性。采用Origin 8.0软件进行数据处理和图表制作,流式细胞仪图像由Flowjo 7.6软件进行处理。
2 结果与分析
2.1 空气放电对尖孢镰刀菌能源物质代谢的影响
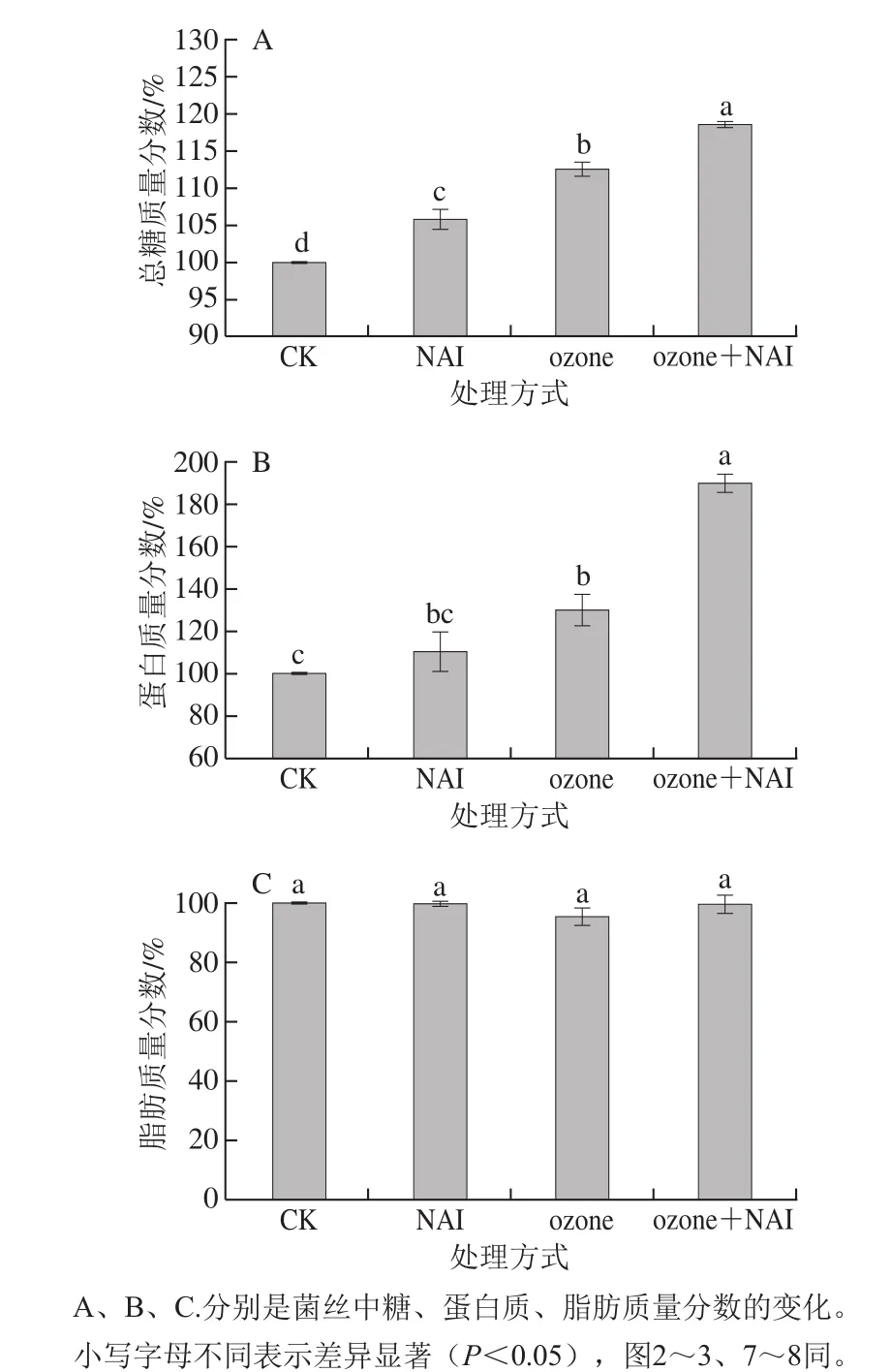
图 1 空气放电对尖孢镰刀菌能源物质代谢的影响Fig. 1 Effect of air discharge on energy metabolism of F. oxysporum
糖、脂和蛋白质是微生物主要的能源物质,对生物体的生长发育至关重要。空气放电处理后,图1A中菌丝总糖质量分数显著高于CK组(P<0.05),并且ozone+NAI处理组显著高于ozone和NAI单独处理组(P<0.05);对于菌丝蛋白质量分数,ozone+NAI处理组和ozone单独处理组显著高于CK组(P<0.05),且ozone+NAI处理组作用效果最为明显(图1B);由图1C可以看出,空气放电处理对菌丝脂肪质量分数无显著影响。
空气放电处理后菌丝糖和蛋白质产生积累,初步断定是由于分解代谢受到抑制[10-11]。脂肪作为后备能源物质,在糖类物质供给不足的情况下才加以利用,处理组本身糖类含量充足,故脂肪含量未发生变化[10]。
2.2 空气放电对尖孢镰刀菌呼吸作用的影响
由图2可知,NAI、ozone和ozone+NAI 3 种不同处理显著抑制菌丝的呼吸作用(P<0.05),且呼吸抑制率分别为14.74%、54.65%、58.47%,ozone+NAI处理组和ozone单独处理组作用效果显著优于NAI单独处理组(P<0.05),空气放电处理显著抑制了尖孢镰刀菌菌丝体的呼吸作用,ozone的抑制效果强于NAI。

图 2 空气放电对尖孢镰刀菌呼吸作用的影响Fig. 2 Effect of air discharge on respiration of F. oxysporum
2.3 空气放电对尖孢镰刀菌ATP含量的影响
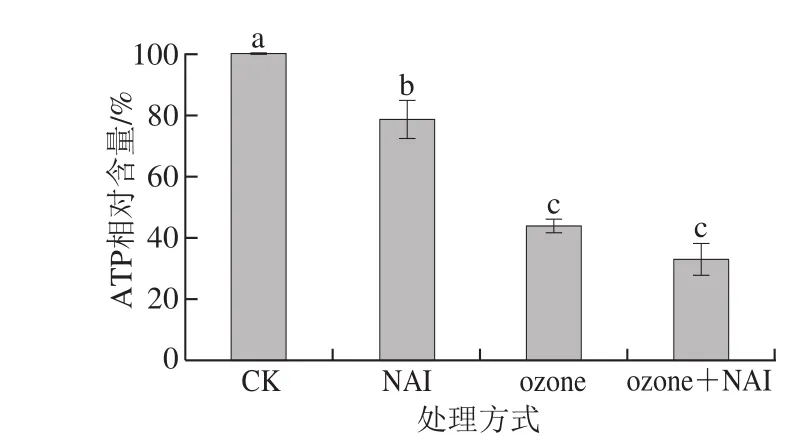
图 3 空气放电对尖孢镰刀菌ATP相对含量的影响Fig. 3 Effect of air discharge on relative ATP content of F. oxysporum
3 种不同处理后菌丝内ATP含量均显著减少(P<0.05),ozone和ozone+NAI对ATP合成的抑制效果显著强于NAI处理组(P<0.05)。线粒体是细胞有氧呼吸合成ATP的主要场所,呼吸耗氧量(图2)及能量(图3)减少,说明菌丝线粒体功能受到破坏。
空气放电处理导致菌丝细胞糖和蛋白质含量增多,呼吸强度减弱,结合处理后菌丝生长受到抑制,判定空气放电处理抑制了菌丝的分解代谢,而呼吸作用正是物质氧化分解、释放能量的过程,与处理后菌丝ATP含量显著减少的结果相互印证。
2.4 空气放电对尖孢镰刀菌细胞膜完整性的影响
PI是一种DNA结合性染料,其激发和发射波长分别为488 nm和630 nm,产生红色荧光,但无膜通透性,不能透过活细胞膜,只能染死细胞。在荧光显微镜下观察,红色荧光越强,则说明细胞膜损伤越严重。
由图4可见,暗场中观察,CK组孢子细胞PI染色荧光强度微弱,处理组(NAI、ozone和ozone+NAI)中细胞荧光强度明显增强,其中ozone+NAI处理组荧光最强,说明空气放电处理破坏了细胞膜的完整性。已有研究运用相同染色方法发现一些抗菌剂及重金属离子对细菌的细胞膜也存在不同程度的损伤[20-21]。
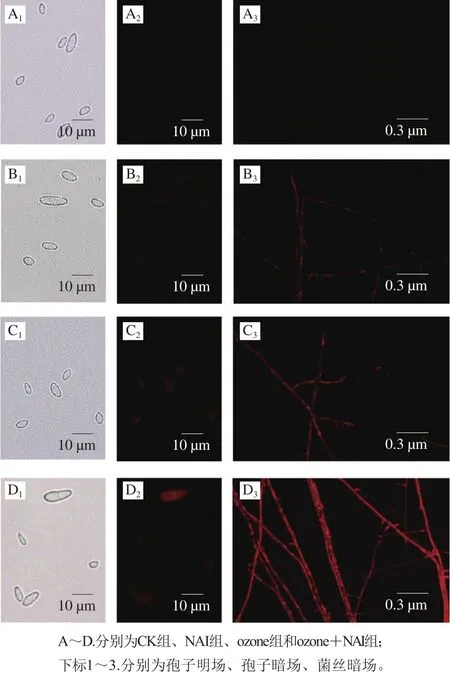
图 4 尖孢镰刀菌PI染色结果Fig. 4 PI staining of F. oxysporum
2.5 空气放电处理对尖孢镰刀菌细胞内容物渗出的影响

图 5 空气放电处理对胞内电解质渗出的影响Fig. 5 Effect of air discharge on electrolyte release
由图5可见,3 个处理组中,ozone处理组和ozone+NAI处理组在不同处理时间菌液电导率均显著高于CK组(P<0.05),而NAI处理组无明显变化。处理12 h时,ozone+NAI复合处理作用效果优于ozone单独处理(P<0.05)。说明ozone和ozone+NAI处理对F. oxysporum的细胞膜有显著的破坏作用,导致小分子电解质渗出,致使细胞外液电导率显著增加。
由图6可见,ozone处理组和ozone+NAI处理组在不同处理时间菌液在260 nm波长处的吸光度均显著高于CK组(P<0.05),说明核酸和蛋白质等大分子物质透过细胞膜从菌体渗出行为显著增加,且ozone+NAI复合处理作用效果强于ozone单独处理(P<0.05),而NAI处理组吸光度无明显变化。此结果与前述空气放电处理对胞内电解质渗出的影响趋势一致。进一步证明空气放电处理可破坏尖孢镰刀菌细胞膜完整性,这与空气处理破坏莲藕采后腐败菌镰刀菌M4细胞膜,导致电解、核酸和蛋白质等大分子物质渗出的结论一致[16]。
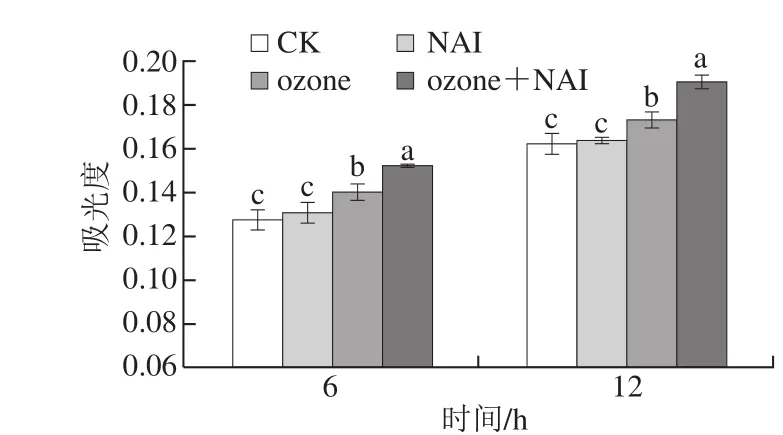
图 6 空气放电处理对胞内大分子物质渗出的影响Fig. 6 Effect of air discharge on release of intracellular macromolecules
2.6 空气放电对尖孢镰刀菌细胞膜流动性的影响
细胞膜由磷脂双分子层和贯穿、镶嵌在其中及吸附在其表面的蛋白质组成。膜的流动性主要指膜脂肪酸链部分及膜蛋白的运动状态。荧光探针DPH可以轻松地与细胞质膜中磷脂的脂烃链区结合而不破坏细胞膜的完整性,结合后由于介质黏度增加,顺反异构化受到抑制而成为唯一能发光的全反构型[22]。DPH标记成功后,荧光强度增强。
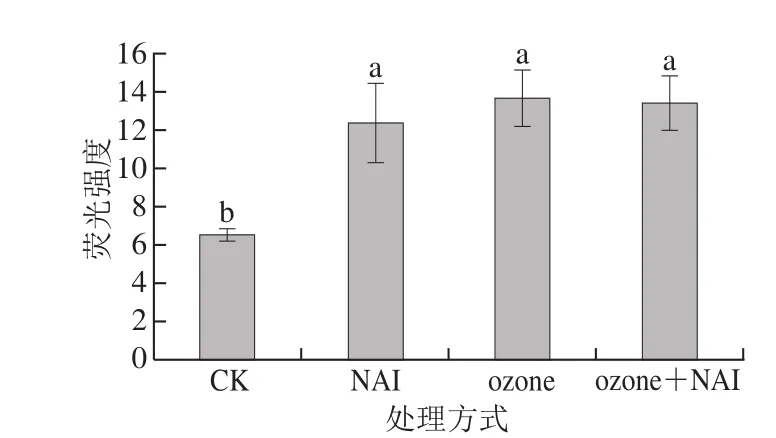
图 7 空气放电对尖孢镰刀菌细胞膜流动性的影响Fig. 7 Effect of air discharge on cell membrane fluidity of F. oxysporum
DPH荧光强度降低表明结构有序性低或细胞膜流动性高[18,23]。由图7可知,与CK组相比,3 个处理组DPH荧光强度均显著增强(P<0.05),表明空气放电处理导致细胞膜流动性显著降低,与弱磁场促使樟芝菌丝体细胞膜流动性增加的作用不同[22]。细胞膜上不饱和脂肪酸组分的过氧化是引起膜流动性下降的主要因素[24],细胞膜结构受损,通透性增强,可能导致膜孔的产生,影响膜正常的流动性[25],结合空气放电处理后,F. oxysporum细胞膜中不饱和脂肪酸与饱和脂肪酸比值显著降低[8],通透性增强(图5),表明膜结构的破坏导致膜功能的丧失。
2.7 空气放电对尖孢镰刀菌细胞膜电位的影响
DiBAC4(3)是一种细胞膜电位敏感的亲脂性阴离子荧光染料,进入细胞与胞浆内的蛋白质结合后才发出荧光,细胞膜电位降低时荧光染料DiBAC4(3)内流增加,从而可以检测到荧光强度的增加,反之亦然[26-27]。
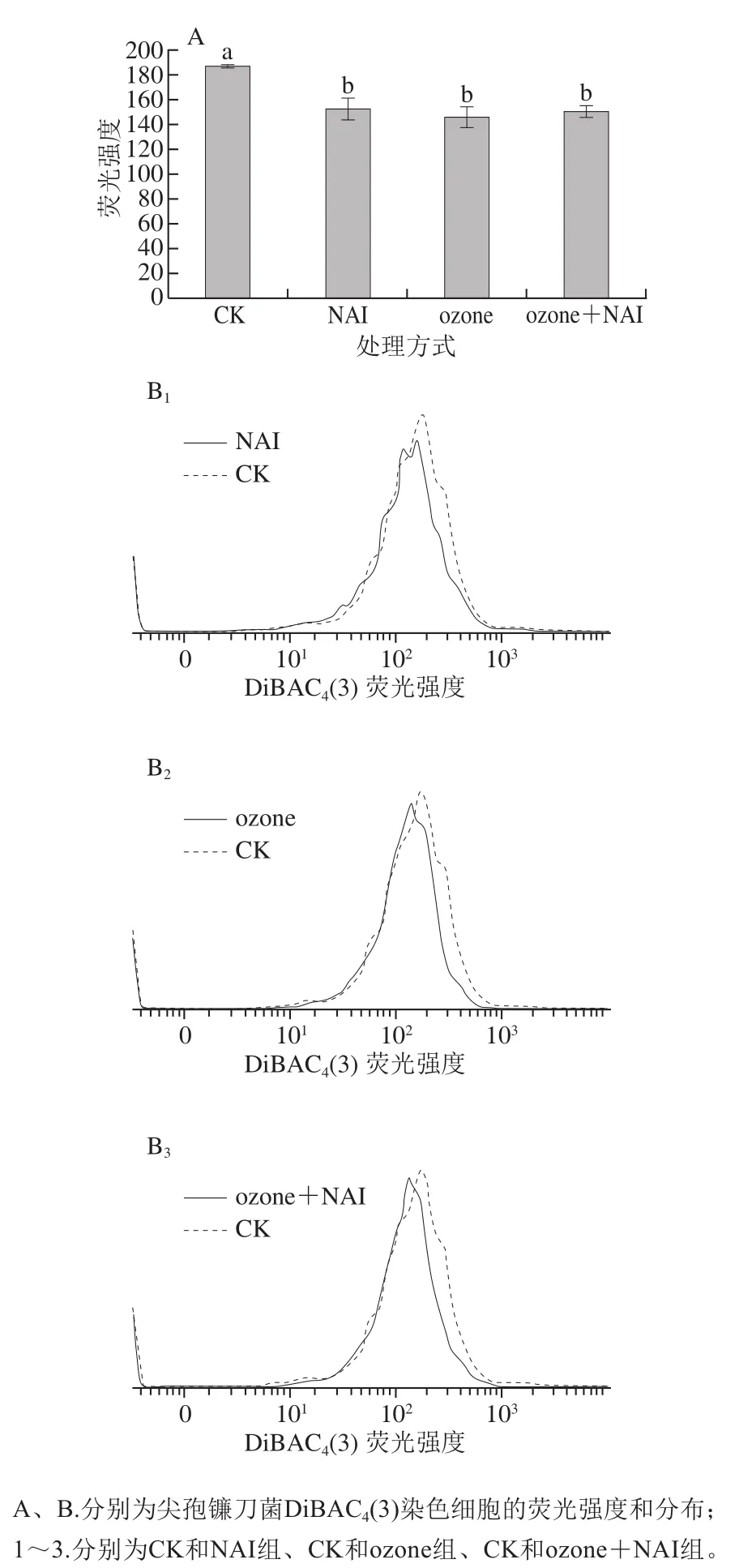
图 8 空气放电对尖孢镰刀菌细胞膜电位的影响Fig. 8 Effect of air discharge on membrane potential of F. oxysporum
如图8A所示,与CK组相比,处理组细胞DiBAC4(3)荧光强度显著减弱(P<0.05),表明空气放电处理促使细胞内的电位降低,诱导细胞超极化。这可能与细胞膜磷脂双分子层结构被破坏,通透性增强,金属离子外流有关[28]。
染色细胞分布图8B中,相对于CK组,处理组染色细胞分布曲线均发生一定程度的左移,细胞整体荧光强度减弱,与图8A中结果一致。
3 讨 论
空气放电主要是发挥臭氧和负离子的抑菌作用。臭氧的抑菌活性源于对细胞重要组分的氧化作用。臭氧已被证明攻击细菌的许多成分,包括蛋白质、细胞膜上的不饱和脂肪酸和呼吸酶,细胞质内的肽聚糖、酶和核酸,以及孢衣和病毒衣壳上蛋白质和肽聚糖[29]。对于真菌杀灭的机理可能为臭氧破坏了真菌的细胞壁,进而破坏了细胞膜,使得细胞内容物渗出,细胞裂解,最终导致真菌的彻底死亡[30]。空气放电过程中产生的负离子在空气中形成的电荷密度可能会改变细胞表面电荷,影响细胞壁结构和功能,进而破坏细胞膜的完整性[8]。
细胞膜是细胞抵御外界刺激的首道屏障,发挥着维持细胞完整性、物质运输、受体和信息传递等重要作用,其完整性(通透性)和流动性的改变,与维持细胞的正常代谢和生理功能密切相关。本实验在空气放电处理对尖孢镰刀菌具有抑制作用的基础上研究发现空气放电处理后尖孢镰刀菌正常代谢活动紊乱,包括菌丝物质代谢平衡被破坏、呼吸强度减弱、耗氧量降低、ATP合成减少等;同时尖孢镰刀菌细胞膜完整性受到破坏,通透性增大、流动性降低、膜电位增加,证明细胞膜是空气放电发挥抑菌作用的靶点之一。结果还表明臭氧与负离子之间具有协同作用,与单独处理相比,ozone+NAI处理组更能有效破坏尖孢镰刀菌细胞膜结构。

