鸭油的体外抗氧化活性分析
龙 霞,宁俊丽,黄先智,丁晓雯,
(1.西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,食品科学与工程国家级实验教学示范中心,重庆 400716;2.西南大学科技处,重庆 400715)
人或动物细胞在受到氮氧化合物、病原体等刺激后,氧化系统和抗氧化系统的平衡被打破,使机体积累大量活性氧[1]。活性氧可以攻击生物体内的蛋白质、脂质、DNA等生物大分子,最终导致机体产生氧化应激作用,从而导致诸如动脉粥样硬化、心血管疾病、癌症等慢性病的发生[2-3]。研究表明,油酸[4-5]、亚油酸[6-7]、亚麻酸[8]、VE[9-10]等具有抗氧化作用,可改善机体的氧化应激能力,如富含不饱和脂肪酸的猕猴桃籽油对DNA有保护作用[11],植物多酚能降低H2O2诱导的肌纤维蛋白氧化损伤[12]。与鸭油同为禽类油脂,不饱和脂肪酸质量分数达65%的鹅油具有改善氧化应激的作用,如张佰帅等[13]的研究表明,鹅油能使小鼠的总抗氧化能力提高73.95%;刘金枝[14]的研究也表明,鹅油能使卵巢切除大鼠的总抗氧化能力提高19.63%;韩海娜[15]的研究表明鹅油甘油二酯微胶囊能使大鼠的抗氧化能力提高21.88%。
鸭油是鸭屠宰过程中的副产品,主要从板油、腹部脂肪组织、皮下组织、肝脏等组织中经提炼、加工而成的固态或半固态脂类[16]。有研究表明,鸭油以棕榈酸、棕榈油酸、油酸、亚油酸、亚麻酸为主,不饱和脂肪酸质量分数可达70.30%,接近维持人体健康的理想值[17-21]。关于含有大量油酸、亚油酸等不饱和脂肪酸的鸭油是否能抵抗活性氧对脂质、蛋白质、DNA等生物大分子的影响报道极少。因此,本实验通过测定鸭油的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)自由基清除率、铁还原能力(ferric ion reducing antioxidant power,FRAP)、氧自由基吸收能力(oxygen radical absorbance capacity,ORAC),评价鸭油在体外是否具有抗氧化活性;通过测定鸭油对β-胡萝卜素褪色的抑制率、对蛋白质的影响、对DNA的保护潜力,评价鸭油在体外对生物大分子抗氧化能力的影响,为鸭油的深入开发利用提供依据。
1 材料与方法
1.1 材料与试剂
鸭油为实验室自提:鸭油与石油醚质量体积比为1∶5,加入体积分数0.015%的叔丁基对苯二酚(tertiary butylhydroquinone,TBHQ),于360 W、30 ℃条件下超声提取43 min,将提取液于60 ℃旋蒸,去除石油醚得到粗提取鸭油。将粗提取的鸭油加入1%质量分数为75%的磷酸脱胶,加入2%的白陶土脱色,95 ℃旋转蒸发3 h脱臭后得到精炼鸭油。精炼鸭油的酸价为(0.96±0.03)mg/g,过氧化值为(0.085±0.010)g/100 g,符合GB 10146—2015《食品安全国家标准 食用动物油脂》[22]的要求。
TBHQ(纯度大于99%) 南京道斯夫生物科技有限公司;1,1-二苯基-2-三硝基苯肼 美国Sigma公司;Gene Green核酸染料 北京鼎国昌盛生物技术有限责任公司;FeCl3、FeSO4、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、盐酸胍、乙酸乙酯 上海麦克林生化科技有限公司;荧光素钠(fluorescein sodium,FL)、β-胡萝卜素、亚油酸上海Aladdin公司;三吡啶三吖嗪(tripyridyl-triazine,TPTZ)、水溶性VE(Trolox)、2,2’-偶氮二(2-脒基丙烷)二盐酸盐(2,2’-azobis[2-methylpropionamidine]dihydrochloride,AAPH)、牛血清白蛋白(bovine serum albumin,BSA)、哌嗪-N,N’-双(2-乙磺酸)(piperazine-1,4-bisethanesulfonic acid,PIPES)、pUC19质粒DNA、琼脂糖、10×Loading buffer、50×TAE电泳缓冲液北京索莱宝公司。
1.2 仪器与设备
Symergy H1酶标仪 美国伯腾仪器有限公司;5811DK离心机 德国Eppendorf公司;真空旋转蒸发器;DYY-6D DNA凝聚电泳仪 北京六一生物科技有限公司;Geno Sens 1860 Gel Documentation System 上海勤翔科学仪器有限公司;XW-80A微型旋涡混合仪上海沪西仪器厂有限公司;RE52CS-1旋转蒸发器上海亚荣生化仪器厂;pHS-3C+智能酸度计 成都世纪方舟科技有限公司。
1.3 方法
1.3.1 样品的制备
鸭油富含不饱和脂肪酸,在提取、精炼过程中易被氧化,因此从鸭油的加工开始就需要加入抗氧化剂。根据本实验室前期的研究,加入TBHQ(添加量为鸭油质量的0.015%)作为鸭油抗氧化剂的效果最好。提取、精炼得到的鸭油置于棕色瓶中4 ℃保存备用。
不同质量浓度纯鸭油:用无水乙醇将精炼鸭油(提取过程中不加抗氧化剂)分别配制为质量浓度5、10、15、20、25、30、35 mg/mL的溶液。
不同质量浓度鸭油+TBHQ:用无水乙醇将精炼鸭油(提取过程中加0.015%的TBHQ作抗氧化剂)分别配制为质量浓度5、10、15、20、25、30、35 mg/mL的溶液。
不同质量浓度TBHQ:用无水乙醇将TBHQ分别配制为与鸭油中所含质量浓度相同的溶液,即0.75、1.5、2.25、3、3.75、4.5、5.25 μg/mL。
1.3.2 DPPH自由基清除率的测定
参照文献[23]的方法并作适当修改。1.0 mL浓度为0.093 mmol/L DPPH-无水乙醇溶液与1.0 mL样品混匀,室温避光放置30 min。空白组以1.0 mL无水乙醇代替DPPH溶液,相同方法处理。1.0 mL无水乙醇代替样品,相同方法处理,作为对照组。于517 nm波长处测定吸光度,DPPH自由基清除率计算见式(1)。
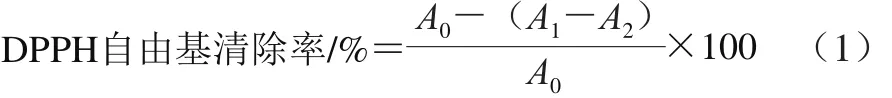
式中:A0为对照组吸光度;A1为样品组吸光度;A2为空白组吸光度。
1.3.3 FRAP的测定
参照Martínez等[24]的方法略作修改。取1.0 mL不同质量浓度的鸭油或TBHQ溶液,加入2.0 mL FRAP试剂混匀[25],于37 ℃水浴30 min,5 000×g离心10 min后于595 nm波长处测吸光度。将吸光度带入硫酸亚铁标准曲线,获取相应的硫酸亚铁浓度定义为FRAP,单位为μmol/L。
绘制FeSO4标准曲线:取1.0 mL浓度分别为25、50、100、200、400、800、1 000 μmol/L的FeSO4溶液,按测定样品方法处理后测定吸光度,以FeSO4浓度作横坐标,以吸光度为纵坐标绘制标准曲线并得线性回归方程。
1.3.4 β-胡萝卜素褪色抑制率的测定
参照Shon等[26]的方法略作修改。在96 孔微孔板中,加入50 μL不同质量浓度的鸭油或TBHQ溶液、200 μL β-胡萝卜素-亚油酸乳化液。对照孔以无水乙醇代替样品,做同样处理。50 ℃、80 r/min摇床混匀1 min,于470 nm波长处测定反应0、120 min后的吸光度,分别记为A0和A120,ΔA=A0-A120。不同质量浓度的样品对β-胡萝卜素-亚油酸乳化液褪色的抑制率的计算见式(2)。
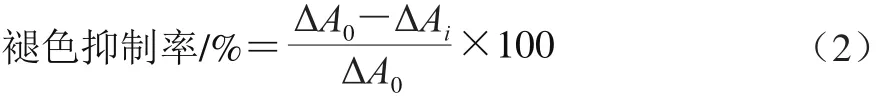
式中:ΔA0表示对照孔的吸光度变化量;ΔAi表示加入样品的吸光度变化量。
1.3.5 鸭油抗氧化能力指数的测定
参照赵建[27]、续洁琨[28]等的方法测定ORAC,在黑色96 孔微孔板中加20 μL不同质量浓度的鸭油或TBHQ或Trolox标准溶液,再加入20 μL浓度为63 nmol/L的FL使用液,37 ℃孵育5 min后加6 mmol/L的AAPH溶液140 μL。以激发波长485 nm、发射波长538 nm,4 min/次的条件测定各孔荧光强度,连续测定2 h,整个测定过程保持37 ℃。同时测定FL荧光自然衰减对照(-AAPH)即未添加自由基,溶剂对照(+AAPH)即未添加样品。
1.3.6 鸭油对蛋白羰基的影响
参照曹云刚[12]、Park[29]等的方法,以15 mmol/L的PIPES缓冲液(pH 6.0)构建氧化体系,使FeCl3浓度为0.01 mmol/L,VC浓度为0.1 mmol/L,H2O2浓度1 mmol/L。将BSA分散于上述氧化体系中(终质量浓度为40 mg/mL),加入鸭油或TBHQ,鸭油加入量分别为:1、2、3、4、5、6 mL/g,以BSA质量计。密封后于4 ℃氧化12 h,用1 mmol/L乙二胺四乙酸终止反应,同时以未加H2O2作空白组,以未加样品作为对照组。采用“国食药监保化[2012]107号”文中《关于印发抗氧化功能评价方法等9 个保健功能评价方法的通知》[30]的方法测定反应液中蛋白羰基含量。不同浓度样品对氧化生成蛋白质羰基的抑制率见式(3)。

1.3.7 鸭油对DNA保护潜力的测定
参照Zhang Yuan等[31]的方法,在微型离心管中加入5 μL质量浓度为60 ng/μL的pUC19质粒DNA,2 μL 30%的H2O2和5 μL不同质量浓度的鸭油(0.2、0.4、0.6、0.8、1 mg/mL)或TBHQ溶液(与鸭油中所含的质量浓度相同),310 nm的紫外光下辐射10 min后,载入1%的琼脂糖,在电压220 V、电流190 mA条件下电泳10 min。以蒸馏水代替样品作为氧化组(不加样品保护)。以蒸馏水代替H2O2且不经过紫外线辐射作为空白组(不经氧化处理)。用Image Lab软件分析DNA含量。不同质量浓度样品对DNA的保护作用率见式(4)。

1.4 数据统计与分析
所有实验均重复3 次以上,结果用 ±s表示。采用SPSS 24.0、Excel 2016软件进行数据分析,Origin 2018软件作图,Image Lab软件处理电泳图像。数据采用单因素方程分析——最小显著性差异(least significant difference,LSD)检验进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 鸭油对DPPH自由基的清除作用
DPPH自由基是以氮为中心稳定的自由基。加入抗氧化剂后反应体系在517 nm波长处的吸光度下降,下降率越高代表样品对DPPH自由基的清除能力越强。因该法稳定、快速,已被广泛应用于评价抗氧化能力[32]。采用该法测定不同质量浓度鸭油对DPPH自由基的清除率见图1。

图 1 不同质量浓度鸭油对DPPH自由基的清除率Fig. 1 DPPH radical scavenging capacity of duck lipids at different concentrations
由图1可知,纯鸭油、TBHQ、鸭油+TBHQ对DPPH自由基都具有清除作用,且随着质量浓度的增加,它们对DPPH自由基清除率也在增加。鸭油+TBHQ组对DPPH自由基的清除率高于同质量浓度纯鸭油、同质量浓度TBHQ的清除率,且差异均显著(P<0.05)。加有TBHQ的鸭油质量浓度为35 mg/mL时,对DPPH自由基的清除率可达(78.81±2.96)%;其中所含TBHQ对DPPH自由基的清除率为(47.27±2.76)%。纯鸭油质量浓度为35 mg/mL时,对DPPH自由基的清除率为(23.19±4.18)%;由此推测,加TBHQ能够提高鸭油对DPPH自由基的清除作用可能是TBHQ与鸭油的协同作用的结果。通过SPSS 24.0软件分析证明,鸭油对0.093 mmol/L的DPPH自由基的半抑制质量浓度(half maximal inhibitory concentration,IC50)为(15.03±0.53)mg/mL,接近于Bennett等[33]对鸭油的测定结果,但低于鱼油对DPPH自由基清除作用的IC50[34]。不同质量浓度鸭油在5~25 mg/mL范围内对DPPH自由基的清除率差异不显著,可能因为低质量浓度的纯鸭油清除能力较低。不同质量浓度的鸭油+TBHQ组DPPH自由基清除率差异显著,可能是TBHQ提高了鸭油对DPPH自由基的清除能力所致。
2.2 鸭油的FRAP
FRAP是抗氧化物在酸性环境还原Fe3+-TPTZ产生蓝紫色Fe2+-TPTZ的能力,其可作为样品中总抗氧化能力的评价指标[35-36]。通常,物质对Fe3+-TPTZ的还原能力与抗氧化能力成正相关[37]。测定不同质量浓度鸭油的铁还原能力结果如图2所示。
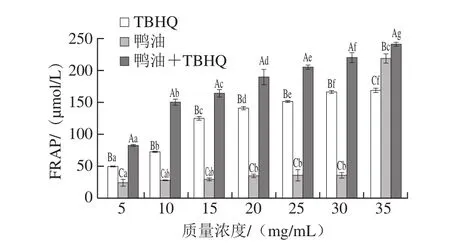
图 2 不同质量浓度鸭油的FRAPFig. 2 FRAP values of duck lipids at different concentrations
由图2可知,纯鸭油、TBHQ、鸭油+TBHQ都有一定的FRAP,且随着质量浓度的增加,其FRAP也在增加。不同质量浓度鸭油+TBHQ的FRAP显著高于同质量浓度纯鸭油和TBHQ的FRAP,纯鸭油质量浓度为35 mg/mL时,其FRAP为(219.87±3.06)μmol/L,而同质量浓度鸭油所含TBHQ的FRAP为(169.53±4.04)μmol/L,鸭油+TBHQ的FRAP为(241.87±3.06)μmol/L,表明TBHQ对鸭油的铁还原能力有一定的促进作用。纯鸭油质量浓度在5~30 mg/mL时,其FRAP显著低于35 mg/mL的(219.87±3.06)μmol/L,表明低质量浓度鸭油的铁还原能力较低。不同质量浓度的鸭油+TBHQ的FRAP差异显著,可能是TBHQ提高了鸭油的铁还原能力。
2.3 鸭油的抗氧化能力指数
抗氧化能力指数是评估物质总抗氧化能力的国际方法,是美国农业部、国家卫生院、食品药品监督管理局评价物质抗氧化能力的重要标准[38]。在该测定方法中,抗氧化物质存在时的荧光衰退曲线下面积与无抗氧化剂存在时的荧光衰退曲线下面积之差表示抗氧化剂的保护面积(net area under curve,Net AUC)[39]。Net AUC越大,抗氧化剂对荧光物质的保护作用越强。不同质量浓度鸭油的Net AUC如图3所示。
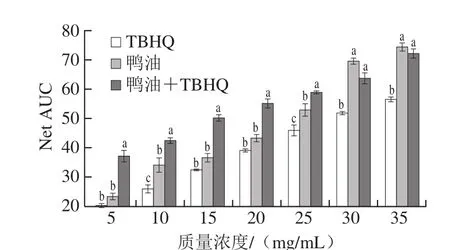
图 3 不同质量浓度鸭油的Net AUCFig. 3 Net AUC of duck lipids at different concentrations
由图3可知,随着纯鸭油、TBHQ、鸭油+TBHQ质量浓度的增加,它们的Net AUC也在增加,鸭油+TBHQ组、纯鸭油组的Net AUC显著高于TBHQ组,表明鸭油能显著延缓FL荧光的衰退。纯鸭油、鸭油+TBHQ的质量浓度在5~25 mg/mL时,鸭油+TBHQ组的Net AUC显著高于纯鸭油;在30~35 mg/mL时,Net AUC虽低于鸭油组,但差异不显著,表明TBHQ可能会增强鸭油对FL荧光的保护作用。
抗氧化剂的抗氧化能力指数(ORAC)是抗氧化剂的荧光衰退曲线保护面积与标准抗氧化物质的保护面积之比,代表样品对自由基的抗氧化能力,其越高代表抗氧化能力越强。不同质量浓度鸭油的ORAC见表1。
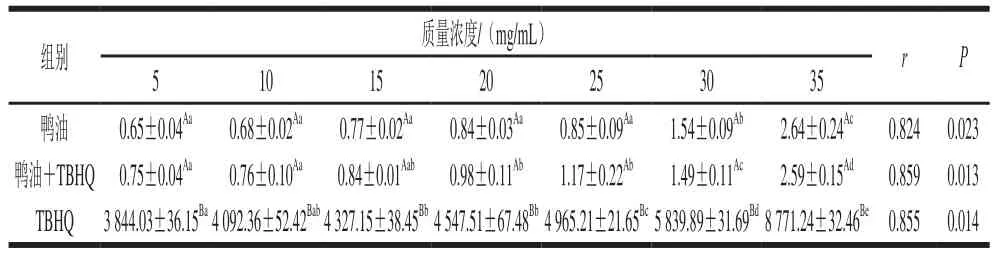
表 1 不同质量浓度鸭油的ORAC及相关性Table 1 ORAC values of duck lipids at different concentrations and correlation analysis
由表1可知,纯鸭油、TBHQ、鸭油+TBHQ均具有一定的ORAC,随着其质量浓度的升高,ORAC也在增加。用SPSS软件进行相关性分析发现,(P<0.05)浓度与ORAC的r>0.800,P<0.05,表明它们的抗氧化能力与浓度存在显著正相关。纯鸭油质量浓度在5~25 mg/mL的范围内,其各质量浓度的ORAC差异不显著,质量浓度增加至35 mg/mL时,差异显著。TBHQ的各组ORAC显著大于同浓度的纯鸭油组、鸭油+TBHQ组,可能与TBHQ是强抗氧化剂有关。
2.4 鸭油对β-胡萝卜素褪色的抑制作用
β-胡萝卜素-亚油酸体系中的亚油酸自动氧化生成的过氧化自由基会使黄色的β-胡萝卜素褪色,当体系中有抗氧化剂时,则β-胡萝卜素的褪色受到抑制,可评价样品在乳化体系中的抗氧化能力[40-41]。不同质量浓度鸭油对β-胡萝卜素的褪色抑制作用如图4所示。
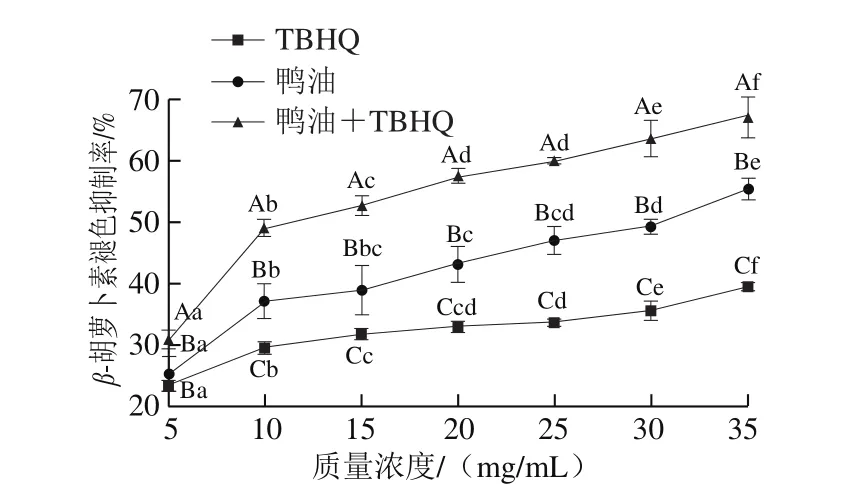
图 4 不同质量浓度鸭油对β-胡萝卜素的褪色抑制率Fig. 4 Inhibition rates of β-carotene degradation by duck lipids at different concentrations
由图4可知,纯鸭油、TBHQ、鸭油+TBHQ对β-胡萝卜素褪色均有明显的抑制作用,且随着质量浓度的增加,它们的抑制作用增强。TBHQ对β-胡萝卜素褪色的抑制作用均显著低于纯鸭油和鸭油+TBHQ的。加有TBHQ的鸭油质量浓度为35 mg/mL时,对β-胡萝卜素褪色的抑制率可达(67.29±3.37)%,纯鸭油的抑制率为(55.47±1.76)%,TBHQ的抑制率仅为(39.61±0.76)%,表明TBHQ有助于增强鸭油对β-胡萝卜素褪色的抑制能力。
2.5 鸭油抗蛋白质氧化损伤能力
蛋白质在自由基、氧化物作用下,肽链断裂、氨基酸残基侧链氧化修饰,其结构发生变化而导致氧化损伤[42-43]。蛋白质羰基是蛋白质氧化损伤的重要标志物,测定其含量可判断蛋白质是否被氧化[44],蛋白质羰基含量越高表示蛋白质被氧化的程度越严重,而受试物抗蛋白氧化的能力越低。不同质量浓度鸭油对蛋白质羰基生成抑制率的结果见图5。
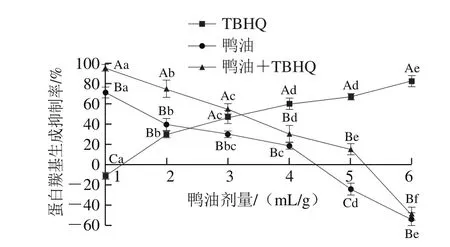
图 5 不同鸭油加入量对BSA羰基含量的影响Fig. 5 Effect of duck lipids at different concentrations on carbonyl content of BSA
由图5可知,纯鸭油、鸭油+TBHQ的蛋白羰基生成抑制率随着其剂量的增加而降低,即随着它们剂量的增加蛋白质生成的羰基越多,表明鸭油、鸭油+TBHQ可能会促进BSA氧化。当鸭油+TBHQ剂量为6 mL/g时,会导致BSA羰基含量增加(50.00±3.21)%;纯鸭油剂量为6 mL/g蛋白时,会导致BSA羰基含量增加(50.71±1.57)%。TBHQ组的蛋白质羰基生成抑制率随着其剂量的增加而增强,蛋白质羰基含量减少,表明TBHQ浓度越高,对BSA的保护作用越强。鸭油+TBHQ剂量为1~3 mL/g时,其蛋白羰基生成抑制率显著高于同剂量纯鸭油的,可能是TBHQ在一定程度上会抑制鸭油对BSA的损伤。纯鸭油剂量在1~4 mL/g范围内,可以抵抗BSA的氧化应激,随着剂量的增加,其抵制作用显著下降,当剂量在5~6 mL/g时,促进BSA氧化;鸭油+TBHQ剂量在1~5 mL/g范围内,可以抵制BSA的氧化应激,随着剂量的增加,其抵制作用显著降低,当剂量在6 mL/g时,促进BSA氧化;不同剂量的TBHQ对BSA的保护作用显著升高,提示TBHQ可能会降低鸭油对BSA的氧化。
2.6 鸭油对DNA的保护潜力
生物体内的活性氧自由基可导致DNA链断裂、DNA位点突变、DNA双链畸变、原癌基因突变、肿瘤抑制基因突变等形式的DNA损伤[17]。为探究鸭油对紫外线辐照DNA是否有保护作用,对不同质量浓度的鸭油进行了DNA保护潜力测定,结果见图6。

图 6 不同质量浓度鸭油对DNA的保护作用Fig. 6 Protection against DNA damage of duck lipids at different concentrations
质粒DNA为环状超螺旋结构,当受到外界环境损伤(如自由基、紫外辐射、强热等)时,环状超螺旋结构受到破坏,可能降解为未知分子质量的碎片[45]。pUC19质粒DNA在琼脂糖凝胶上产生条带的明暗程度表示未被破坏DNA含量的多少,条带越亮表明DNA被破坏的程度越轻,越暗表明DNA被破坏的程度越严重[31]。如图6A所示,泳道11条带明显暗于泳道12,表明DNA经过紫外照射、H2O2处理后其环状结构受到破坏。鸭油+TBHQ组泳道的DNA条带亮度比泳道11亮,比泳道12暗,表明鸭油+TBHQ对DNA有一定的保护作用。如图6B所示,纯鸭油组泳道3~7的DNA条带明显亮于图6A中TBHQ组泳道1~4的,表明鸭油对DNA的保护作用更强一些。
为进一步分析鸭油对DNA的保护潜力,分析了各泳道中DNA含量,根据公式(4)计算出各样品对DNA的保护率,结果见图7。
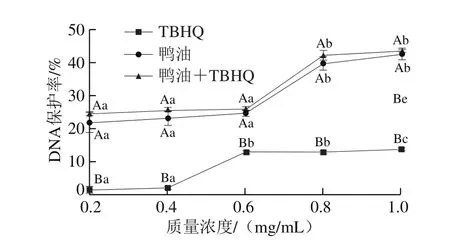
图 7 各实验组对DNA的保护率Fig. 7 Protection rates against DNA damage of TBHQ and duck lipids with and without added TBHQ
图7 通过DNA保护率反映各实验组对DNA的保护作用,其值越高,表示样品对DNA的保护作用越好。由实验结果可知,随着纯鸭油、鸭油+TBHQ质量浓度的增加,DNA保护率也在提高,表明纯鸭油、加TBHQ的鸭油对DNA都有明显的保护作用,且二者对DNA的保护作用差异不显著,但均显著高于TBHQ的保护作用,表明纯鸭油、含有TBHQ的鸭油可以降低DNA被氧化的程度。纯鸭油、鸭油+TBHQ的质量浓度在0.2~0.6 mg/mL范围内对DNA保护率差异不显著,但当质量浓度增加后,差异显著,可能是较低质量浓度的鸭油、鸭油+TBHQ对DNA的保护作用较弱。
3 讨 论
本实验结果表明,较高质量浓度的鸭油可能会促进BSA氧化,使其蛋白质羰基含量增加。目前已有研究表明氧化后的脂质会促进蛋白质氧化,如Li Binbin等[46]的研究表明,氧化脂质可能诱导蛋白质发生更严重的氧化;Park等[29]研究表明,FeCl3/VC/H2O2氧化体系中的H2O2可能会攻击脂质产生烷氧基,从而促进蛋白质氧化;Stadtman等[47]的研究表明脂质氧化过程中形成的过氧自由基可以从蛋白质分子中提取氢原子,导致类似于脂质氧化的自由基介导的链式反应。因此,在本实验中,可能是由于FeCl3/VC/H2O2氧化体系中的H2O2攻击鸭油,导致鸭油氧化后形成自由基,继而攻击BSA,使BSA的蛋白羰基含量增加。
由于鸭油的不饱和脂肪酸含量较高,在提取、精炼过程中易被氧化,因此需加入抗氧化剂TBHQ控制其发生氧化。本实验在评价鸭油的抗氧化能力时,同时测定了不同质量浓度鸭油中对应质量浓度TBHQ的抗氧化能力。但是,鸭油的分离提取会经粗提、高温精炼等过程,精炼可使鸭油中的TBHQ质量浓度降低,其抗氧化性可能也会改变,从而导致未经过高温处理的相应质量浓度鸭油中TBHQ抗氧化性结果偏高。即使在TBHQ结果偏高的情况下,除对蛋白的影响外,鸭油抗氧化的各指标均比TBHQ高,且差异显著,表明鸭油本身具有改善生物大分子氧化应激的能力。
鸭油的抗氧化性可能与其所含有不饱和脂肪酸有关。本实验室测得实验所用鸭油的不饱和脂肪酸质量分数为(56.33±0.13)%,其中油酸为(30.63±0.58)%,亚油酸为(17.2±0.26)%。油酸、亚油酸对机体有辅助抗氧化作用[48]。Kim[49]和Al-Shudiefat[50]等的研究表明,油酸可降低机体的活性氧水平而增强抗氧化作用。Park等[51]研究了发酵鱼油对UVB诱导的细胞氧化损伤的保护作用,认为是发酵鱼油中的油酸清除活性氧并吸收UVB而具有抗氧化作用。因此,鸭油具有抗氧化活性可能是因其含有较高的不饱和脂肪酸。
4 结 论
本实验通过测定不同质量浓度鸭油的DPPH自由基清除能力,铁还原能力、抗氧化能力指数、抑制β-胡萝卜素褪色能力、对DNA的保护潜力,对蛋白质羰基的影响,研究了鸭油的体外抗氧化能力,结果表明,鸭油具有一定的体外抗氧化活性,能抵制生物大分子脂质、DNA的氧化应激,且在一定质量浓度范围内,质量浓度越高,抗氧化性越好。

